三维经食管超声心动图在经导管主动脉瓣植入术中的应用研究
赵维鹏,潘翠珍,魏 来,潘文志,周达新,舒先红(复旦大学附属中山医院上海市心血管病研究所 .心超室;.心外科;.心内科 200032)
三维经食管超声心动图在经导管主动脉瓣植入术中的应用研究
赵维鹏a,潘翠珍a,魏 来b,潘文志c,周达新c,舒先红a
(复旦大学附属中山医院上海市心血管病研究所 a.心超室;b.心外科;c.心内科 200032)
目的 探讨三维经食管超声心动图在经导管主动脉瓣植入术中的应用价值。方法 对16例严重主动脉瓣病变患者分别经由两种不同手术入径行经导管主动脉瓣植入术(transcatheter aortic valve implantation,TAVI),其中7例重度主动脉瓣狭窄(主动脉瓣狭窄面积<1.0 cm2,主动脉瓣口最大流速≥4 m/s,平均跨瓣压差≥40 mmHg)和1 例人工生物主动脉瓣中重度反流患者行经股动脉TAVI,另外4例重度主动脉瓣狭窄和4例重度主动脉瓣反流患者行经心尖TAVI,术前均行常规经胸超声心动图检查及三维经食管超声心动图检查,术中三维经食管超声心动图监测,术后常规经胸超声心动图随访。结果 经股动脉TAVI组:所有患者均成功经导管植入人工生物主动脉瓣,其中1例患者术中发现心包填塞合并升主动脉夹层分离。经心尖TAVI组:所有患者均成功植入人工生物主动脉瓣,无并发症发生。CT和经食管三维超声心动图测量主动脉瓣环最大径、最小径、瓣环面积及狭窄瓣口数据的比较,二者相关性良好,r值分别为0.99(瓣环最大径)、0.97(瓣环最小径)、0.98(瓣环面积)、0.99(狭窄瓣口面积);术前连续性方程测量的狭窄瓣口面积与CT及3D-TEE比较,二者相关性良好,r值均为0.99。结论 三维经食管超声心动图能快速、准确地测量主动脉瓣环的大小及评价主动脉的解剖结构,并且能实时引导、监测经导管人工生物主动脉瓣的植入。
主动脉瓣;三维超声心动图;介入
主动脉瓣疾病是一种常见的心脏瓣膜疾病。几十年来在体外循环下行主动脉瓣置换已经成为严重主动脉瓣病变的主要治疗手段,但仍存在手术创伤大、高危患者手术并发症发生率高的不足。近年来经股动脉或心尖途径的经导管主动脉瓣植入术(transcatheter aortic valve implantation,TAVI)是介入心脏病学研究的一个新领域,为临床主动脉瓣置换手术提供了一种崭新的治疗方法,它不仅适用于三叶主动脉瓣重度狭窄的高危患者,而且适用于先天性二叶式主动脉瓣重度狭窄的高危患者[1]。超声心动图在经导管TAVI术前、术中及术后均起着重要的作用,它不仅需要在介入术中进行实时引导和监测,而且在术前筛选以及术后随访评价中亦是不可或缺的。同时,随着实时三维经食管超声心动图的出现,多方位的三维剖面能提供更详细的主动脉瓣环解剖的信息,可以精准测量及评价主动脉瓣及相邻解剖结构,进而可指导选择最佳的人工瓣膜的尺寸规格[2]。本研究初步探讨三维经食管超声心动图在TAVI术中的应用价值。
1 资料与方法
1.1 一般资料 2010年5月至2014年10月因严重主动脉瓣病变就诊于我院的16例患者,均因常规外科开胸体外循环下行主动脉瓣置换手术风险高而选择经股动脉或经心尖TAVI手术。其中7例重度主动脉瓣狭窄(主动脉瓣狭窄面积<1.0 cm2,主动脉瓣口最大流速≥4 m/s,平均跨瓣压差≥40 mmHg)和1 例人工生物主动脉瓣中重度反流患者行经股动脉TAVI,另外4例重度主动脉瓣狭窄和4例重度主动脉瓣反流患者行经心尖TAVI。其中经股动脉TAVI组为2010年5月至2014年10月7例重度主动脉瓣狭窄(其中,包括先天性二叶式主动脉瓣畸形伴有重度主动脉瓣狭窄3例,主动脉瓣钙化伴重度主动脉瓣狭窄4例及人工生物主动脉瓣中重度反流1 例在我院心内科行经股动脉TAVI术,均为男性,年龄(77±4.5)岁。经心尖TAVI组为2014年3月至2014年10月7日主动脉瓣钙化伴重度主动脉瓣狭窄4例和主动脉瓣退行性改变伴重度主动脉瓣反流4例在我院心外科行经心尖TAVI术,其中男4例,女4例,年龄(78.2±3.62)岁。
1.2 图像采集方法 所有患者术前均行常规经胸超声心动图、三维经食管超声心动图检查、冠脉造影、主动脉、股动脉、髂动脉造影以及心脏计算机断层扫描。应用Philips iE33超声显像仪,S5-1经胸探头(频率1~5 MHz),X7-2经食管探头(频率2~7 MHz),模式包括常规二维多平面显像、彩色多普勒、频谱多普勒显像实时三维显像包括实时三维(Live 3D),实时三维聚焦放大显像(3D Zoom),全容积显像(Full volume)及实时三维彩色血流显像(Color RT 3DE)。然后将采集的资料储存到光盘,进行在机或脱机分析。①常规经胸超声心动图采集 受检者取左侧卧位或平卧位,连接心电图;应用S5-1探头进行常规经胸超声心动图检查并记录主动脉根部内径(AORD),左房内径(LAD),左室舒张末期内径(LVDD),左室收缩末期内径(LVDS),室间隔厚度(IVSD),左室后壁厚度(LVPWT);左室收缩功能(LVEF由Simpson方法估测);连续波多普勒定量主动脉瓣狭窄的峰值跨瓣压差(AS-PGmax)、平均跨瓣压差(AV-PGmean)及主动脉瓣的最大流速(AS-Vmax)、连续性方程估测主动脉瓣有效瓣口面积(AVA);连续波多普勒定量肺动脉收缩压评估肺动脉高压的程度以及评价其他瓣膜反流程度。② 经食管超声心动图采集 受检者取左侧卧位,连接心电图;患者咽喉部局麻后,应用X7-2探头缓慢插入食管进行经食管超声心动图检查并定量主动脉瓣环内径、左室流出道内径(LVOT)(距主动脉瓣环下1 cm处)、主动脉根部内径、主动脉窦管交界处内径、升主动脉近端内径(AAO)(距主动脉瓣环上4 cm处),主动脉瓣增厚、钙化的程度以及瓣膜的立体形态(图1)。并应用QLAB-3DQ软件定量主动脉瓣环的最大径及最小径、主动脉瓣环面积、AVA(图2)。所有患者在TAVI术中由经食管二维、三维超声心动图、透视以及造影引导和监测。当主动脉瓣严重狭窄时,导丝很难通过狭窄口,应用Live 3D的容积显像方式显示导丝和主动脉狭窄口的关系,同时应用x-Plane显像方式同时显示左室长轴切面及主动脉瓣水平短轴切面,指导导丝通过狭窄瓣膜口,而且经食管实时三维超声心动图能清晰显示输送导管、球囊的位置(图3)以及球囊充气及放气后主动脉瓣的形态和功能;最后经食管二维、三维超心动图引导及监测人工主动脉瓣植入以及实时监测并发症。所有患者在TAVI术后7天进行常规超声心动图检查,测量常规超声心动图资料及AS-Vmax、AS-PGmax、AV-PGmean、AVA以及人工主动脉瓣瓣周漏(Leak)和反流(AR)。
1.3 统计学方法 使用SPSS 17.0 统计分析软件,两种影像测量方法比较采用相关分析。P< 0.05 为差异有统计学意义。
2 结果
2.1 两组手术情况 两组患者均成功植入人工生物主动脉瓣。其中经股动脉TAVI组:术前超声心动图检查提示左房增大4例,左室内径正常上限3例,左室壁向心性肥厚6例,左室收缩功能正常6例,左室收缩功能减弱2例,见表1。本组7例主动脉瓣狭窄面积<1.0 cm2,7例主动脉瓣口最大流速> 4 cm/s,7例平均跨瓣压差> 40 mmHg,见表2.1例患者术中发现心包填塞合并升主动脉夹层分离,治疗无效3日后死亡。经心尖TAVI组:患者均成功经心尖植入人工生物主动脉瓣,无并发症发生。术前超声心动图检查提示左房增大2例,左室内径轻度增大2例,左室内径正常上限1例,室间隔轻度肥厚2例,左室收缩功能正常5例,左室收缩功能减弱3例。本组4例患者主动脉瓣狭窄面积<1.0 cm2,4例主动脉瓣口最大流速≥4 cm/s,4例平均跨瓣压差≥40 mmHg;4例患者重度主动脉关闭不全(表2)。
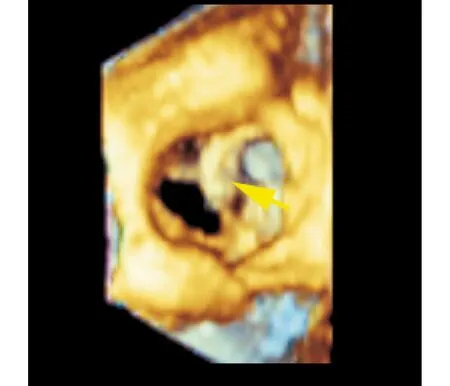
图1 经食管三维超声心动图影像改变 立体显示二叶式主动脉瓣的形态,显示瓣上钙化结节(箭头所示)
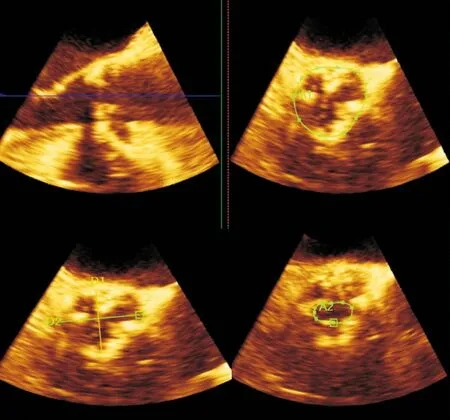
图2 经食管实时三维超声心动图及QLAB-3DQ软件定量主动脉瓣环的最大径及最小径(左下图)、主动脉瓣环面积(右上图)、主动脉瓣狭窄口面积(右下图)
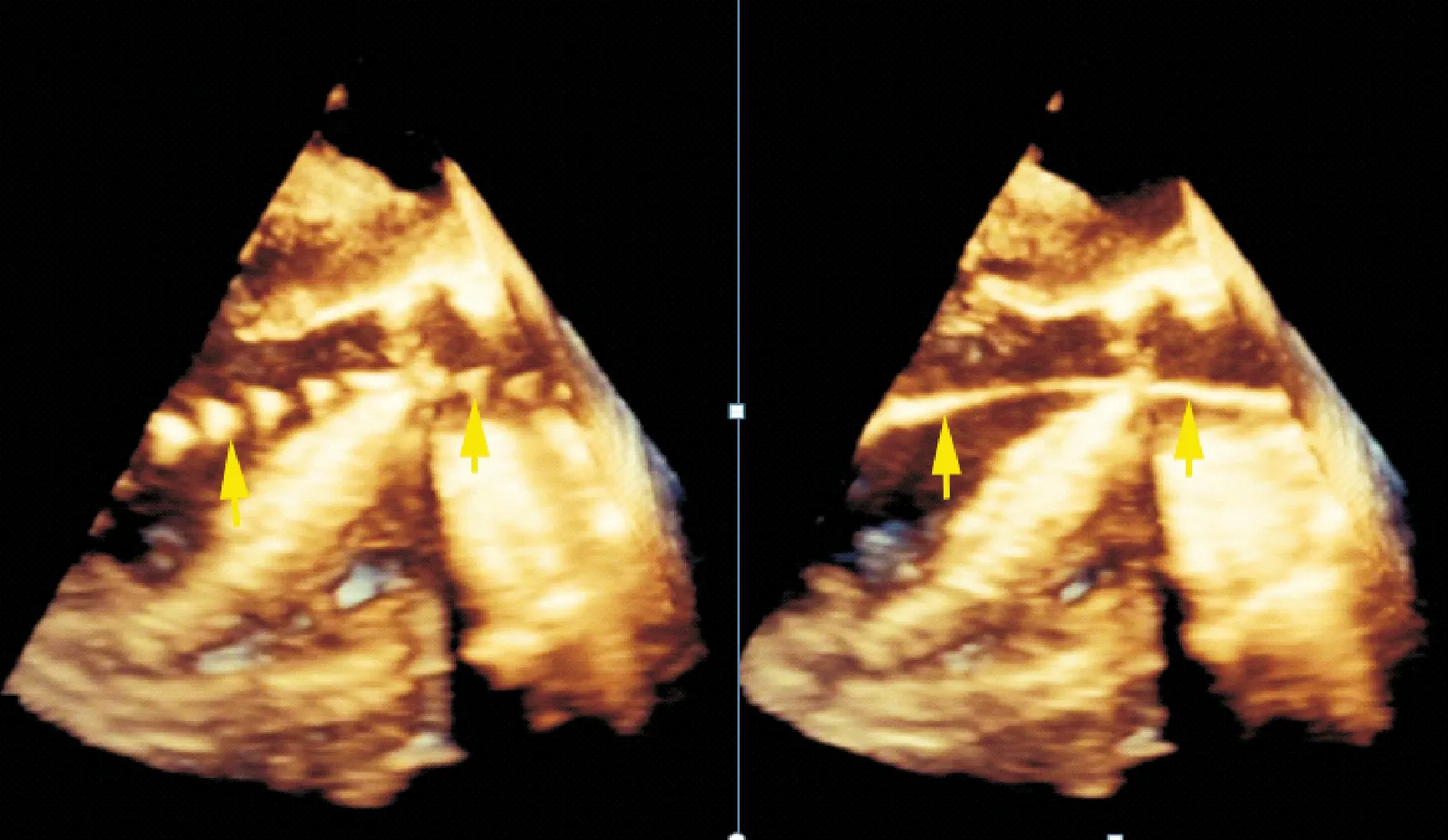
图3 经食管实时三维超声心动图 左室长轴切面清晰显示输送导管(箭头所示)
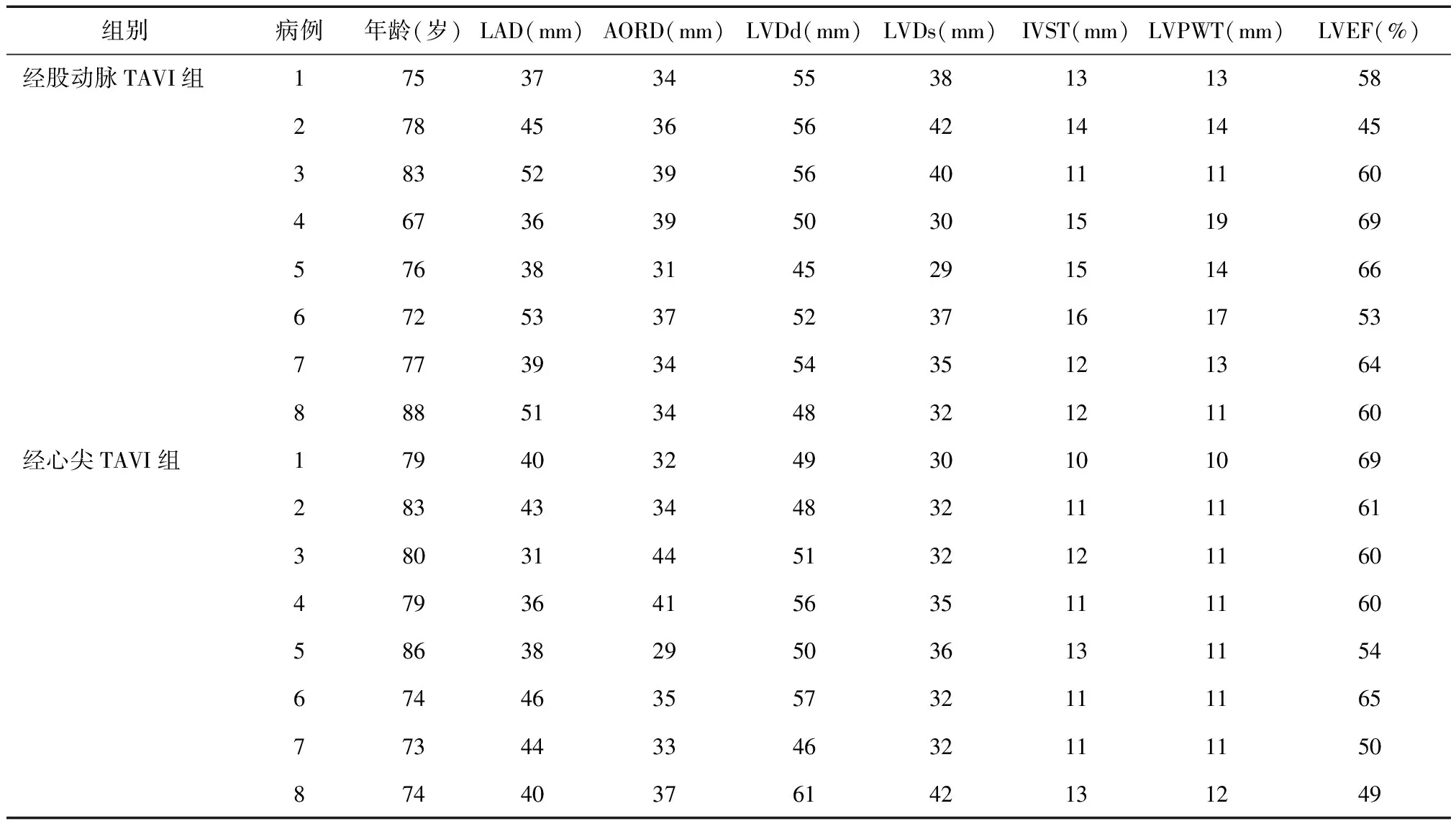
表1 患者术前的常规超声心动图资料
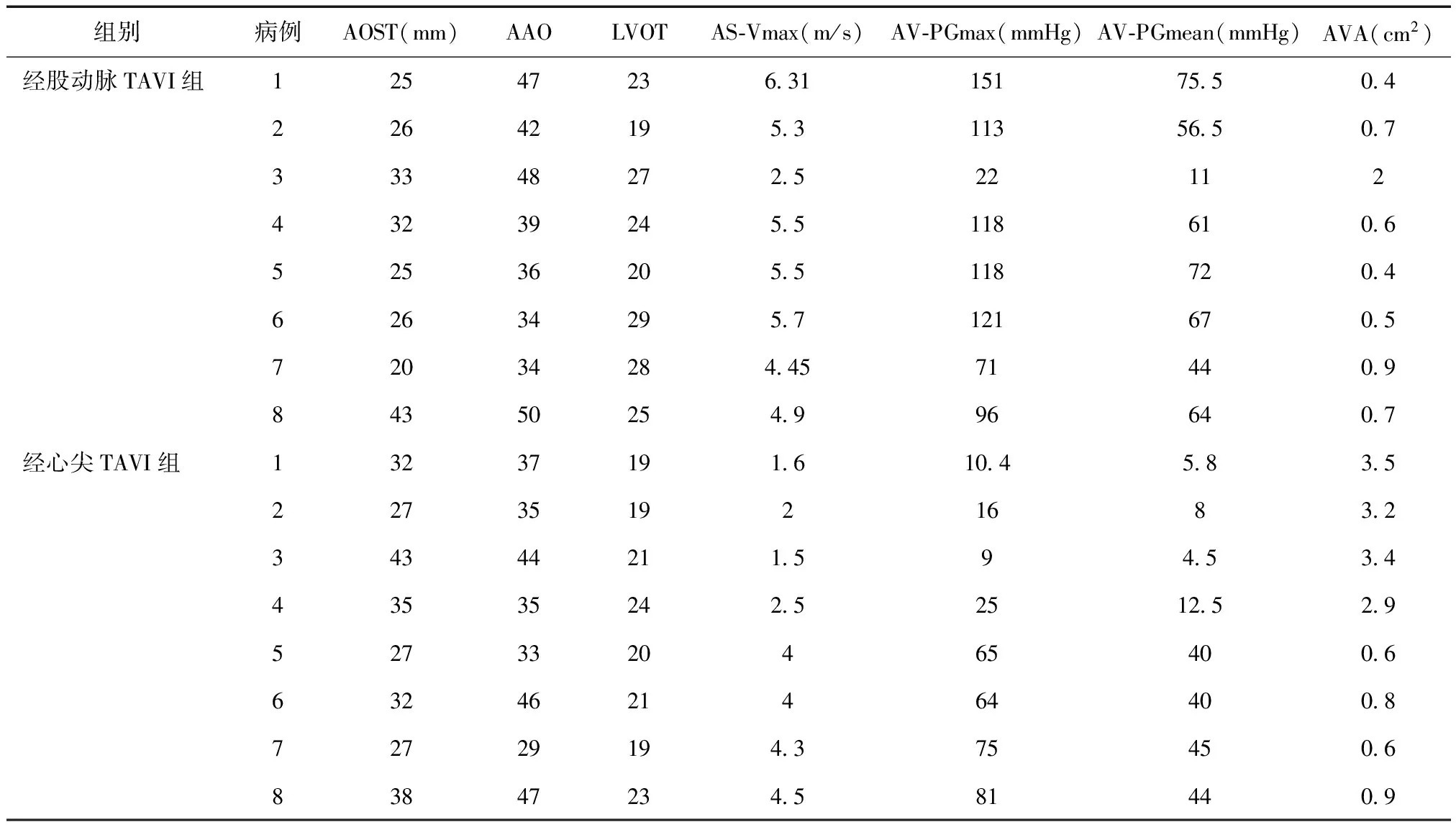
表2 术前患者常规超声心动图参数值
2.2 三维经食管超声心动图与CT评价主动脉瓣环比较 三维经食管超声心动图与CT在评价主动脉瓣环瓣环最大径(r=0.99,P< 0.001)、瓣环最小径(r=0.97,P< 0.001)、瓣环面积(r=0.98,P< 0.001)、狭窄瓣口面积(r=0.99,P< 0.001);术前连续性方程测量的狭窄瓣口面积与CT及3DTEE比较相关性很好(均r=0.99,P< 0.001),见表3。
2.3 术后患者超声心动图结果 两组患者术后7天接受常规超声心动图检查,结果见表4;经股动脉TAVI组术后轻中度瓣周漏2例,轻度瓣周漏2例;经心尖TAVI组术后轻中度瓣周漏2例,轻度瓣周漏1例,轻微瓣周漏1例,术后瓣膜狭窄1例,见表5。
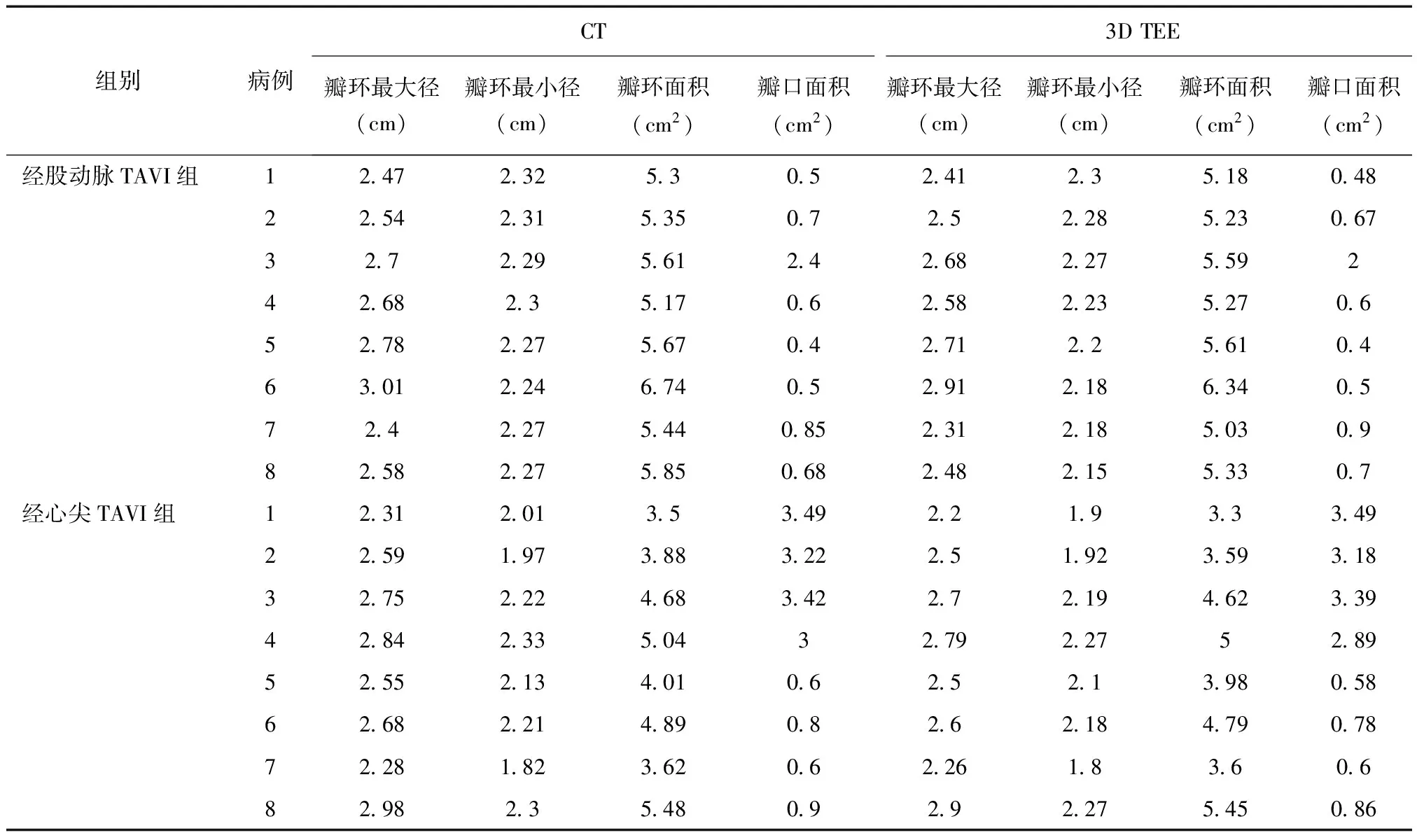
表3 术前CT和经食管三维超声心动图评价主动脉瓣比较
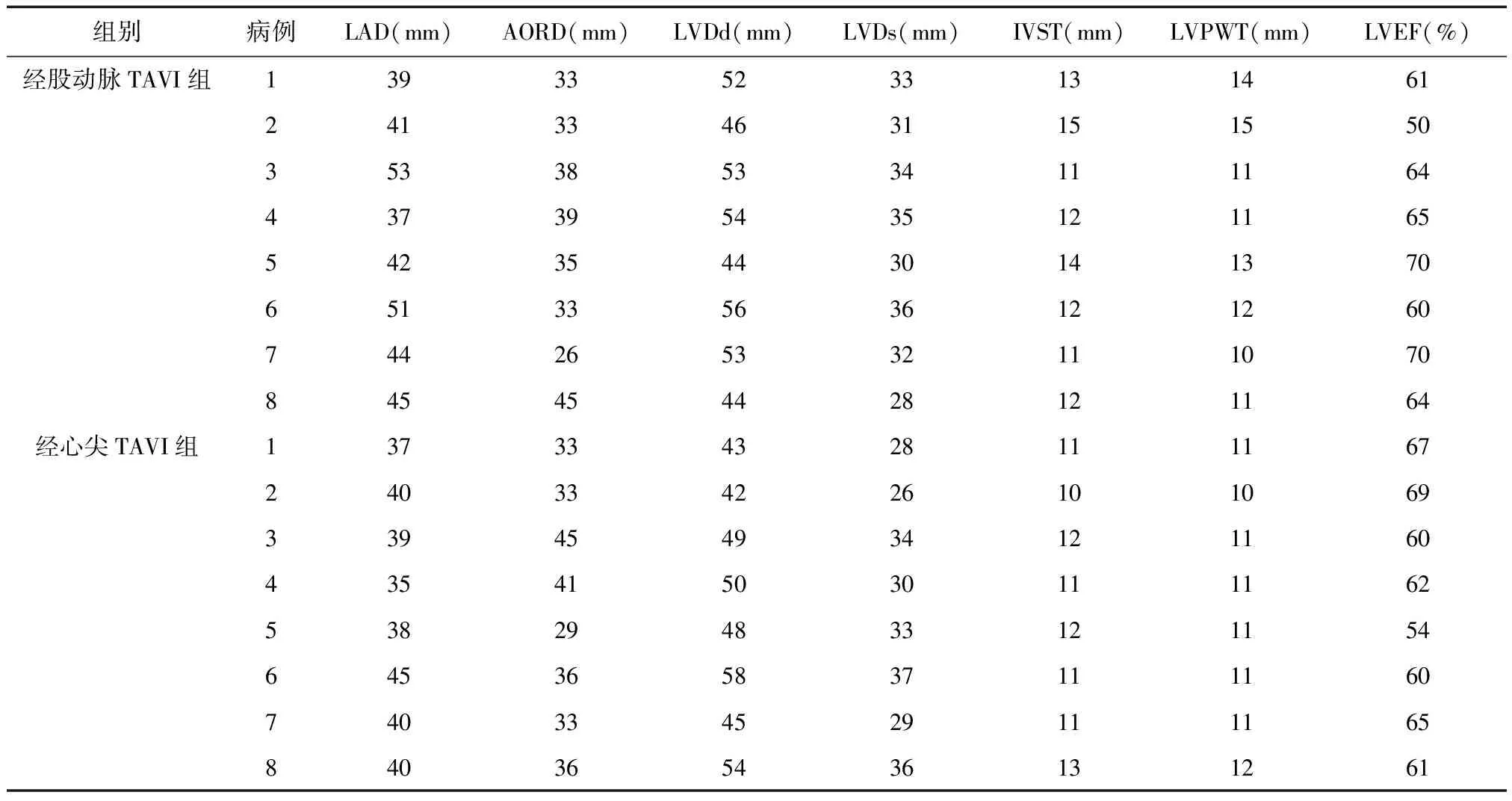
表4 术后3天的常规超声心动图资料
3 讨论
在TAVI术前系统的、全面的超声心动图检查结合实时三维经食管超声心动图的补充是非常重要的,实时三维经食管超声心动图能准确、可重复测量主动脉瓣环直径,并且与CT的测值相关性很好,而且能测量主动脉瓣环至冠状动脉开口的距离,同时能立体评价主动脉瓣和根部的解剖形态[2];在TAVI介入术中,实时三维经食管超声心动图能立体地显示心腔内的装置、引导和监测人工主动脉瓣植入的位置,同时引导和监测人工瓣膜瓣周漏、瓣膜反流及并发症[2]。同时观察左房及左心耳内附壁血栓的情况,如果患者发现左房及左心耳存在附壁血栓,必须华法林治疗三个月后再复查食管超声。更重要的是经食管超声心动图评价主动脉粥样硬化斑块的程度,因为主动脉的显著粥样硬化在经导管TAVI术中引起栓塞的主要原因,为避免这种情况发生,必须改变植入路径由顺行法或逆行法改为经心尖部的方法。
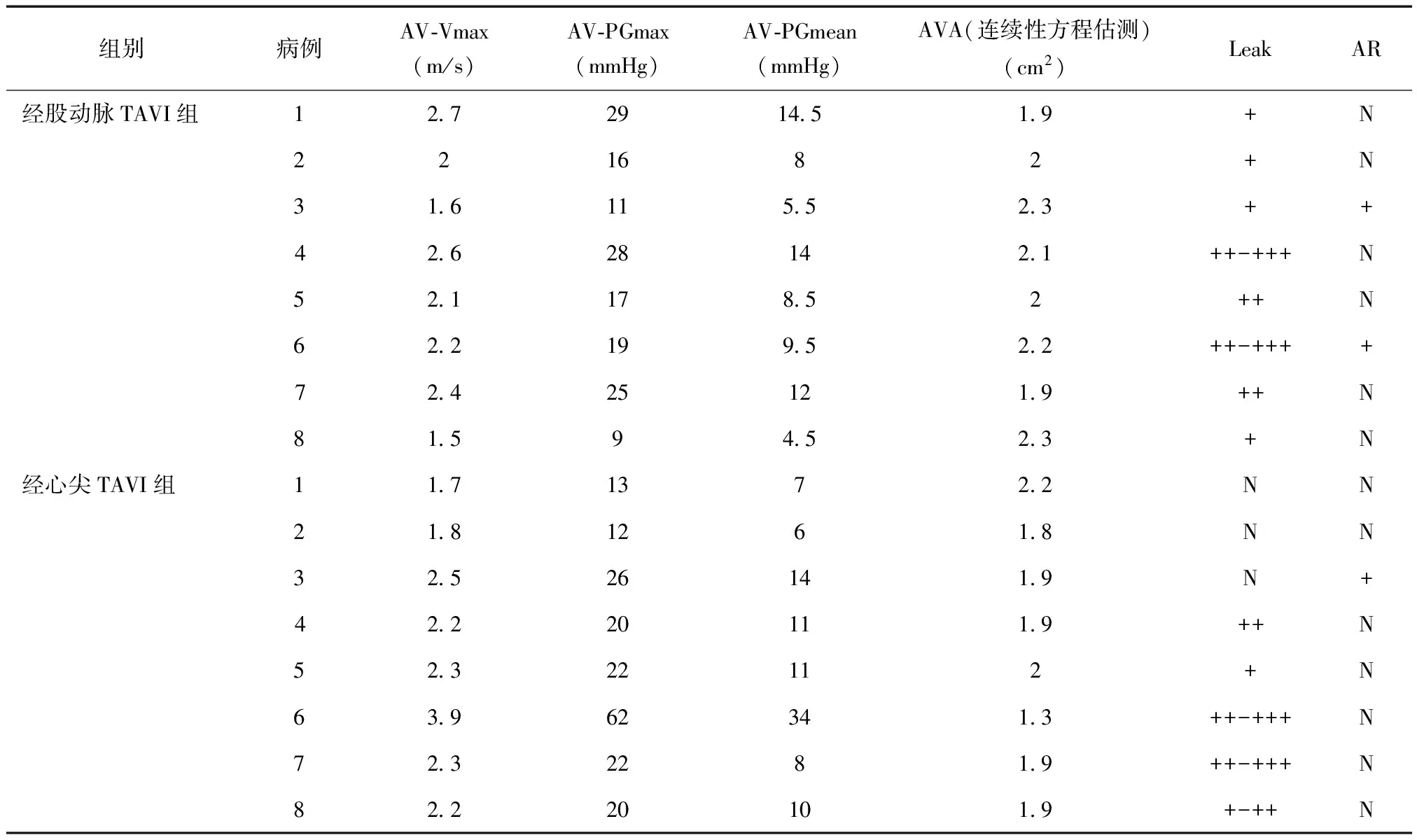
表5 术后人工主动脉瓣的彩色多普勒功能评价
N无,+轻微,++轻度,+-++,轻微至轻度,++-+++轻中度,+++中度
本研究应用经食管二维、三维超声心动图在TAVI术前评价左室流出道内径、主动脉根部内径、主动脉窦管交界处内径、升主动脉近端内径、主动脉瓣环最大径、最小径,瓣环面积以及狭窄瓣口面积,表明实时三维经食管超声心动图能准确定量主动脉瓣环最大径、最小径、瓣环面积以及狭窄瓣口面积,且与CT的测值相关性很好,与以往的文献报道一致[2,3]。
在TAVI术中,经食管超声心动图可进行实时二维和三维显像监测人工生物主动脉瓣植入过程[4~7],而且实时三维经食管超声心动图可清晰显示导丝、输送鞘、球囊和人工生物瓣膜,进行实时引导和监测其位置,在人工生物瓣植入并打开后即刻,实时三维彩色经食管超声心动图能评价主动脉瓣反流的程度及反流位置,如果出现明显的瓣周漏,需要再一次的球囊扩张有助于减少瓣周漏。本研究1例TAVI患者因人工生物主动脉瓣植入位置较低,压迫二尖瓣前叶,致使二尖瓣反流较术前增多,于是将人工生物主动脉瓣往上提,虽然二尖瓣反流较少,但出现升主动脉夹层分离及急性心包填塞,经即刻心包穿刺,患者转危为安。因此,实时三维经食管超声心动图在TAVI术中准确引导和实时监测植入的位置是很重要的。同时实时三维经食管超声心动图系统评价人工生物瓣的瓣叶活动,确定人工生物瓣的固定情况,并仔细观察人工生物瓣对冠状动脉开口的影响。
在TAVI术后,文献报道[8,9,11~13],50%的患者伴有轻度瓣周漏,20%的患者伴有中度瓣周漏,<10%的患者伴有重度瓣周漏。而且中度或重度瓣周漏伴有增加住院死亡率[14]。本研究应用经食管二维、三维超声心动图评价8例经股动脉TAVI患者(其中3例二叶式主动脉瓣伴重度狭窄,4例主动脉瓣钙化重度狭窄,1例人工生物瓣置换后中重度反流)以及8例经心尖TAVI患者(4例主动脉瓣钙化重度狭窄,4例主动脉瓣重度反流),发现4例伴有轻中度瓣周漏、2例伴有轻度瓣周漏、1例伴有轻微至轻度瓣周漏。而且4例轻中度瓣周漏患者出现于重度主动脉瓣狭窄患者,仅1例轻度瓣周漏患者出现于重度主动脉瓣反流患者。原因可能如下:①缘于主动脉瓣及瓣环严重钙化,致使人工瓣膜与自然主动脉瓣环之间有缝隙,从而容易产生瓣周漏;②缘于选择人工瓣膜的尺寸较小导致瓣周漏;③缘于主动脉瓣环的形状是椭圆形的,从而导致瓣周漏,故主张应用主动脉瓣环最大径、最小径的平均值选择人工瓣膜的大小以减少瓣周漏的发生。
综上所述,TAVI的成功与否取决于术前高质量的经胸及经食管二维、三维超声心动图评价、术中高质量的经食管二维、三维超声心动图引导与监测以及术后经胸超声心动图的密切随访。由于本研究仅对8例经股动脉TAVI患者及8例经心尖TAVI患者进行初步探讨,有待进一步增加病例数,并进行多中心大规模临床研究。
[1] Namal W,Jian Y,Josep R,et al.Transcatheter aortic valve implantation in patients with bicuspid aortic valve stenosis[J].JACC cardiovasc interv,2010,3(11):1122-1125.
[2] Lindsay AS,Rafal D,Amit B,et al.Real-time three-dimensional transesophageal echocardiography adds value to transcatheter aortic valve implantation[J].J Am Soc Echocardiogr,2013,26:359-369.
[3] Arnold CTN,Victorial D,Frank van D,et al.Comparison of aortic root dimensions and geometries before and after transcatheter aortic valve implantation by 2-and 3-dimensional transesophageal echocardiography and multislice computed tomography[J].Cir Cardiovasc imaging,2010,3(1): 94-102.
[4] Perk G,Lang RM,Garcia-Fernandez MA,et al.Use of real time three-dimensional transesophageal echocardiography in intracardiac catheter based interventions[J].J Am Soc Echocardiogr,2009,22:865-882.
[5] Lee AP,Lam YY,Yip GW,et al.Role of real time three-dimensional transesophageal echocardiography in guidance of interventional procedures in cardiology[J].Heart,2010,96:1485-1493.
[6] Smith L,Bhan A,Monaghan MJ,et al.The expanding role of echocardiography in interventional cardiology[J].Eur Cardiol,2010,6:71-77.
[7] Bagur R,Rodes-Cabau J,Doyle D,et al.Usefulness of TEE as the primary imaging technique to guide transcatheter transapical aortic valve implantation[J].JACC Cardiovasc Imaging,2011,4:115-124
[8] Webb JG,Altwegg L,Boone RH,et al.Transcatheter aortic valve implantation: impact on clinical and valve-related outcomes[J].Circulation,2009,119:3009-3016.
[9] Himbert D,Descoutures F,Al-Attar N,et al.Results of transfemoral or transapical aortic valve implantation following a uniform assessment in high-risk patients with aortic stenosis[J].J Am Coll Cardiol,2009,54:303-311.
[10]Walther T,Simon P,Dewey T,et al.Transapical minimally invasive aortic valve implantation: multicenter experience[J].Circulation,2007,116(suppl):1240-1245.
[11]Svensson LG,Dewey T,Kapadia S,et al.United States feasibility study of transcatheter insertion of a stented aortic valve by the left ventricular apex[J].Ann Thorac Surg,2008,86:46-54.
[12]Kodali SK,Williams MR,Smith CR,et al.Two-year outcomes after transcatheter or surgical aortic-valve replacement[J].N Engl J Med,2012,366:1686-1695.
[13]Bauer F,Lemercier M,Zajarias A,et al.Immediate and long-term echocardiographic findings after transcatheter aortic valve implantation for the treatment of aortic stenosis: the Cribier-Edwards/Edwards-SAPIEN valve experience[J].J Am Soc Echocardiogr,2010,23:370-376.
[14]Abdel-Wahab M,Zahn R,Horack M,et al.Aortic regurgitation after transcatheter aortic valve implantation: incidence and early outcome.Results from the German transcatheter aortic valve interventions registry[J].Heart,2011,97: 899-906.
The application value of real-time 3-dimensional transesophageal echocardiography in aortic valve implantation
ZHAOWei-peng,PANCui-zhen,WEILai,PANWen-zhi,ZHOUDa-xin,SHUXian-hong
(DepartmentofEchocardiography,ZhongshanHospital,FudanUniversity,ShanghaiInstituteofCardiovascularDiseases,Shanghai200032,China)
SHUXian-hong
Objective To investigate the application value of 3-dimensional transesophageal echocardiography in aortic valve implantation. Methods We performed transcathet aortic valve implantations (TAVI) to 16 patients with severe aortic stenosis through two different surgical accesses. Of these patients, 7 severe aortic stenosis (AVA < 1.0 cm2, peak aortic valve velocity ≥4.0m/s, and mean aortic valve pressure gradient ≥ 40mmHg) and one patient with moderate to severe prosthetic valve regurgitation were enrolled in transfemoral TAVI group. Four patients with severe aortic stenosis and four patients with severe aortic regurgitation were enrolled in transapical TAVI group. All patients
2- and 3-dimensional transthoracic and transesophageal echocardiographic examination before, during and after surgery using Philips IE33 with S5-1 and X7-2 probe. Results In the transfemoral TAVI group, procedural success was achieved in all 8 patients, but one patient died due to pericardial tamponade and aortic dissection three days after TCTAVI. In the transapical TAVI group, all patients were implanted successfully aortic valve and had no complication. The maximum and minimum diameter of aortic annulus, the area of aortic annulus and aortic valve were measured by CT and 3D TEE. All parameters had a strong correlation between CT and 3D TEE: r values were 0.99 (maximum diameter), 0.97(minimum diameter), 0.98 (the area of aortic annulus) and 0.99 (the area of aortic valve), respectively. There were a good correlation for the area of aortic valve among CT, 3DTEE and equation of continuity (all r=0.99). Conclusion 3-dimensional transesophageal echocardiography can quantify the size of aortic annular and comprehensively evaluate the anatomical structure of aorta rapidly and accurately. It can be used in guiding the implantation of aortic valve and monitoring its complications in real time.
Aortic valve; Three-dimensional transesophageal echocardiography;Intervention
R540.4+5; R654.2
A
1672-6170(2016)05-0004-07
舒先红,女,主任医师,教授,博士生导师。中国超声医学工程学会超声心动图专业委员会副主任委员,中国医学影像技术研究会超声心动图专业委员会副主任委员,中国医师协会超声医学分会超声心动图委员会主任委员。研究方向:心脏超声诊断。
2016-07-19)

