双价抗虫基因转化对茶籽生长发育影响的研究初探
成 杨,杨 阳,刘 振,赵 洋,杨培迪(湖南省农业科学院 茶叶研究所,国家茶树改良中心 湖南分中心,湖南 长沙 410125)
双价抗虫基因转化对茶籽生长发育影响的研究初探
成 杨,杨 阳,刘 振,赵 洋,杨培迪
(湖南省农业科学院 茶叶研究所,国家茶树改良中心 湖南分中心,湖南 长沙 410125)
摘要:以保存本所茶树资源圃的黄叶峒茶和牛皮茶为研究对象,进行花粉管通道法转基因操作研究,观察其结实率和发芽率,初步探明了双价抗虫基因转化对茶籽生长发育的影响。
关键词:花粉管通道法;转基因;茶籽;生长发育
转基因技术是将人工分离和修饰过的基因导入到生物体基因组中,由于导入基因的表达,引起生物体的性状的可遗传的修饰,这一技术称之为转基因技术(Transgene technology),是目前世界各国现代生物技术产业研究的重点。通过转基因方法使茶树获得抗虫基因,可以很好的解决茶树虫害问题,同时解决茶树农药残留和农药使用对茶园生态环境造成的破坏和污染问题。在茶树转基因的研究上,已经有了很多的研究成果,但是真正获得拥有稳定转入基因的植株很少[1,2]。
花粉管通道法操作简便、直接,直接将部分DNA片段转入受体基因组,性状容易稳定;且在试验过程中不需要经过愈伤组织阶段,绕过了茶树转基因操作上的一大难题[3]。花粉管通道法是一种较早出现也较成熟的转基因方法,在多种作物的转基因研究上尤其是转基因抗虫棉花上取得了非常良好的效果[4]。然而花粉管通道法转化成功率低,且转化操作会影响结实率和萌发率[5,6],因此在转化成果的鉴定上,存在一定难度。本研究连续三年开展Bt和Cpti双价抗虫基因转化试验对茶籽生长发育情况的影响研究,以便为茶树花粉管通道法转基因研究提供参考。
1 材料与方法
1.1材料与仪器
1.1.1材料
选取种植于湖南省农业科学院茶叶研究所(湖南省茶叶研究所)种质资源圃中处于盛花期的黄叶峒茶(第一年受体)和牛皮茶(第二年增加的受体)为受体材料。菌株为天根生物科技有限公司提供的E.coil DH5α 感受态菌株。质粒为上海生工生物工程有限公司合成的含有Bt 和Cpti 抗虫基因序列的卡那霉素抗性T载体质粒。
1.1.2仪器
培英科技有限公司生产的HZC-250恒温振荡培养箱、上海博讯实业有限公司医疗设备厂生产的XMTD-204数显式恒温水浴锅、德国eppendorf公司生产的Mastercycler PCR仪以及Cenrrifuge5417R冷冻高速离心机、北京市六一仪器厂生产的DYY-7C型电泳仪。
1.2实验方法
1.2.1质粒DNA的转化与扩增
将T 载体质粒转入E.coil DH5α 感受态菌株当中,将转化后的菌株制成4 个不同浓度梯度的菌液,分别涂在加入了50 mg/L 的卡那霉素作为抗原的LB 固体培养基的培养皿中,37℃恒温培养16 h,挑取单菌株加入到装有100 mL的LB 液体培养基的三角瓶(250 mL)当中,37℃下150 r/min 的恒温摇床中震荡培养20h[7]。
1.2.2DNA 的制备
SDS 碱裂解法提取质粒DNA[8],制成低密度DNA 提取液并进行检测。
1.2.3花粉管通道法转化
开花后1~2 h内进行人工授粉,授粉1 h 后去除花冠,沿与柱头成45°左右切除约1/3 柱头,将5μL DNA 提取液滴于柱头上。挂牌标记并摘去其所在枝上其他未经处理的茶花,次日重复滴注1 次,自然成熟后收获茶籽。
1.2.4 花发育情况和茶籽发芽率的统计
自茶花接受过转化处理后,每个月观察一次,通过观察茶花子房的颜色和饱满度,来判断其是否正常发育,第二年10月份霜降前后收取茶籽并统计结实率。与前两年的结实率进行对比。
前一年收取的茶树种子在实验室中培养,选取处理后种子30粒,未处理种子60粒,进行对照实验。用温水浸3~4 h,水温20℃~25℃。事先做好发芽盘,盘底要钻些漏水的小孔,以免积水。盘内底层先垫一层吸水纸,纸上铺1.5 cm厚的干净细沙。然后将温水浸好后的茶籽,取出平摊在沙上,再在摊好的茶籽上盖一层薄沙,洒水湿润,放入恒温培养箱中加温催芽。箱内温度保持在25℃~30℃之间,发芽盘的细沙要保持湿润,每天加水通气两、三次[9]。
2 结果与分析
2.1接种后的茶树结实率
对2012~2014年连续三年接种后花的发育与结实率情况进行统计,结果表明,三年间花朵正常发育率平均为33.93%,结实率为16.25%(表1)。
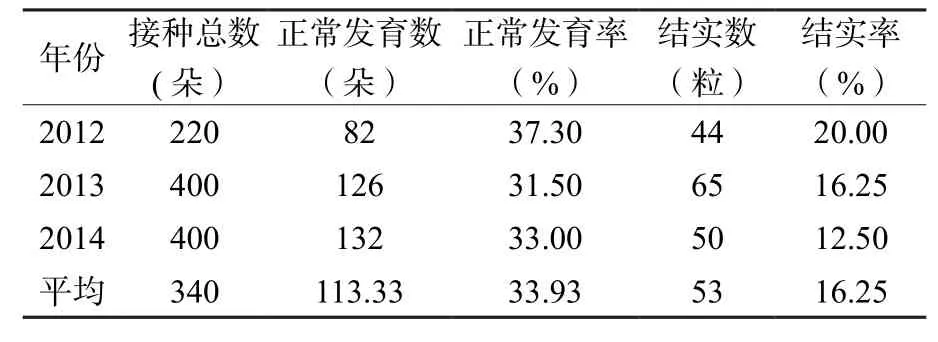
表1 2012~2014年接种茶花发育和结实情况Table 1 The inoculated tea fower seeding rate in 2012~2014
2.2接种后茶籽发芽情况
将2013年接种后的茶籽与普通茶籽进行沙培,并对发芽情况进行调查,结果表明:接种后所收获茶籽的发芽率(16.7%)要远低于对照普通茶籽的发芽率(33.3%和40.0%),说明茶树Bt和Cpti双价抗虫基因转化试验对茶籽的生长发育有着明显的负面影响。

表2 接种后茶籽与普通茶籽发芽情况Table 2 The germination rate of inoculated tea seeds and common tea seads
3 讨论
综合观察三年的接种茶花发育情况,在进行花粉管通道法的操作之后,结实率最高没有超过20%,最低的一年只有12.5%。而对比2012年[10]和2013年实验的茶籽发芽率来看,进行了转化操作的茶籽发芽(出苗)率为普通茶籽的一半左右。
综上所述,花粉管通道法对茶籽发芽(出苗)率的负面影响是非常明显的,这一点与许珺然等所做的实验结论基本一致[6,11]。由于茶树杂交后结实率的范围非常广泛[12],因此实验当中茶树结实率虽然略偏低,但基本在正常范围内,这一点与许珺然等和李兴林、王晓娟的实验有一定差距[5, 6, 11]。一方面可能是因为接种时间对作物的影响,在许珺然的实验中,就明确提出进行转化时间越靠后,结实率越高[11];另一方面也可能是因为本实验中所用外源DNA浓度仅有许珺然等人实验的一半[6],浓度相对偏低。除此之外,茶树极长的结实周期也可能有一定的影响。这一方面的研究将在下一阶段中具体进行。
由此可见,花粉管通道法本身成功率较低,必须依靠大量的实验样本来提高取得转化成功样本的概率,同时做好实验室培养操作,尽量提高茶籽的发芽率[9]。
参考文献
[1] 谭和平, 周李华, 钱杉杉, 等. 茶树转基因技术研究进展[J].武汉植物学研究, 2009, 27(3): 323-326.
[2] 项威, 史成颖, 贺志荣, 等.根癌农杆菌介导茶树转基因体系的建立[J].安徽农业大学学报, 2012, 39(5): 721-724.
[3] 龚秦秦, 沈慰芳, 周光宇. 授粉后外源DNA导入植物技术——DNA通过花粉管通道进入胚囊[J]. 中国科学(B),1988(6): 611-614.
[4] 喻树迅, 范术丽. 国产转基因棉花研发及产业化[J]. 生物产业技术, 2010, (3): 35-41.
[5] 李兴林, 王晓娟.外源DNA导入麦类作物结实率的研究[J].天津科技大学学报. 2006;21(3): 5-7.
[6] 许珺然, 张显, 张勇, 等. 抗菌肽基因Gnk2-1经花粉管通道法导入西瓜的初步研究[J]. 园艺学报, 2014, 41(4): 1467-1475.
[7] 梁建庆, 叶志华, 江秀梅, 等. 转化条件对质粒DNA转化大肠杆菌的影响[J]. 微生物学杂志, 2004(4): 15-17.
[8] 石滢, 崔岩, 赵莉佩, 等. 球形孢子丝菌DNA提取方法的比较[J]. 中国真菌学杂志, 2015, 10(4): 216-219.
[9] 张玉翠. 茶树种苗的鉴定和检验技术[J]. 中国种业, 2004,(5): 39-40.
[10] 成杨, 赵洋, 杨培迪, 等. 茶树Bt和Cpti双价抗虫基因转化研究(简报)[J]. 茶叶通讯, 2014, 41(4): 41-43.
[11] 许珺然. 花粉管通道法转化抗菌肽基因Gnk2-1到西瓜的研究[D]. 咸阳:西北农林科技大学, 2014.
[12] 李家贤, 何玉媚. 茶树人工杂交结实习性的试验探讨[J]. 广东茶业, 1999(04): 18-22.
The effect of the Transformation of the Dual Resistance Gene on the Growth of Tea Seeds
CHENG Yang,YANG Yang,LIU Zhen,ZHAO Yang,YANG Pei-di
(Tea Research Institute of Hunan Academy of Agricultural Sciences, Changsha, 410125, China)
Abstract:The experiment studied the effect of the transformation of the Dual Resistance Gene on the growth of tea seeds by observation of seed rate and germination rate. The tea cultivars used in this experiment are Huangyetongcha and Niupicha planted in the Tea Germplasm Garden of Hunan Tea Research Institute. And the gene transformation method is Pollen Tube Pathway.
Key words:Pollen Tube Pathway, Gene transformation, Tea seed, Germination rate
中图分类号:S571.1
文献标识码:A
文章编号:1009-525X(2016)01-35-37
收稿日期:2015-12-22
修订日期:2016-01-13
基金项目:国家现代农业产业技术体系建设专项(CARS-23)、湖南省农业科学院创新团队
作者简介:成杨(1985-),男,江苏南通人,助理研究员,主要从事茶树育种研究。

