Lin28B的高表达与膀胱癌的恶性程度及预后相关
冯宇鹏 朱俊峰 黄薇 沈艳 叶向东 杨毅*
1)广州医科大学附属第四医院泌尿外科 3)病理科 广州 51000 2)中山大学附属第一医院病理科 广州 51000
Lin28B的高表达与膀胱癌的恶性程度及预后相关
冯宇鹏1)朱俊峰2)黄薇3)沈艳3)叶向东1)杨毅1)*
1)广州医科大学附属第四医院泌尿外科3)病理科广州510002)中山大学附属第一医院病理科广州51000
【摘要】目的探讨膀胱癌组织中Lin28B的异常表达与膀胱癌病理学分级、临床分期及预后的关系。方法应用免疫组织化学方法检测Lin28B在75例膀胱癌组织及10例癌旁组织中的表达;采用卡方检验或精确概率法分析Lin28B在膀胱癌及癌旁组织中的差异,以及膀胱癌不同病理学分级、不同临床分期中Lin28B的阳性率的差异。并采用log-rank检验及Cox回归分析Lin28B的表达与膀胱癌患者预后的关系。结果Lin28B在64%(48/75)膀胱癌组织中表达阳性,在癌旁组织中表达为阴性(0),组间差异具有统计学意义(P<0.001)。病理学分级恶性程度高的标本,Lin28B的阳性率高,组间差异具有统计学意义(P=0.007)。临床分期进展程度高的标本中,Lin28B的阳性率高,组间差异具有统计学意义(P=0.030)。Log-rank检验及Cox回归分析示Lin28B表达阳性是预后不良的独立影响因素。结论Lin28B在膀胱癌中高表达,且与膀胱癌的病理学分级、临床分期及预后密切相关。
【关键词】Lin28B;膀胱癌;预后;增殖;转移
随着肿瘤分子生物学技术和高通量基因组测序分析技术的突破性发展,依靠传统的大体解剖和显微镜下形态学诊断的膀胱癌病理学分级和临床分期,已无法准确更好评价膀胱癌的生物学行为及判断预后[1-2]。近年来,越来越多的关于膀胱癌诊断及治疗的研究着眼于检测癌或抑癌基因及其编码的产物,目的是为了能够早期发现膀胱癌,指导治疗,判断预后,监测疾病的发展,并作为治疗的一个靶点进行干预,从而提高膀胱癌的治疗效果。
全基因组关联测序研究发现MYC和TP63等基因的突变会大大增加罹患膀胱癌的风险[3]。MYC癌基因与Lin28基因的表达存在互相促进的循环网络,在恶性肿瘤的发生发展中起关键作用[4]。Subramanian等研究证明在乳腺癌中TP63基因突变通过上调Lin28B的表达促进肿瘤的增殖和转移[5];抑制Lin28B的表达,TP63突变引起的肿瘤负荷明显减弱。国内外目前研究结果提示,Lin28B是一种RNA结合蛋白,能够调控多种基因的转录和表达,可能在上皮细胞间质转化、恶性肿瘤的浸润及转移的过程中发挥关键的作用[6]。本研究通过检测膀胱癌组织中Lin28B的表达,发现膀胱癌组织Lin28B表达异常升高,且与肿瘤的恶性病理特征和预后密切相关。
1资料与方法
1.1资料收集200-01—2010-12间在中山大学附属第一医院行膀胱镜活检或经尿道膀胱肿瘤电切术或膀胱癌根治术的75例膀胱癌患者资料。所有膀胱癌组织标本来源于石蜡包块(包括10例癌旁组织蜡块),经两位不同的病理医生确诊为膀胱癌。膀胱癌的病理学分级采用2004年WHO的分级,分别为低度恶性倾向尿路上皮乳头状肿瘤、低级别和高级别尿路上皮癌,依次表示为G1、G2、G3。根据诊断原发肿瘤时的B超、胸部X线射片、CT、MR、骨扫描等辅助检查,以及综合术后病理结果确定膀胱癌的临床分期。患者诊断为膀胱癌的年龄为(59.99±14.41)岁。随访33~89个月,中位随访时间为60个月。
1.2免疫组织化学方法采用经典的辣根过氧化物酶链霉卵白素(SP)免疫组化法。Lin28B蛋白染色阳性以细胞浆为主,极少数在细胞核中也有染色。每张切片观察5个400倍镜下视野,综合染色强度及阳性细胞百分率进行评分。染色强度0分(阴性),1分(弱阳性),2分(中等阳性),3分(强阳性);阳性细胞百分率0分(无阳性细胞),1分(阳性细胞<25%),2分(阳性细胞25% ~ 50%),3分(阳性细胞>50%),两项分数之和为0~2分者,计为表达阴性,>2分者为阳性。
1.3统计学方法统计软件对数据进行统计学分析,计数资料采用卡方检验或精确概率法分析。采用Kaplan-Meier法估计生存率,采用log-rank检验生存曲线的差异,多因素的生存分析采用Cox回归。以P<0.05为差异有统计学意义。
2结果
2.1膀胱癌组织中Lin28B表达异常75例膀胱癌组织中48例Lin28B表达呈阳性64%,而10例癌旁组织膀胱粘膜中Lin28B表达均为阴性,两者比较差异有统计学意义(P<0.001)。分析膀胱癌患者病例中Lin28B表达,发现Lin28B在患者年龄、性别等方面比较差异无统计学意义(P>0.05),见表1。
2.2膀胱癌组织中Lin28B的表达与临床标本的病理学分级相关Lin28B在高级别上皮细胞癌(低分化)中阳性率最高,为78.3%(18/23);低级别(中分化)膀胱癌组织中Lin28B的阳性率次之,为70.6%(24/34);低度恶性倾向尿路上皮乳头状肿瘤(高分化)阳性率最低,为33.3%(6/18),组间差异有统计学意义(P=0.018) (表1)。
2.3膀胱癌组织中Lin28B的表达与膀胱癌原发肿瘤临床分期相关如表1,Lin28B的阳性率与膀胱癌的浸润程度相关,从Ta期到T4期依次升高,分别为46.2%、57.1%、66.7%、83.3%、100%,组间差异有统计学意义(P=0.030)。
2.4生存分析75例膀胱癌病例中,分别对Lin28B表达阳性与阴性的病例进行生存分析,预期平均生存时间(月)分别为86.5和62.0个月,log-rank统计学分析两组差别具有统计学意义(χ2=22.714,P<0.001,图1)。进一步综合考虑年龄、性别、病理学分级、临床分期等因素采用Cox回归分析,发现Lin28B的表达,与膀胱癌病理学分级、临床分期相似,也是一种影响膀胱癌预后的独立影响因素(RR:0.089,95%CI:0.018 ~ 0.451,P<0.003)。
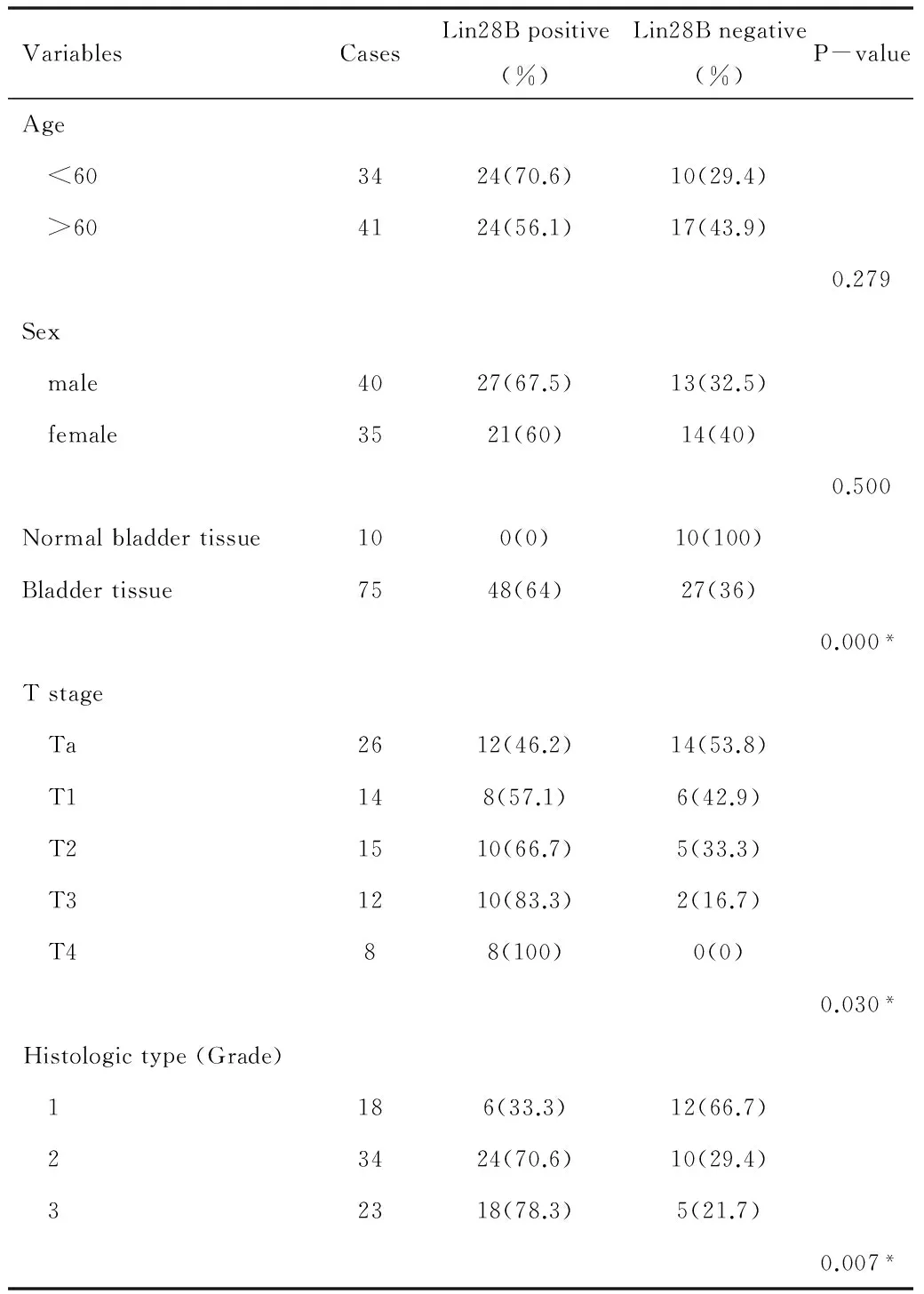
表1 Lin28B在患者年龄、性别等方面比较

图1 75例膀胱癌患者Lin28B表达阳性与阴性的
3讨论
膀胱癌致病的环境危险因素目前研究认为包括长期吸烟,职业接触芳香胺和多环碳氢化合物,血吸虫属的慢性感染,电离辐射暴露和含有非那西丁的止痛药的滥用。除了环境因素,基因的重排、扩增、和转录调控基因的表达改变导致癌基因的激活或抑癌基因的失活在膀胱癌的发生发展中扮演着至关重要的作用。Lin28B是一种RNA结合蛋白,大小约27kDa,主要在细胞浆中表达,也在细胞核中有少量表达。Lin28B的蛋白质结构中含有独特的RNA冷休克结构域( cold shock domain,CSD)和一对反向的CCHC锌指模体(zinc finger motifs,ZFM),可与特异RNA结合,参与基因的转录和表达调控,其表达异常可能参与上皮细胞间质转化、恶性肿瘤的浸润及转移[7]。
Nguyen等研究发现在肝癌细胞中Lin28B呈高表达状态,且高表达Lin28B可以促使正常肝细胞转化为有成瘤作用的肝癌细胞;在小鼠活体证明敲除Lin28B基因的表达能够降低肿瘤的负荷及延长寿命,说明Lin28B的表达与肝癌的发生。Tu等发现在38%的结肠癌标本中Lin28B表达异常,且表达水平越高,肿瘤的增殖速度越快;并在活体动物模型中证明Lin28B促进肿瘤的形成,沉默Lin28B的表达能减低肿瘤的负荷。另外,在卵巢癌和黑色素瘤中也发现Lin28B表达上调,提示Lin28B在恶性肿瘤中表达水平上调具有一定的普遍性。在本研究中我们通过对75例膀胱癌组织和10例癌旁组织进行免疫组化染色分析,发现癌旁组织Lin28B表达均为阴性,而在64%的膀胱癌组织中Lin28B的表达升高。结果表明Lin28B表达升高与膀胱癌的发生可能有密切的关系[8-10]。
在哺乳动物中Lin28B主要在胚胎干细胞和发育中的组织中表达,即在未分化或低分化的组织细胞中高表达。随着细胞的分化而表达水平逐渐降低,至成年个体中几乎无表达提示Lin28B可能具有维持细胞分化能力或促进细胞分化。Chien等研究发现Lin28B在口腔鳞癌干细胞样细胞中高表达,且在非干细胞样鳞癌细胞中表达Lin28B能促进干细胞样标记物OCT4和Sox2的表达,高表达Lin28B能够促进正常口腔角化上皮重新编程为多能干细14。Chen等研究报道乳腺癌临床标本中Lin28B的表达水平与临床进展相关,与乳腺癌干细胞标记物的表达相关。沉默Lin28B的表达,乳腺癌干细胞的标记分子表达和特性消失。Alam等研究发现降低肺小细胞癌中Lin28B的表达,能够降低干细胞标记物HMGA2的表达,并可抑制肿瘤细胞的增殖和转移。上述这些研究结果充分说明,Lin28B与肿瘤的增殖、转移、干细胞样特性密切相关。恶性肿瘤中病理学分级往往代表细胞的分化程度,也代表肿瘤恶性的侵袭程度,高分化的癌细胞恶性程度相对较低,低分化的恶性程度高。本研究发现Lin28B的表达在不同病理学分级的膀胱癌细胞中阳性率存在差异,在低分化的高级别膀胱癌中阳性率为78.3%,在中分化的低级别尿路上皮癌中阳性率为70.6%,低度恶性倾向尿路上皮乳头状肿瘤中阳性率最低,为33.3%,癌旁正常膀胱组织为0。另外,本研究分析了Lin28B的表达与膀胱癌的临床分期的关系,发现临床分期越高(T4),Lin28B阳性率越高,为100%;膀胱癌早期(Ta),Lin28B阳性率最低,为46.2%。进一步通过log-rank检验和Cox回归分析,发现Lin28B的表达是影响膀胱癌患者预后一种独立影响因素,结果显示Lin28B阳性表达的患者的预后明显差于Lin28B表达阴性的患者。总之,Lin28B的表达上调与膀胱癌的恶性程度及预后相关[11-13]。
此外,还有研究发现Lin28与肿瘤治疗的疗效具有密切的相关性。Hsu等检测104例上皮卵巢癌Lin28B的表达,发现高表达Lin28B的患者更容易导致化疗耐药;敲除Lin28B的表达能够抑制卵巢癌细胞的增殖、迁移和侵袭,增强卵巢癌细胞对顺铂类化疗药的敏感性。另外,研究表明高表达Lin28B与乳腺癌的放疗效果不佳有关,低表达Lin28B的乳腺癌细胞株较高表达Lin28B的乳腺癌细胞株对放疗更敏感。膀胱癌术后的辅助治疗,常用化疗药物灌注,包括表柔比星、吡柔比星、丝裂霉素、卡介苗、干扰素等等,由于药物种类较多、治疗的周期及药物的用量也存在较大差异,混杂因素较多,因此,本研究未收集Lin28B的表达对膀胱癌术后辅助治疗对预后的影响。我们将在之后的研究中进一步扩大样本量,详细收集膀胱癌术后辅助药物治疗对膀胱癌预后的影响,分析Lin28B的表达在药物治疗效果的差异性和耐药性中的作用[14-15]。
总之,Lin28B在膀胱癌组织和正常膀胱粘膜中的差异表达提示,Lin28B在膀胱癌发生发展中扮演重要角色。另外,在恶性程度高的膀胱癌中Lin28B表达明显高于低度恶性的膀胱癌,且Lin28B表达上调的患者预后明显差于阴性表达者,提示Lin28B表达的检测可能成为膀胱癌诊断及预后有价值的指标,可成为膀胱癌治疗的新靶点。
4参考文献
[1]Thomas P, Joseph Paul E, Fine G D, et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer.[J]. Nature, 2014, 515(7528):558-562.
[2]Kamat A M, Flaig T W, H Barton G, et al. Expert consensus document: Consensus statement on best practice management regarding the use of intravesical immunotherapy with BCG for bladder cancer.[J]. Nature Reviews Urology, 2015, 12(4):225-35.
[3]Knowles M A, Hurst C D. Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity.[J]. Nature Reviews Cancer, 2014, 15(1):25-41.
[4]Wang T, Wang G, Hao D, et al. Aberrant regulation of the LIN28A/LIN28B and let-7 loop in human malignant tumors and its effects on the hallmarks of cancer[J]. Molecular Cancer, 2015, 14(1):1-13.
[5]Subramanian M , Francis P ,, Bilke S ,, et al. A mutant p53/let-7i-axis-regulated gene network drives cell migration, invasion and metastasis.[J]. Oncogene, 2015, 34(9):1 094-1 104.
[6]Zhou J, Chng W J, Ng S B. LIN28/LIN28B: An emerging oncogenic driver in cancer stem cells[J]. International Journal of Biochemistry & Cell Biology, 2013, 45(5):973-978.
[7]Nguyen L H, Robinton D A, Seligson M T, et al. Lin28b is sufficient to drive liver cancer and necessary for its maintenance in murine models.[J]. Cancer Cell, 2014, 26(2):248-61..
[8]Tu, H.C., et al. LIN28 cooperates with WNT signaling to drive invasive intestinal and colorectal adenocarcinoma in mice and humans. Genes Dev 2015,29(10), 1 074-1 086.
[9]K-F H, M-R S, Y-F H, et al. Overexpression of the RNA-binding proteins Lin28B and IGF2BP3 (IMP3) is associated with chemoresistance and poor disease outcome in ovarian cancer.[J]. British Journal of Cancer, 2015, 113(3):414-24.
[10]Zhenfeng Z, Shengzhe Z, Pengfei M, et al. Lin28B promotes melanoma growth by mediating a microRNA regulatory circuit.[J]. Carcinogenesis, 2015, 36(9):937-45.
[11]Copley M R, Sonja B, Claudia B, et al. The Lin28b-let-7-Hmga2 axis determines the higher self-renewal potential of fetal haematopoietic stem cells.[J]. Nature Cell Biology, 2013, 15(8):916-925.
[12]Chian-Shiu C, Mong-Lien W, Pen-Yuan C, et al. Lin28B/Let-7 Regulates Expression of Oct4 and Sox2 and Reprograms Oral Squamous Cell Carcinoma Cells to a Stem-like State.[J]. Cancer Research, 2015, 75(12):2 553-2 565.
[13]Chong C, Fengqi C, Lipeng B, et al. IKKβ Enforces a LIN28B/TCF7L2 Positive Feedback Loop That Promotes Cancer Cell Stemness and Metastasis.[J]. Cancer Research, 2015, 75(8):1 725-1 735.
[14]Alam M, Ahmad R, Rajabi H, et al. MUC1-C Induces the LIN28B→LET-7→HMGA2 Axis to Regulate Self-Renewal in NSCLC.[J]. Molecular Cancer Research Mcr, 2015, 13(3):21-28.
[15]Linbo W, Chao Y, Kezhen L, et al. Lin28 mediates radiation resistance of breast cancer cells via regulation of caspase, H2A.X and Let-7 signaling.[J]. Plos One, 2013, 8(6):1 475-1 478.
(收稿2015-12-18)
基金项目:广东省科技计划项目(2014A020212421);广州医科大学校级科研基金资助项目(2013A29)
*通信作者:杨毅,Email:fengyupeng98@163.com
【中图分类号】R737.14
【文献标识码】A
【文章编号】1077-8991(2016)03-0012-03

