MAGE-4抗原MHC-I/MHC-II限制性表位肽的预测
刘晓梁
山西医科大学汾阳学院科技中心 山西吕梁 032200
MAGE-4抗原MHC-I/MHC-II限制性表位肽的预测
刘晓梁
山西医科大学汾阳学院科技中心山西吕梁032200
[摘要]①目的预测黑色素瘤相关抗原-4(MAGE-4)抗原的MHC-I/MHC-II限制性表位肽。②方法利用NCBI蛋白数据库检索到MAGE-4抗原的氨基酸序列,BIMAS、SYFPEITH1、IEDB等3种方案分别对MAGE-4抗原的HLA-A*0201限制性MHC-I类抗原表位进行预测,选出候选肽;然后利用SYFPEITHI服务器和NetMHCIIpan 3.1服务器对候选肽周围的MHC-II限制性表位进行预测。综合分析选出MHC-I/MHC-II限制性表位肽。③结果筛选得到3条肽段,既存在MHC-I限制性表位又存在MHC-II限制性表位肽。④结论为MAGE-4抗原用于结肠癌免疫治疗肽段的选择提供了依据。
[关键词]黑色素瘤相关抗原-4MHC-I限制性MHC-II限制性免疫治疗
随着生活水平的提高与饮食习惯的改变,我国结肠癌(colorectal cancer,CRC)的发病率越来越高,严重影响着人民的生命健康。而在全球癌症发病率中,CRC居第3位,每年大约有1百万的新增病例。尽管其治疗手段与效果取得了进步,每年仍然导致至少50万人死亡[1]。因此,寻找更为有效的治疗手段,显得颇为重要。生物免疫治疗是被视为继手术、放射治疗、化学治疗之外肿瘤治疗的重要方法之一。研究表明,大部分的肿瘤患者处于免疫抑制状态[2~4]。因此,有效激发患者的免疫功能成为当前研究的热点。细胞免疫在抗肿瘤免疫中起重要作用。在人体内,T细胞仅能识别由抗原性肽段与人类白细胞抗原HLA形成的复合体pMHC。也就是说,具有激发免疫功能的是肿瘤抗原的特异性肽段,而非整个肿瘤抗原分子,该肽段也被称作T细胞表位。研究表明,体内外,选择肿瘤抗原性肽段可以有效激发生物体的免疫功能,抑制肿瘤的发展,降低病死率。肿瘤-睾丸抗原(cancer testis antigen,CTA)是一种正常情况下仅表达于生殖细胞与胎盘滋养层细胞,而在肿瘤组织中不同频率表达的肿瘤相关性抗原(tumor associated antigens,TAA)[5],被视为肿瘤生物免疫治疗的理想靶标。其中,CRC患者肿瘤组织中黑色素瘤相关抗原-4(MAGE-4)阳性率约为22.3%[6]。然而,基于MAGE-4在CRC中的免疫治疗作用还未见报道。因此,本研究旨在利用计算机网络资源对MAGE-4的T细胞表位进行预测,以期为后续免疫治疗中肽段的选择提供依据。
1材料与方法
1.1人MAGE-4的一级结构根据NCBI提供的蛋白数据库(NP_001011550.1)获得人MAGE-4的氨基酸序列。结果如图1。

图1 MAGE-4的一级结构
1.2MAGE-4抗原MHC-I类抗原表位的预测采用BIMAS(http://www-bimas.cit.nih.gov/molbio/hla_bind/index.shtml),SYFPEITH1(http://www.syfpeithi.de/bin/MHCServer.dll/EpitopePrediction.htm),IEDB(http://tools.iedb.org/mhci/)等方案对MAGE-4的MHC-I类抗原表位的预测。MHC-I类抗原型别选取中国人频率较高的HLA*0201,抗原肽的长度限制为9个氨基酸,其他参数为默认。最后在各方案中选取排名前15的肽段,各方案中共有的肽段是候选肽段。
1.3MAGE-4抗原MHC-II类抗原表位的预测首先利用SYFPEITHI服务器预测MAGE-4中上述候选肽的周围是否有MHC-II类抗原表位,MHC等位基因限制为HLADRB*0101,0301,0401,0701,1101,1501,肽长度为15肽,其余为默认值;然后利用在线服务器NetMHCIIpan 3.1 Server(http://www.cbs.dtu.dk/services/NetMHCIIpan/)预测各肽段与各型MHC-II类抗原的亲和力[7]。
2结果
2.1预测的MAGE-4抗原MHC-I类抗原表位通过BIMAS、SYFPEITH1、IEDB等3中方案分别对MAGE-4抗原的MHC-I类抗原表位进行预测,发现P1(286~294),P2(309~317),P3(272~280),P4(109~117)在各方案中都具有HLA*0201限制性9肽较大的可能性。各肽段序列及其预测值见表1。
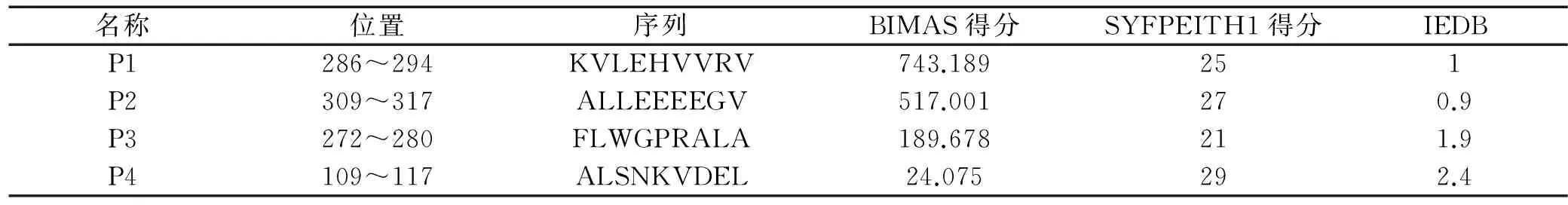
表1 MAGE-4特异性HLA*0201限制性候选CD8+T细胞表位肽
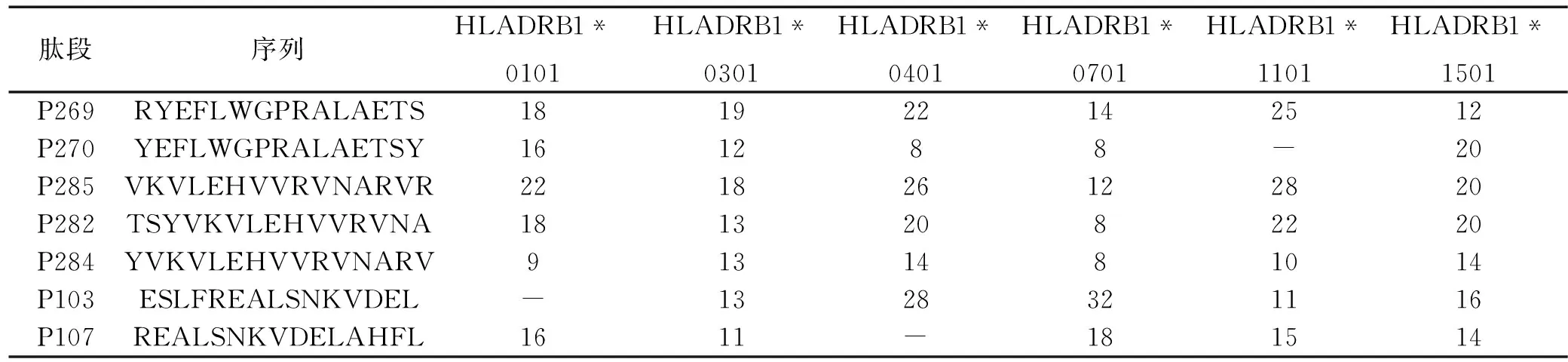
表2 MAGE-4候选CD4+T细胞表位肽预测得分
注:“-”表示未在相应基因型中预测到。
2.2预测的MAGE-4抗原MHC-II类抗原表位
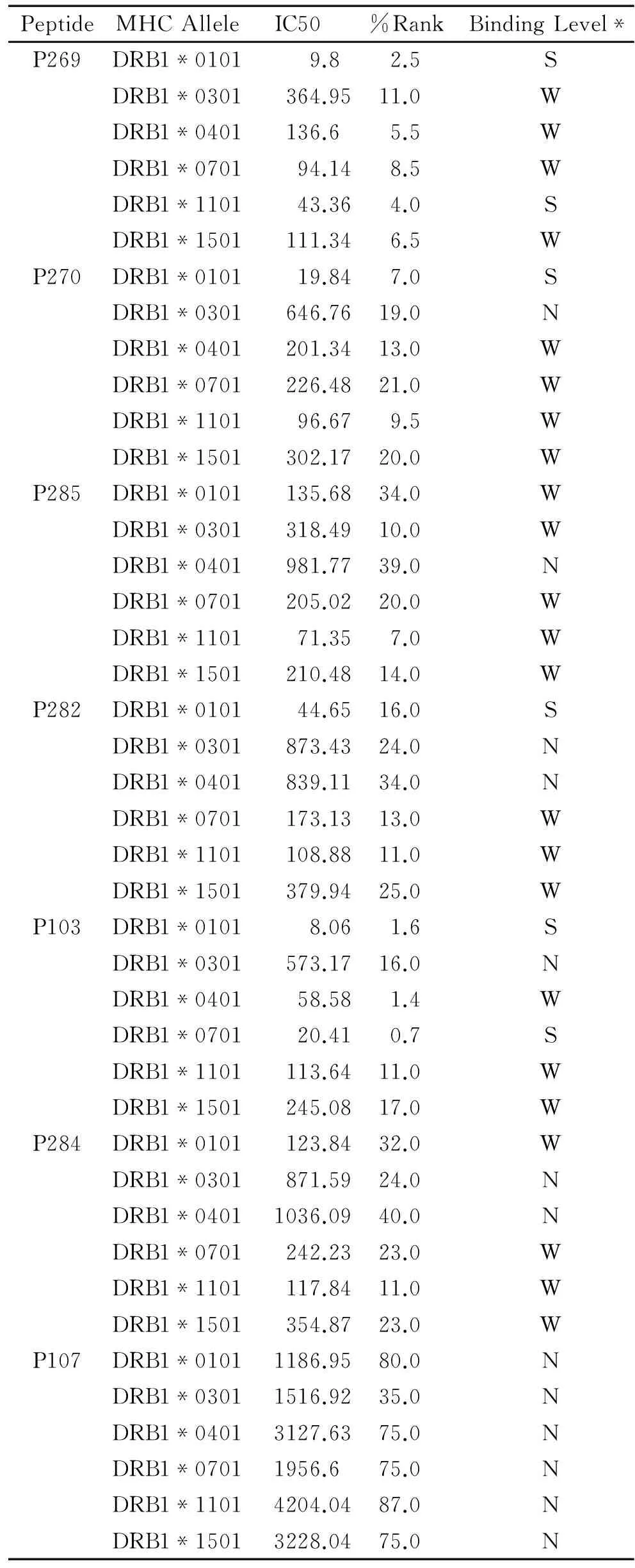
表3 候选肽与与MHC-II类抗原的亲和力
注:S表示强结合,W表示结合力弱,N表示该肽段与相应基因型无结合力。
2.2.1候选肽附近MHC-II类抗原表位的预测利用SYFPEITHI服务器对MAGE-4的MHC-II类抗原表位进行预测,发现在上述P1,P2,P3,P4附近存在相应表位,而且某些序列可能为多种MHC-II型别限制性表位。结果见表2。
2.2.2候选肽与MHC-II类抗原的亲和力利用NetMHCIIpan 3.1服务器对P269,P270,P285,P282,P284,P103,P107与MHC-II类抗原的亲和力进行预测。预测结果见表3。从结果可以看出,P269,P285,P103与多种型别的MHC-II类抗原都具有不同程度的亲和力。
本研究利用在线预测工具,筛选到3条肽段P269(RYEFLWGPRALAETS),P285(VKVLEHVVRVNARVR),P103(ESLFREALSNKVDEL)既存在HLA-A*0201限制性CD8+T细胞表位,又能与多种型别的MHC-II抗原结合,为后续研究肿瘤抗原MAGE-4用于肿瘤的免疫治疗肽段的选择提供了依据。
3讨论
近年来,基于肽疫苗的肿瘤免疫治疗取得了一定疗效,成为肿瘤治疗研究的热点。最常见的是利用肿瘤抗原诱导肿瘤特异性的CD8+T细胞和CD4+T细胞的反应。肿瘤细胞往往表达肿瘤抗原肽,通常为8~10个氨基酸左右,能够被CD8+T细胞识别,诱导CTL反应[8],其在机体抗肿瘤免疫中具有非常重要的作用[9,10]。Okuno 等发现 HLA-A*2402限制性9肽RNF43-721(NSQPVWLCL)或TOMM34-299(KLRQEVKQNL) 配合化疗,可以诱导结肠癌患者CTL反应,提高其长期生存率而没有副作用[11]。恶性黑色素瘤患者也发现,肽疫苗可以引起CTL介导的溶瘤作用[8,12,13]。
然而,研究发现在辅助性CD4+T细胞缺陷的动物模型,此类肽疫苗的效果并不理想,提示其在肿瘤免疫中同样具有重要作用[14]。给转移性黑色素瘤患者过继性输入NY-ESO-1(一种黑色素相关抗原)特异性CD4+T细胞可以引起持久的临床缓解,由其介导的表位扩展可能为抗瘤效应的机制之一[15]。活化的CD4+T细胞可以分泌多种细胞因子,增强DC细胞的抗原提呈能力[16],对于形成抗瘤记忆性反应也具有重要作用[17]。近年来的研究发现,CD4+T细胞亦可形成细胞毒性T细胞,其胞毒作用受MHC-II抗原限制[18]。辅助性T细胞识别由MHC-II类分子提呈的抗原肽,长度往往为13-18个氨基酸[19]。
基于CD8+T细胞与CD4+T细胞在抗瘤免疫中的重要作用,已有联合表位免疫治疗的研究,并显示一定的效果。Haydn T.等将一包含MHC-I和MHC-II限制性表位的前列腺癌抗原肽免疫小鼠,可同时诱导小鼠CD8+T细胞和CD4+T细胞的反应,并具有明显的抗瘤效应[20]。Welters MJ等发现HPV(人乳头瘤病毒)的联合长表位亦可引起宫颈癌特异性的CD8+T细胞与CD4+T细胞反应[21]。
然而,并不是所有的肽段都适合用做免疫治疗。理想的肽段除在肿瘤中具有较高的阳性率和特异性外,还必须对肿瘤的发生、发展具有重要作用,以免肿瘤逃逸导致的免疫失效[22]。MAGE-4是一种CTA,属于MAGE家族,其基因定位于X染色体,可能参与了结肠癌的发生与远处转移[23,24]。同时由于其在正常机体的限制性表达与结肠癌中的较高阳性率,使其成为免疫治疗的潜在靶标[6]。
本研究中,我们利用网络资源对MAGE-4的CD8+T细胞表位与CD4+T细胞表位进行预测,发现在P269(RYEFLWGPRALAETS),P285(VKVLEHVVRVNARVR),P103(ESLFREALSNKVDEL)等周围可能存在联合表位,为用于结肠癌的免疫治疗MAGE-4相关肽段的选择提供了依据。
参考文献
[1]Pernot S, Terme M, Voron T, et al. Colorectal cancer and immunity: what we know and perspectives[J]. World journal of gastroenterology. 2014,20(14):3738-3750
[2]徐红, 毛一香, 张学光,等. 晚期消化道肿瘤患者化疗前后外周血血浆细胞因子的变化[J]. 肿瘤防治研究. 2008,(3):196-200
[3]邹静, 刘斌, 陈雪华, 等. 肺癌患者外周血T淋巴细胞亚群变化特点及临床意义[J]. 中国免疫学杂志. 2010,(11):1016-1020
[4]王盛典, 贾明明. 肿瘤免疫微环境在肿瘤常规治疗效应中的作用[J]. 中国肿瘤生物治疗杂志. 2012,(3):229-238
[5]Old L J, Chen Y T. New paths in human cancer serology[J]. The Journal of experimental medicine,1998,187(8):1163-1167
[6]Li M, Yuan Y H, Han Y, et al. Expression profile of cancer-testis genes in 121 human colorectal cancer tissue and adjacent normal tissue[J].Clinical cancer research : an official journal of the American Association for Cancer Research,2005,11(5):1809-1814
[7]Andreatta M, Karosiene E, Rasmussen M, et al. Accurate pan-specific prediction of peptide-MHC class II binding affinity with improved binding core identification[J]. Immunogenetics,2015,67(11-12):641-650
[8]Darrow T L, Slingluff C L, Jr., Seigler H F. The role of HLA class I antigens in recognition of melanoma cells by tumor-specific cytotoxic T lymphocytes. Evidence for shared tumor antigens[J]. Journal of immunology,1989,142(9):3329-3335
[9]Kast W M, Offringa R, Peters P J, et al. Eradication of adenovirus E1-induced tumors by E1A-specific cytotoxic T lymphocytes[J]. Cell,1989,59(4):603-614
[10]Salgia R, Lynch T, Skarin A, et al. Vaccination with irradiated autologous tumor cells engineered to secrete granulocyte-macrophage colony-stimulating factor augments antitumor immunity in some patients with metastatic non-small-cell lung carcinoma[J]. Journal of clinical oncology:official journal of the American Society of Clinical Oncology,2003,21(4):624-630
[11]Kono K,Mizukami Y, Daigo Y, et al. Vaccination with multiple peptides derived from novel cancer-testis antigens can induce specific T-cell responses and clinical responses in advanced esophageal cancer[J].Cancer science,2009,100(8):1502-1509
[12]Chianese-Bullock K A, Pressley J, Garbee C, et al. MAGE-A1-, MAGE-A10-, and gp100-derived peptides are immunogenic when combined with granulocyte-macrophage colony-stimulating factor and montanide ISA-51 adjuvant and administered as part of a multipeptide vaccine for melanoma[J]. Journal of immunology,2005,174(5):3080-3086
[13]Yamshchikov G V, Barnd D L, Eastham S, et al. Evaluation of peptide vaccine immunogenicity in draining lymph nodes and peripheral blood of melanoma patients[J]. International journal of cancer Journal international du cancer,2001,92(5):703-711
[14]Kayaga J, Souberbielle B E, Sheikh N, et al. Anti-tumour activity against B16-F10 melanoma with a GM-CSF secreting allogeneic tumour cell vaccine[J]. Gene therapy,1999,6(8):1475-1481
[15]Hunder N N, Wallen H, Cao J, et al. Treatment of metastatic melanoma with autologous CD4+ T cells against NY-ESO-1[J]. The New England journal of medicine,2008,358(25):2698-2703
[16]Matsui S, Ahlers J D, Vortmeyer A O, et al. A model for CD8+ CTL tumor immunosurveillance and regulation of tumor escape by CD4 T cells through an effect on quality of CTL[J]. Journal of immunology,1999,163(1):184-193
[17]Bai A, Kokkotou E, Zheng Y, et al. Role of acid sphingomyelinase bioactivity in human CD4+ T-cell activation and immune responses[J]. Cell death & disease. 2015,6:e1828
[18]Quezada S A, Simpson T R, Peggs K S, et al. Tumor-reactive CD4(+) T cells develop cytotoxic activity and eradicate large established melanoma after transfer into lymphopenic hosts[J]. The Journal of experimental medicine,2010,207(3):637-650
[19]Slingluff C L, Jr. The present and future of peptide vaccines for cancer: single or multiple, long or short, alone or in combination[J]. Cancer journal. 2011,17(5):343-350
[20]Kissick H T, Sanda M G, Dunn L K, et al. Immunization with a peptide containing MHC class I and II epitopes derived from the tumor antigen SIM2 induces an effective CD4 and CD8 T-cell response[J]. PLoS One,2014,9(4):e93231
[21]Welters M J, Kenter G G, Piersma S J, et al. Induction of tumor-specific CD4+ and CD8+ T-cell immunity in cervical cancer patients by a human papillomavirus type 16 E6 and E7 long peptides vaccine[J]. Clinical cancer research : an official journal of the American Association for Cancer Research,2008,14(1):178-187
[22]Galaine J, Borg C, Godet Y, et al. Interest of Tumor-Specific CD4 T Helper 1 Cells for Therapeutic Anticancer Vaccine[J]. Vaccines. 2015,3(3):490-502
[23]De Plaen E, Arden K, Traversari C, et al. Structure, chromosomal localization, and expression of 12 genes of the MAGE family[J]. Immunogenetics,1994,40(5):360-369
[24]Suri A, Jagadish N, Saini S, et al. Targeting cancer testis antigens for biomarkers and immunotherapy in colorectal cancer: Current status and challenges[J]. World journal of gastrointestinal oncology,2015,7(12):492-502
(2016-02-27收稿)(岳静玲编辑)
Prediction of MHC-I/MHC-II restricted epitope peptide of MAGE-4
LIUXiaoliang
(ShanxiMedicalUniversityFenyangCollege,Lvliang,032200)
[ABSTRACT]ObjectiveTo predict the MHC-I/MHC-II restricted epitope peptide of MAGE-4.MethodsThe amino acid of MAGE-4 was retrieved by NCBI protein datebase.Based on this,HLA-A*0201 restricted epitope peptide was predicted by BIMAS、SYFPEITH1 and IEDB on line service.Then we used SYFPEITHI and NetMHCIIpan 3.1 to predicted MHC-II restricted peptide.ResultsThree peptides were obtained,which contain MHC-I restricted epitope as well as MHC-II restricted epitope.ConclusionThis result provide a basis for choosing peptides in order to immunotherapy of colorectal cancer.
[KEYWORDS]MAGE-4.MHC-I restricted.MHC-II restricted.Immunotherapy
【作者简介】刘晓梁(1985-),男,医学硕士,助教,研究方向:肿瘤免疫。
[中图分类号]R 392
[文献标识码]A
[文章编号]2095-2694(2016)03-174-05

