鼠源吲哚胺2,3-双加氧酶活性检测方法的建立
郭占领 李娟娟 杨 青,2△
(1复旦大学生命科学学院生物化学系 上海 200438;2云南天然产物与生物制药协同创新中心 昆明 650091)
鼠源吲哚胺2,3-双加氧酶活性检测方法的建立
郭占领1李娟娟1杨青1,2△
(1复旦大学生命科学学院生物化学系上海200438;2云南天然产物与生物制药协同创新中心昆明650091)
【摘要】目的建立鼠源吲哚胺2,3-双加氧酶 (mouse indoleamine 2,3-dioxygenase,mIDO) 活性检测方法。方法利用基因工程方法表达纯化重组mIDO (recombinant mIDO,rmIDO),建立酶水平mIDO活性检测体系;构建过表达mIDO的小鼠Lewis肺癌 (Lewis lung cancer,LLC) 细胞株,建立细胞水平mIDO活性检测体系。比较L-1-甲基色氨酸 (L-1-methyl tryptophan,L-1-MT) 在酶及细胞水平上对mIDO及人源IDO (human IDO,hIDO)的抑制作用,测定抑制类型、抑制常数Ki值及半数抑制浓度 (IC50) 值。 结果L-1-MT对mIDO和hIDO均有抑制作用,抑制类型及抑制常数Ki值相似,但IC50值在酶水平及细胞水平上均有差异。 结论mIDO酶活性检测体系是筛选IDO抑制剂的有效工具,与hIDO酶活性检测体系联用,能反映种属差异,可更好地利用小鼠模型来替代人类进行IDO抑制剂治疗疾病的研究。
【关键词】吲哚胺2,3-双加氧酶;鼠源;人源;活性检测体系;L-1-甲基色氨酸
吲哚胺2,3-双加氧酶 (indoleamine 2,3-dioxygenase,IDO)是哺乳动物中催化色氨酸沿着犬尿氨酸途径 (kynurenine pathway) 代谢的第一个限速酶[1],也是细胞内一种含亚铁血红素的单体胞质蛋白酶,最早被发现于1967年[2],广泛分布于人和动物的细胞和组织中[3]。人源IDO (human IDO,hIDO)蛋白由403个氨基酸组成,相对分子质量(Mr)为45 324[4],鼠源IDO (mouse IDO,mIDO)蛋白由407个氨基酸组成,Mr为45 639,通过序列比对发现,mIDO与hIDO有62%的同源一致性[5]。mIDO与hIDO具有相似的催化色氨酸代谢的生化功能,二级结构特征基本相似,但也存在差异,尤其是α-螺旋部分,它们在对不同底物的选择性、pH耐受性以及抑制剂的抑制效力上也有差异[6]。
IDO的活性或表达的异常升高,与人类一些重大疾病有着密切关系[7]。IDO已被证实是阿尔茨海默病[8]、抑郁症、癌症等疾病治疗药物的研发靶标[9],筛选获得高效的IDO抑制剂可为上述疾病的治疗提供有效方案。L-1-甲基色氨酸 (L-1-methyl tryptophan,L-1-MT) 是发现较早、与底物色氨酸结构最接近的竞争性IDO抑制剂,也是公认的研究比较透彻的IDO抑制剂[10-11]。目前广泛应用小鼠模型替代人类进行疾病及药物研究。近年来在IDO抑制剂作为抗肿瘤候选药物的研究中,小鼠模型更是占有主导地位[12-14]。因此在IDO抑制剂筛选时,有必要同时考查化合物对mIDO和hIDO的抑制作用,以便建立mIDO与hIDO活性检测体系之间的相关性,使小鼠模型的数据更好地应用到人类疾病治疗的研究中。
本研究克隆表达纯化重组mIDO (recombinant mIDO,rmIDO),结合实验室已有的重组hIDO (recombinant hIDO,rhIDO)[15],分别建立酶及细胞水平上不同种源IDO的活性检测体系,以评价L-1-MT对不同种源IDO酶的抑制作用,并寻找两种酶活性检测体系之间的相关性,旨在探索mIDO与hIDO在酶动力学上的关系。
材 料 和 方 法
试剂和药品L-1-MT、异丙基-β-D硫代半乳糖苷 (IPTG) (美国Sigma-Aldrich 公司);L-色氨酸、对二氨基苯甲醛、亚甲基蓝 (日本Wako公司);过氧化氢酶、5-氨基乙酰丙酸盐酸盐 (5-ALA)、苯甲基磺酰氟 (PMSF) (上海阿拉丁生化科技股份有限公司);PrimeSTAR Max DNA聚合酶 (日本Takara公司);NovoRec®PCR一步定向克隆试剂盒 (上海近岸蛋白质科技有限公司);DMEM培养基、0.25%胰蛋白酶 (美国Gibco公司);HyClone胎牛血清、Lipofectamine 2000 (美国Thermo Fisher公司);PVDF膜 (美国Millipore公司);mIDO cDNA (美国GE公司)。
设备和仪器高速离心机、超低温冰箱、Forma系列CO2培养箱、Multiskan MK3型酶标仪 (美国 Thermo Fisher公司);SW-CJ系列标准型洁净工作台 (苏州安泰空气技术有限公司);倒置显微镜 (日本Olympus公司);凝胶成像仪 (上海分析仪器总厂);PCR仪、转膜仪 (美国Bio-Rad公司);BG-垂直电泳仪、BG-水平电泳仪 (北京百晶生物技术有限公司)。
重组质粒的构建利用NovoRec重组酶构建质粒,根据其操作技术手册设计PCR引物。引物包括5’端不少于15 bp与载体同源的序列以及20~25 bp目的片段特异性序列,使得到的目的片段两端有不少于15 bp的序列与线性化载体两端一致,引物序列及酶切位点信息见表1。
以mIDO cDNA为PCR模板,利用PrimeSTAR Max DNA聚合酶进行PCR反应,获得目的片段,反应条件:98 ℃预变性3 min;98 ℃、10 s,55 ℃、12 s,72 ℃、1 min,28个循环;72 ℃延伸10 min。PCR扩增产物进行琼脂糖凝胶电泳鉴定,利用胶回收试剂盒回收扩增片段。用NcoI、XhoI双酶切载体质粒pET28a (+),用KpnI、EcoRI双酶切载体质粒pcDNA3.1 (+),并回收线性化片段。
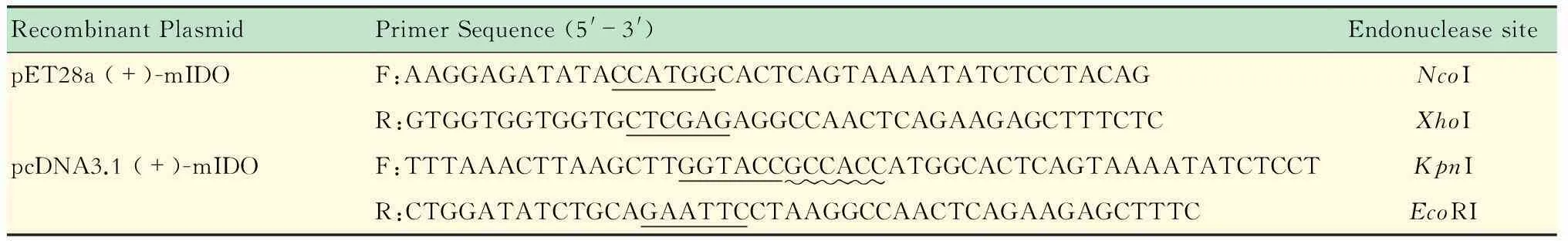
表1 PCR引物序列
Underlined with solid lines:The endonuclease site sequence; Underlined with wavy line:The Kozak sequence.
将目的DNA片段与线性化载体片段依照3∶1~10∶1的摩尔比加入PCR管中并加入NovoRec重组酶及缓冲液,混匀后在37 ℃水浴中反应20 min,结束后立刻将重组反应液转化到大肠埃希菌DH5α感受态细胞中,37 ℃恒温培养箱中过夜,次日挑取平板上中等大小克隆在含抗生素的LB培养基中扩增,抽提质粒,进行双酶切验证,并将鉴定正确的阳性克隆送至苏州金唯智生物科技有限公司测序。
rmIDO蛋白的表达mIDO蛋白的表达参照Austin等[16]关于hIDO蛋白表达的研究进行。将测序验证正确的重组质粒pET28a (+)-mIDO转化到大肠埃希菌BL21 (DE3)感受态细胞中,从转化平板上随机挑取单克隆于含有50μg/mL卡那霉素的100 mL LB细菌培养基中,过夜培养。将100 mL培养物加入到同样的 900 mL LB 培养基中,37 ℃孵育至菌液密度在600 nm处的吸光度(D)值达到 0.6 时将温度降至室温并加入5-ALA溶液,再加入终浓度为 0.5 mmol/L的IPTG,室温诱导表达过夜。4 ℃下5 400×g离心20 min收集菌体,再用20 mL预冷的PBS(含1 mmol/L PMSF)重悬菌体,同样条件离心,将收集的菌体冻存在-80 ℃待用(保存至多1个月)或进行下一步的纯化。
rmIDO蛋白的纯化用适量预冷的PBS (含1 mmol/L PMSF) 重悬菌体,超声破碎;4 ℃下13 800×g离心20 min,取上清。预先用含10 mmol/L咪唑的磷酸盐缓冲液 (20 mmol/L,pH=7.4,含150 mmol/L NaCl)平衡5 mL预装Ni-NTA亲和层析柱 (美国GE Healthcare 公司),将上清流经柱体蛋白挂柱后,分别用10个柱体积的含20 mmol/L咪唑和40 mmol/L咪唑的磷酸盐缓冲液洗去非特异性结合的杂蛋白,再用洗脱缓冲液 (含250 mmol/L咪唑的磷酸盐缓冲液)洗脱下rmIDO蛋白。将得到的蛋白用超滤离心管 (美国Millipore公司)浓缩纯化,采用Sephadex G-25脱盐柱 (美国GE Healthcare公司)和50 mmol/L 磷酸钾缓冲液 (pH=6.5),得到纯化的rmIDO蛋白。纯化后的蛋白用SDS-PAGE电泳分离并用考马斯亮蓝G-250染色,然后脱色检测。
酶水平mIDO活性检测mIDO活性检测体系在Takikawa等[17]的研究基础上改进优化而来,500μL标准反应体系中含有50 mmol/L的磷酸钾缓冲液 (pH=6.5)、40 mmol/L抗坏血酸、200μg/mL过氧化氢酶、20μmol/L亚甲基蓝、底物L-色氨酸和IDO酶及待测样品。将该反应体系混匀后置于37 ℃水浴中孵育30 min,加入200μL质量浓度为30%的三氯乙酸溶液终止反应,在65 ℃水浴中加热15 min后,反应液于13 800×g离心5 min。取100μL上清与等体积质量浓度为2%的对二氨基苯甲醛的冰乙酸溶液混合,充分混匀后用酶标仪检测犬尿氨酸产生的黄色在492 nm处的吸光度(D)值。
抑制类型及Ki及IC50值测定在上述反应体系中加入200μmol/L抑制剂和不同浓度梯度的rmIDO,对照组只加不同浓度梯度的酶而未加抑制剂,处理方法同上。最后以反应速度对酶浓度作图,根据所得两条曲线的对应关系判定抑制剂的抑制类型。抑制剂的IC50值及抑制常数Ki值的测定同样利用上述反应体系,加入不同浓度的底物,在一个底物浓度下加入不同浓度的抑制剂,其他处理方法同上。最后以抑制率对抑制剂浓度作图,利用改良寇氏法计算出IC50值,以Dixon作图法[18]得到Ki值。
LLC细胞培养及转染LLC细胞株购自中国科学院细胞库 (TCM 7),采用含有10%胎牛血清的DMEM高糖培养基于37 ℃、5% CO2培养箱中培养。将细胞吹打均匀传代于6孔板里,待细胞生长至80%~90%融合时进行转染。按照Lipofectamine 2000的说明书进行操作,并稍作改良:吸弃含血清培养基并用PBS洗涤细胞2次,每孔加入1 500μL无血清培养基。质粒pcDNA3.1 (+)-mIDO和脂质体(每孔2.5 ng质粒和5μL脂质体)分别加入到预装有125μL Opti-MEM培养基的EP管中并轻轻吹打混匀,5 min后将两者混合,室温孵育20 min后逐滴均匀加入待转染细胞培养液中,37 ℃、5% CO2培养箱培育4~6 h后换成含10%胎牛血清的DMEM培养基,培养24 h后收集细胞行Western blot检测IDO蛋白的表达。
细胞水平mIDO活性检测将转染pcDNA3.1 (+)-mIDO质粒培养24 h后的LLC细胞以2.0×104/孔的密度种植于96孔板里,加入待测药物,每孔200μL培养基,孵育12 h后,取150μL上清加入另一块96孔板中,并加入50μL质量浓度为30%的三氯乙酸,65 ℃加热15 min,13 800 × g 离心5 min。取100μL上清与等体积质量浓度为2%的对二氨基苯甲醛的冰乙酸溶液混合,充分混匀后用酶标仪检测犬尿氨酸产生的黄色在492 nm处的吸光度(D)值。
Western blot检测提取细胞总蛋白,经BCA法测定蛋白质浓度。取等量蛋白样品及蛋白标准品点样进行SDS-PAGE电泳,电泳结束后将PAGE胶中的蛋白质转印到PVDF膜上,5%脱脂牛奶常温封闭2 h。加入抗鼠IDO一抗 (1∶200)、GAPDH一抗 (1∶2 000),4 ℃孵育过夜,经PBST (含0.3% Tween-20的PBS溶液)溶液洗膜3次,每次10 min,然后加入相应的二抗 (1∶1 000)室温缓慢震荡1 h,PBST洗膜后用化学发光试剂盒显色,并对mIDO的表达进行检测。
hIDO的酶及细胞水平活性检测方法hIDO的表达纯化、过表达细胞株的构建、酶及细胞水平活性检测方法等实验步骤参照文献[15],抑制类型及Ki值、IC50值测定等实验步骤参照文献[19]。
结果
重组质粒的鉴定mIDO的蛋白质编码区大小为1 224 bp,将重组质粒双酶切验证,分别用NcoI、XhoI双酶切重组质粒pET28a (+)-mIDO,用KpnI、EcoRI双酶切重组质粒pcDNA3.1 (+)-mIDO,酶切产物用琼脂糖凝胶电泳检测,发现在1 200 bp左右出现DNA条带 (图1),测序结果经比对软件分析,重组质粒中的基因序列完全正确,酶切、测序结果表明两重组质粒构建成功。
M:DNA marker; Lane 1:pET28a (+)-mIDO (NcoI+XhoI ); Lane 2:pcDNA3.1 (+)-mIDO (KpnI+EcoRI ).
图1重组质粒pET28a (+)-mIDO和pcDNA3.1 (+)-
mIDO的酶切验证
Fig 1Restriction endonuclease analysis of recombinant
plasmid pET28a (+)-mIDO and pcDNA3.1 (+)-mIDO
mIDO蛋白的表达纯化诱导后超声破菌的上清及经过Ni-NTA亲和层析柱纯化的蛋白质均通过SDS-PAGE分析 (图2),在Mr约45 000处可见到特异的目的蛋白条带,与文献[16]的报道一致,而未诱导的重组菌、未挂柱蛋白、20 mmol/L咪唑及40 mmol/L咪唑洗脱蛋白则无此条带。使用BandScan软件分析目的条带的纯度为91.2%。诱导前后的蛋白经过Western blot检测进一步验证为mIDO蛋白(图3),为下一步的酶水平mIDO活性检测提供了依据。1 L大肠埃希菌发酵液可获得10 mg纯化的rmIDO蛋白,比活力为136μmoL·h-1·mg-1。
M:Protein molecular weight marker; Lane 1:Protein before induction; Lane 2:Protein after induction; Lane 3:Soluble lysate protein; Lane 4:Protein of no specific combination with Ni-NTA chelating column; Lane 5:Protein eluted at 20 mmol/L imidazole; Lane 6:Protein eluted at 40 mmol/L imidazole; Lane 7:Protein eluted at 250 mmol/L imidazole.
图2表达纯化rmIDO蛋白的SDS-PAGE分析
Fig 2SDS-PAGE analysis of purified rmIDO protein
Lane 1:Total protein before induction,no expression of mIDO; Lane 2:Total protein after induction,notable expression of mIDO.
图3IPTG诱导前后rmIDO蛋白的表达
Fig 3Expression of rmIDO protein before and
after IPTG induction
过表达mIDO的LLC细胞株鉴定LLC细胞转染质粒pcDNA3.1 (+)-mIDO,培养24 h,提取总蛋白,进行Western blot检测 (图4)。转染质粒pcDNA3.1 (+)-mIDO的LLC细胞中有mIDO蛋白表达,且表达量很高,但未转染质粒及转染空质粒pcDNA3.1 (+)的LLC细胞中无mIDO蛋白表达。独立实验重复3次,结果均一致,为下一步细胞水平mIDO酶活性检测提供了依据。
Lane 1:LLC cells without plasmid transfection;Lane 2:LCC cells transfected pcDNA3.1(+);Lane 3:LLC cells transfected recombinant plasmid pcDNA3.1(+)-mIDO.
图4转染pcDNA3.1 (+)-mIDO的LLC
细胞中mIDO蛋白的表达
Fig 4Expression of mIDO protein in pcDNA3.1 (+)-
mIDO transfected LLC cells
L-1-MT对mIDO和hIDO的抑制类型、Ki及IC50值固定L-1-MT的浓度为200μmol/L,与不同浓度梯度的IDO酶反应并测定速度,对照组不加L-1-MT,最终以反应速度对酶浓度作图(图5A),根据曲线的特征可以判定L-1-MT为IDO的可逆抑制剂。根据IDO活性检测体系,在一个底物浓度下加入不同浓度的抑制剂,以抑制率对抑制剂浓度作图(图5B),利用改良寇氏法计算出L-1-MT对IDO酶的IC50值,并改变不同的底物浓度,以Dixon作图法作图(图5C),得到L-1-MT对IDO酶的Ki值。利用过表达IDO的细胞株测定L-1-MT在细胞水平对IDO的抑制活性,以抑制率对抑制剂浓度作图(图5D),并计算出IC50值。L-1-MT对不同种源IDO的抑制类型、ki IC50值的检测结果见表2。
讨论
本实验成功构建了mIDO的重组表达载体pET28a (+)-mIDO,表达纯化得到的rmIDO蛋白由SDS-PAGE及Western blot验证。利用建立的酶活性检测体系检测L-1-MT在酶水平对mIDO和hIDO酶的抑制效果,发现L-1-MT对两种酶的抑制类型一致,均为可逆竞争性抑制,抑制常数Ki值也很接近 (对rmIDO的Ki值为29.73μmol/L,对rhIDO的Ki值为32.97μmol/L),但IC50值存在一定差异。L-1-MT对mIDO和hIDO的IC50值分别为362.67和438.74 μmol/L,说明相较hIDO,L-1-MT对mIDO的抑制效力更强。本实验还构建了利用mIDO的真核生物表达载体pcDNA3.1 (+)-mIDO转染鼠LLC细胞并表达mIDO蛋白,建立了细胞水平mIDO活性检测体系,并分别检测细胞水平上L-1-MT对mIDO和hIDO的抑制效力,发现其对IDO在细胞水平上的抑制效力要远高于酶水平,且对LLC-mIDO及HEK293-hIDO的IC50值不同,分别为16.82和21.63 μmol/L,差异与酶水平结果相当。

表 2 L-1-MT mIDO和hIDO的抑制类型及相应的Ki和IC50值
aKinetic parameters and IC50values are the mean of at least three independent assays;bRecombinant IDO.
以上结果说明L-1-MT对mIDO与hIDO具有相同的抑制类型,但在抑制效力方面可能会存在差异。这与mIDO、hIDO空间结构的差异有关,两种来源的IDO酶具有62%的序列同源一致性,活性中心氨基酸序列具有100%同源一致性[20],但mIDO和hIDO二级结构中α-螺旋的比例不同,分别为71%和61%[6];鼠源和人源细胞在转运与代谢上的差异也会影响IDO细胞水平活性检测的结果[6]。
A:Plot of reaction rate to enzyme concentration;B:IC50values of L-1-MT to rmIDO and rhIDO by enzymatic assay (IC50values were calculated by modified Karber’s method);C:Determination of kinetic parameters of L-1-MT in rmIDO and rhIDO;D:IC50values of L-1-MT in cellular assay (Determination of mIDO transfected LLC cells and hIDO transfected HEK 293 cells).
图5L-1-MT对不同种源IDO的抑制类型及相应Ki、IC50值的测定
Fig 5Determination of the inhibition type,Ki and IC50values of L-1-MT on different species of IDO
本实验的研究成果为以后IDO抑制剂的筛选提供了mIDO酶活性检测平台,使得对抑制剂的筛选更全面,有助于更好地利用小鼠模型来替代人类进行IDO抑制剂治疗疾病的研究。
参考文献
[1]TAKIKAWA O,YOSHIDA R,KIDO R,etal.Tryptophan degradation in mice initiated by indoleamine 2,3-dioxygenase[J].JBiolChem,1986,261 (8):3648-3653.
[2]YAMAMOTO S,HAYAISHI O.Tryptophan pyrrolase of rabbit intestine.D-and L-tryptophan-cleaving enzyme or enzymes[J].JBiolChem,1967,242 (22):5260-5266.
[3]TAKIKAWA O.Biochemical and medical aspects of the indoleamine 2,3-dioxygenase-initiated L-tryptophan metabolism[J].BiochemBiophysResCommun,2005,338 (1):12-19.
[4]TONE S,TAKIKAWA O,HABARA-OHKUBO A,etal.Primary structure of human indoleamine 2,3-dioxygenase deduced from the nucleotide sequence of its cDNA[J].NucleicAcidsRes,1990,18 (2):367.
[5]HABARA-OHKUBO A,TAKIKAWA O,YOSHIDA R.Cloning and expression of a cDNA encoding mouse indoleamine 2,3-dioxygenase[J].Gene,1991,105 (2):221-227.
[6]AUSTIN CJD,ASTELBAUER F,KOSIM-SATYAPUTRA P,etal.Mouse and human indoleamine 2,3-dioxygenase display some distinct biochemical and structural properties[J].AminoAcids,2009,36 (1):99-106.
[7]TAKIKAWA O.Clinical aspects of indoleamine 2,3-dioxygenase (IDO)-initiated tryptophan metabolism:IDO is a target of drug discovery for various diseases[J].IntCongrSer,2007,1304:290-297.
[8]YU D,TAO BB,YANG YY,etal.The IDO inhibitor coptisine ameliorates cognitive impairment in a mouse model of Alzheimer′s disease[J].JAlzheimersDis,2015,43 (1):291-302.
[9]孔令雷,匡春香,杨青.IDO抑制剂的研究进展[J].中国药物化学杂志,2009,19 (2):147-154.
[10]CADY SG,SONO M.1-Methyl-DL-tryptophan,beta-(3-benzofuranyl)-DL-alanine (the oxygen analog of tryptophan),and beta-[3-benzo (b) thienyl]-DL-alanine (the sulfur analog of tryptophan) are competitive inhibitors for indoleamine 2,3-dioxygenase[J].ArchBiochemBiophys,1991,291 (2):326-333.
[11]KATZ JB,MULLER AJ,PRENDERGAST GC.Indoleamine 2,3-dioxygenase in T-cell tolerance and tumoral immune escape[J].ImmunolRev,2008,222:206-221.
[12]MULLER AJ,MALACHOWSKI WP,PRENDERGAST GC.Indoleamine 2,3-dioxygenase in cancer:targeting pathological immune tolerance with small-molecule inhibitors[J].ExpertOpinTheTargets,2005,9 (4):831-849.
[13]MULLER AJ,DUHADAWAY JB,DONOVER PS,etal.Inhibition of indoleamine 2,3-dioxygenase,an immunoregulatory target of the cancer suppression gene Bin1,potentiates cancer chemotherapy[J].NatMed,2005,11 (3):312-319.
[14]HOU DY,MULLER AJ,SHARMA MD,etal.Inhibition of indoleamine 2,3-dioxygenase in dendritic cells by stereoisomers of 1-methyl-tryptophan correlates with antitumor responses[J].CancerRes,2007,67 (2):792-801.
[15]YU CJ,ZHENG MF,KUANG CX,etal.Oren-gedoku-to and its constituents with therapeutic potential in Alzheimer′s disease inhibit indoleamine 2,3-dioxygenase activityinvitro[J].JAlzheimersDis,2010,22 (1):257-266.
[16]AUSTIN CJD,MIZDRAK J,MATIN A,etal.Optimised expression and purification of recombinant human indoleamine 2,3-dioxygenase[J].ProteinExprPurif,2004,37 (2):392-398.
[17]TAKIKAWA O,KUROIWAT,YAMAZAKI F,etal.Mechanism of interferon-gamma action.Characterization of indoleamine 2,3-dioxygenase in cultured human cells induced by interferon-gamma and evaluation of the enzyme-mediated tryptophan degradation in its anticellular activity[J].JBiolChem,1988,263(4):2041-2048.
[18]CORTES A,CASCANTE M,CARDENAS ML,etal.Relationships between inhibition constants,inhibitor concentrations for 50% inhibition and types of inhibition:new ways of analysing data[J].BiochemJ,2001,357 (Pt 1):263-268.
[19]YANG S,LI X,HU F,etal.Discovery of tryptanthrin derivatives as potent inhibitors of indoleamine 2,3-dioxygenase with therapeutic activity in Lewis lung cancer (LLC) tumor-bearing mice[J].JMedChem,2013,56 (21):8321-8331.
[20]RÖHRIG UF,AWAD L,GROSDIDIER A,etal.Rational Design of Indoleamine 2,3-Dioxygenase Inhibitors[J].JMedChem,2010,53 (3):1172-1189.
Establishment of the mouse indoleamine 2,3-dioxygenase activity assay system
GUO Zhan-ling1,LI Juan-juan1,YANG Qing1,2△
(1DepartmentofBiochemistry,SchoolofLifeSciences,FudanUniversity,Shanghai200438,China;2TheCollaborativeInnovationCenterofYunnanNaturalProductsandBiologicalPharmacy,Kunming650091,YunnanProvince,China)
【Abstract】ObjectiveTo establish a mouse indoleamine 2,3-dioxygenase (mIDO) activity assay system.MethodsRecombinant mIDO (rmIDO) expressed and purified by genetic engineering methods was used to set up an enzymatic mIDO activity assay method, and mIDO overexpressing Lewis lung cancer (LLC) cell line was constructed to establish a cellular mIDO activity assay method.The inhibitory activity of Lewis lung cancer (L-1-MT) on mIDO and human IDO (hIDO) in enzymatic and cellular level were investigated respectively,including inhibition type,kinetic parameters Ki and IC50values.ResultsL-1-MT showed inhibitory effects on mIDO and hIDO,and inhibition type and Ki values were similar,while IC50values were distinct in both enzymatic and cellular levels.ConclusionsThe established mIDO activity assay system is an effective tool for screening IDO inhibitors. It can reflect the species difference when combined with hIDO activity assay system,and is useful for the research on therapeutic effect of IDO inhibitors with mouse model instead of human beings.
【Key words】indoleamine 2,3-dioxygenase;mouse;human;activity assay system;L-1-methyl tryptophan
【中图分类号】Q331, Q786
【文献标识码】A
doi:10.3969/j.issn.1672-8467.2016.03.018
(收稿日期:2015-09-06;编辑:段佳)
国家自然科学基金 (81373396);高等学校博士学科点专项科研基金 (20130071110037);上海市科委生物医药重点课题 (12431900204)
△Corresponding authorE-mail:yangqing68@fudan.edu.cn
*This work was supported by the National Natural Science Foundation of China (81373396),the Research Fund for the Doctoral Program of Higher Education of China (20130071110037) and the Key Medical Project of Science and Technology Commission of Shanghai Municipality (12431900204).

