瑞巴派特对实验性结肠炎大鼠肠道黏膜的保护作用
徐 进, 杨 洁,王 斌, 陈 珺, 刘 颖, 刘涵翰
湖北医药学院附属人民医院 1.消化内科; 2.健康管理中心; 3.病理科,湖北 十堰 442000
瑞巴派特对实验性结肠炎大鼠肠道黏膜的保护作用
徐 进1, 杨 洁2,王 斌1, 陈 珺1, 刘 颖1, 刘涵翰3
湖北医药学院附属人民医院 1.消化内科; 2.健康管理中心; 3.病理科,湖北 十堰 442000
目的 探讨瑞巴派特对2, 4, 6-三硝基苯磺酸(TNBS)诱导的大鼠结肠炎的肠道黏膜保护作用及可能的作用机制。方法40只成年雌性SD大鼠随机分为对照组(G1)、模型组(G2)、瑞巴派特治疗组(G3)、奥沙拉嗪治疗组(G4),每组10只。连续治疗结束后取病变段肠组织,行结肠大体损伤评分;结肠组织匀浆检测白三烯B4(LTB4)含量、超氧化物歧化酶(SOD)及还原型谷胱甘肽(GSH-Px)活性;免疫组化法检测结肠组织环氧合酶-2(COX-2)和5-脂氧合酶(5-LOX)的表达量;酶联免疫吸附法检测血清TNF-α、IL-10含量。 结果 治疗后,与G2组比较,G3组和G4组的结肠大体损伤评分、血清TNF-α、IL-10水平、结肠组织LTB4水平均明显降低,而SOD、GSH-Px的活性均明显升高(P<0.05)。与G2组相比,G1、G3、G4组COX-2及5-LOX蛋白表达水平均明显降低(P<0.05)。G1组COX-2和5-LOX蛋白表达极弱,与G3、G4组比较,差异有统计学意义(P<0.05)。 结论 瑞巴派特对TNBS诱导的大鼠结肠炎有较好的治疗作用,其作用机制可能与上调结肠组织中SOD及GSH-Px的活性、调节细胞因子、降低COX-2及5-LOX的表达有关。
溃疡性结肠炎;瑞巴派特;环氧合酶-2;5-脂氧合酶
溃疡性结肠炎(ulcerative colitis, UC)是一种病因、发病机制尚未完全明确的结直肠慢性非特异性炎性反应。病变主要累及黏膜和黏膜下层,促炎与抗炎因子失衡及氧自由基损伤在UC发病过程中起重要作用[1]。瑞巴派特作为一种消化性溃疡的胃肠黏膜保护剂,已被证明具有抗溃疡、保护胃肠黏膜细胞、增加内源性前列腺素合成、激活一氧化氮系统、清除自由基的作用[2]。临床上应用瑞巴派特治疗UC取得一定的临床疗效[3],但其对肠道黏膜的保护作用机制尚不清楚,本实验研究瑞巴派特在三硝基苯磺酸(TNBS)诱导的大鼠结肠炎模型中的治疗作用,并试图探讨其可能的作用机制。
1 材料与方法
1.1 实验动物与主要试剂 清洁级健康成年雌性未育Sprague-Dawley(SD)大鼠40只,体质量200~220 g,由湖北医药学院动物实验中心提供[许可证号:SCXK(鄂)2011-0008],置于温度为(22±1)℃,湿度为50%~70%的净化动物饲养房内,混合饲料喂养,禁食不禁水。5%TNBS水溶液(美国Sigma公司)、瑞巴派特(浙江远力健药业)、奥沙拉嗪(天津力生制药)、白三烯B4(LTB4)酶联免疫吸附测定试剂盒(R&D Systems, Inc.)、还原型谷胱甘肽(GSH-Px)和超氧化物歧化酶(SOD)试剂盒均购于南京建成生物工程研究所;TNF-α、IL-10 ELISA试剂盒(武汉博士德生物工程有限公司)、兔抗鼠COX-2多克隆抗体及兔抗鼠5-LOX多克隆抗体(美国Cayman Chemical公司)。
1.2 实验方法
1.2.1 药物配制:将5% TNBS 20 ml溶于50%乙醇溶液20 ml,制成2.5% TNBS(V/V)溶液;1片瑞巴派特(100 mg)溶于20 ml生理盐水中;1片奥沙拉嗪(250 mg)溶于20 ml生理盐水,制成溶液后备用。
1.2.2 UC模型建立及分组:40只雌性SD大鼠随机分为对照组(G1)、模型组(G2)、瑞巴派特治疗组(G3)、奥沙拉嗪治疗组(G4),每组10只。模型建立参照文献[4],大鼠禁食48 h后,G1组采用25%乙醇溶液灌肠,1.0 ml/只,其他组采用2.5% TNBS(V/V)溶液灌肠,1.0 ml/只。24 h后,G1、G2组:每天无菌生理盐水灌胃,2.0 ml/只;G3组:每天瑞巴派特溶液灌胃,5 mg/kg;G4组:每天奥沙拉嗪溶液灌胃,125 mg/kg,共进行10 d。
1.2.3 取材:治疗结束后(第11天),所有大鼠20%乌拉坦腹腔注射(1.5 ml/只),麻醉后经腹主动脉无菌取血约2.0 ml,提取血清,-20 ℃保存,用于检测TNF-α、IL-10水平。从距肛门1.0 cm向结肠近端切取6.0 cm肠段,纵行切开,用无菌生理盐水洗净内容物,行大体损伤评分[5]。无损伤记0分,充血但无溃疡记1分,充血且肠壁变厚,但无溃疡记2分,有1处溃疡但无肠壁增厚记3分,有2处或2处以上溃疡/炎症记4分,有2处或2处以上大溃疡和炎症或有1处溃疡和炎症沿结肠纵轴超过1 cm记5分,沿结肠纵轴损伤超过2 cm以上,每超过1 cm增加1分,记6~10分。
1.2.4 结肠匀浆检测:结肠组织SOD、GSH-Px活性及LTB4含量的检测分别按照试剂盒说明书的要求切取肠段,去除脂肪系膜组织。加冰生理盐水低温制备10%匀浆。-20 ℃贮存待检测。
1.2.5 结肠组织COX-2、5-LOX免疫组化染色分析:取结肠病变部位组织,行免疫组化染色。细胞呈棕黄色为阳性,定位于细胞核和(或)细胞质。阳性细胞比率按如下方法计算,在染色最强部位随机选取3个视野,计算每只大鼠的平均阳性细胞比率,并按下述标准评分[6]:阳性细胞率≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。
1.2.6 血清TNF-α、IL-10水平的测定:酶联免疫吸附法(ELISA)检测,按照相应试剂盒说明书操作。
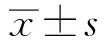
2 结果
2.1 灌肠后大鼠的一般情况 灌肠造模10~24 h后,G2、G3及G4组大鼠出现腹泻,解稀糊状便、水样便,伴黏液脓血,精神倦怠,皮毛无光泽,活动、进食减少;治疗后,G3、G4组上述症状逐渐缓解,但G2组症状无明显改善。而G1组大鼠仅出现解水样便、糊状便,3~4 d后恢复正常。整个实验期间,无大鼠死亡。
2.2 瑞巴派特对结肠炎大鼠各指标的影响 治疗10 d 后,G3组结肠损伤大体评分、结肠组织LTB4水平较G2组显著降低(P<0.05),SOD、GSH-Px的活性较G2组显著升高(P<0.05)。而G4组与G3组上述各指标相比,差异均无统计学意义(P>0.05,见表1)。

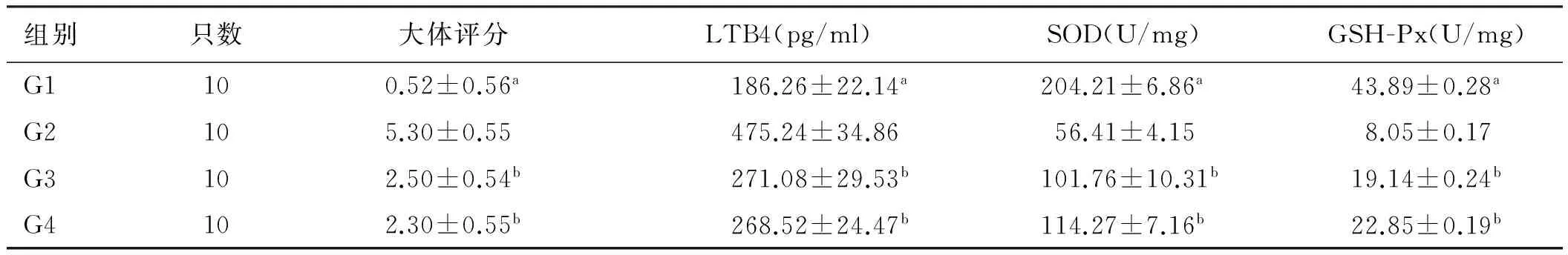
组别只数大体评分LTB4(pg/ml)SOD(U/mg)GSH-Px(U/mg)G1100.52±0.56a186.26±22.14a204.21±6.86a43.89±0.28aG2105.30±0.55475.24±34.8656.41±4.158.05±0.17G3102.50±0.54b271.08±29.53b101.76±10.31b19.14±0.24bG4102.30±0.55b268.52±24.47b114.27±7.16b22.85±0.19b
注:与G2组比较,aP<0.01,bP<0.05。
2.3 结肠组织COX-2、5-LOX表达 在G1组的肠黏膜中,COX-2、5-LOX表达量极低;G2组的肠黏膜中可见大量胞质染黄色或棕黄色的炎性细胞。G2组大鼠结肠组织COX-2、5-LOX表达水平较G3、G4组明显增高(P<0.05);G1组与其他三组比较,差异有统计学意义(P<0.05,见表2、图1)。
2.4 血清TNF-α、IL-10水平 G2、G3、G4组的血清TNF-α、IL-10水平明显高于G1组(P<0.05);G3、G4组的血清TNF-α、IL-10水平明显低于G2组(P<0.05);G3组与G4组相比,差异无统计学意义(P>0.05,见表2)。
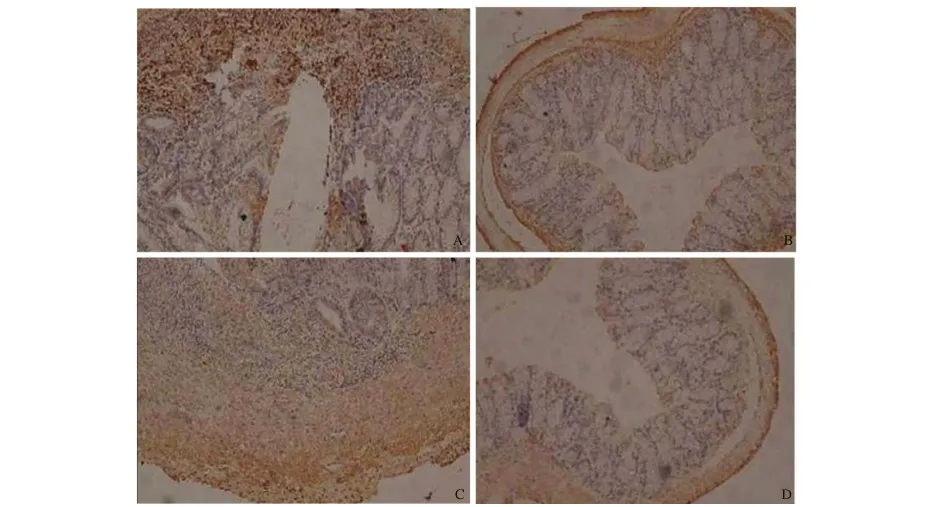
图1 免疫组化染色(400×) A:G2组结肠组织COX-2明显表达;B:G3组结肠组织COX-2的表达明显减少;C:G2组结肠组织5-LOX明显表达; D:G3组结肠组织5-LOX的表达明显减少
Fig 1 Immunohistochemistry staining (400×) A: COX-2 was significantly expressed in group G2; B: the expression of COX-2 was significantly decreased in group G3; C: 5-LOX was significantly expressed in group G2; D: the expression of 5-LOX was significantly decreased in group G3
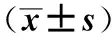

组别只数TNF-α(pg/ml)IL-10(pg/ml)COX-2阳性积分5-LOX阳性积分G11034.2±2.8 25.1±2.60.25±0.180.22±0.16G21097.4±13.7a76.7±9.2a3.37±0.24a3.17±0.28aG31075.5±12.4ab55.8±14.4ab1.68±0.92ab1.05±0.29abG41074.2±11.6ab46.3±7.8ab1.55±0.21ab0.96±0.15ab
注:与G1组比较,aP<0.05;与G2组比较,bP<0.05。
3 讨论
本实验发现,应用瑞巴派特治疗后,实验性结肠炎大鼠临床症状有所改善,且其大体损伤评分明显降低,提示瑞巴派特对实验性结肠炎有一定的治疗作用,对肠黏膜损伤具有保护作用。Okayama等[5]用葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导大鼠严重的结肠损伤,然后用瑞巴派特灌肠,发现由DSS诱导的损伤得到改善,结肠的黏液含量明显提高,表明瑞巴派特对DSS诱导的大鼠结肠炎有效,其保护作用在于自由基的清除和促结肠黏液分泌。Miyata等[7]用瑞巴派特对1例抗生素及糖皮质激素耐药的重度隐窝炎患者进行2次/d的灌肠治疗(150 mg/次),共8周,溃疡愈合,随访11个月无复发,未见不良反应。
氧自由基(oxygen free radicals,OFR)在UC发病机制中有重要作用。McKenzie等[8]发现UC患者活动期肠黏膜中有大量OFR产生,直接或间接损伤肠黏膜上皮细胞。UC患者肠黏膜中抗氧化物质含量降低,上皮细胞对氧化损伤反应增强,增加肠黏膜的通透性[9]。UC患者口服卵磷脂超氧化物歧化酶(PC-SOD)可明显改善疾病活动指数,抗氧化剂治疗可减轻结肠炎动物模型肠道病理损伤,抑制或减少OFR有助于减轻炎性反应,保护上皮细胞,改善肠黏膜通透性[10-11]。本研究发现,模型组大鼠肠道氧化损伤明显,表现为SOD和GSH-Px活性明显降低,瑞巴派特可显著上调SOD和GSH-Px活性,提示瑞巴派特具有明显抗氧化作用。
细胞因子在肠道免疫反应中起关键作用,致炎因子与抗炎因子之间的失衡均可导致炎症性肠病的发生。研究[12]发现,UC患者血清及肠黏膜中TNF-α表达水平升高,提示TNF-α对UC发病有促进作用。本实验发现经瑞巴派特治疗后,结肠炎大鼠血清TNF-α水平明显下降。Mitsuyama等[13]研究显示,活动性UC患者血清中IL-10含量与正常对照组比较明显升高,并在恢复早期仍然升高,直到炎症缓解后下降至正常水平。本研究结果与其类似,经瑞巴派特、奥沙拉嗪治疗后,随着病情的缓解,IL-10呈不同程度的回落。
COX-2与5-LOX分别是花生四烯酸(arachidonic acid,AA)代谢的两条主要途径的关键酶。COX-2与UC的炎症过程密切相关。5-LOX可以催化AA生成LTB4。LTB4作用在炎性细胞的LTB4受体上,主要介导炎性细胞向炎症部位趋化,对中性粒细胞、单核细胞和效应性T细胞具有极强的趋化作用,被认为是UC中主要起作用的炎性介质[14]。Mazzon等[15]敲除结肠炎模型小鼠的5-LOX基因,其炎症程度明显减轻。本研究显示,经瑞巴派特和奥沙拉嗪治疗后LTB4均明显降低,大鼠肠组织局部COX-2及5-LOX表达量显著降低,推测瑞巴派特和奥沙拉嗪可能通过抑制肠组织局部COX-2及5-LOX表达,从而减轻肠组织局部黏膜损伤。
综上所述,瑞巴派特治疗实验性结肠炎大鼠有一定效果,其潜在的可能作用机制是上调结肠组织中SOD及GSH-Px的活性、调节细胞因子水平、减少局部COX-2及5-LOX蛋白表达,从而减轻局部炎性反应强度而缓解炎症,但具体的作用机制仍需进一步的研究证实。
[1]霍丽娟, 安丽婷, 师永盛. 美沙拉嗪联合双歧三联活菌治疗溃疡性结肠炎的临床疗效观察[J]. 中华消化杂志, 2012, 32(8): 523-527.
Huo LJ, An LT, Shi YS. The clinical efficacy of mesalazine and bifid-triple viable combination therapy in patients with ulcerative colitis [J]. Chin J Dig, 2012, 32(8): 523-527.
[2]李颉, 诸琦, 曹海霞, 等. 瑞巴派特对提高胃溃疡愈合质量的实验研究[J]. 中华消化杂志, 2008, 28(7): 451-455.
Li J, Zhu Q, Cao HX, et al. Effect of Rebamipide on the quality of gastric ulcer healing in rats [J]. Chin J Dig, 2008, 28(7): 451-455.
[3]朱晚林, 叶秀津, 王章流, 等. 瑞巴派特保留灌肠治疗溃疡性结肠炎疗效[J]. 中国药师, 2009, 12(9): 1289-1290.
Zhu WL, Ye XJ, Wang ZL, et al. Therapeutic effect of Rebamipide enema retention therapy on ulcerative colitis [J]. China Pharmacist, 2009, 12(9): 1289-1290.
[4]Siddiqui A, Ancha H, Tedesco D, et al. Antioxidant therapy with N-acetylcysteine plus mesalamine accelerates mucosal healing in a rodent model of colitis [J]. Dig Dis Sci, 2006, 51(4): 698-705.
[5]Okayama M, Tsubouchi R, Nishio H. Protective effect of intra-rectal administration of rebamipide on dextran sulfate sodium-induced rat colitis [J]. Digestion, 2004, 70(4): 240-249.
[6]唐平飞, 李瑾, 贺文成, 等. 吉法酯对三硝基苯磺酸诱导大鼠实验性结肠炎的作用[J].中华消化杂志, 2009, 29(9): 554-558.
Tang PF, Li J, He WC, et al. The effects of Gefarnate in treatment of rat model of colitis induced by trinitrobenzene sulphonic acid [J]. Chin J Dig, 2009, 29(9): 554-558. [7]Miyata M, Konagaya T, Kakumu S, et al. Successful treatment of severe pouchitis with rebamipide refractory to antibiotics and cortiecosteroids: a case report [J]. World J Gastroenterol, 2006, 12(4): 656-658.
[8]McKenzie SJ, Baker MS, Buffinton GD, et al. Evidence of oxidant-induced injury to epithelial cells during inflammatory bowel disease [J]. J Clin Invest, 1996, 98(1): 136-141.
[9]Buffinton GD, Doe WF. Depleted mucosal antioxidant defences in inflammatory bowel disease [J]. Free Radic Biol Med, 1995, 19(6): 911-918.
[10]Suzuki Y, Matsumoto T, Okamoto S, et al. A lecithinized superoxide dismutase (PC-SOD) improves ulcerative colitis [J]. Colorectal Dis, 2008, 10(9): 931-934. [11]Giris M, Depboylu B, Do ru-Abbaso lu S, et al. Effect of taurine on oxidative stress and apoptosis-related protein expression in trinitrobenzene sulphonic acid-induced colitis [J]. Clin Exp Immunol, 2008, 152(1): 102-110.
[12]Tian L, Huang YX, Tian M, et al. Downregulation of electroacupuncture at ST36 on TNF-alpha in rats with ulcerative colitis [J]. World J Gastroenterol, 2003, 9(5): 1028-1033.
[13]Mitsuyama K, Tomiyasu N, Takaki K, et al. Interleukin-10 in the pathophysiology of inflammatory bowel disease:increased serum concentrations during the recovery phase [J]. Mediators Inflamm, 2006, (6): 26875.
[14]Hendel J, Nielsen OH. Expression of cyclooxygenase-2 mRNA in active inflammatory bowel disease [J]. Am J Gastroenterol, 1997, 92(7): 1170-1173.
[15]Mazzon E, Sautebin L, Caputi AP, et al. 5-lipoxygenase modulates the alteration of paracellular barrier function in mice ileum during experimental colitis [J]. Shock, 2006, 25(4): 377-383.
(责任编辑:李 健)
Protective effects of Rebamipide on colonic mucosa of experimental colitis in rats
XU Jin1, YANG Jie2, WANG Bin1, CHEN Jun1, LIU Ying1, LIU Hanhan3
1.Department of Gastroenterology; 2. Physical Examination Center; 3. Department of Pathology, Renmin Hospital, Hubei University of Medicine, Shiyan 442000, China
Objective To investigate the protective effects and mechanism of Rebamipide in 2,4,6-trinitrobenzene sulfonic acid (TNBS) induced colitis rats.Methods Forty female adult Sprague-Dawley (SD) rats were randomly divided into 4 groups: normal control group (G1), TNBS-induced colitis model group (G2), TNBS-induced colitis treated with Rebamipide group (G3) and TNBS-induced colitis treated with Olsalazine group (G4). Each group
its respective treatment. At the end of the experiment, colon tissue was collected for assessment of colonic mucosa damage score. LTB4 content, SOD and GSH-Px activity were detected. Expressions of COX-2 and 5-LOX in tissues were detected by immunohistochemistry. The serum levels of TNF-α and IL-10 were measured by ELISA. Results After treatment, compared with group G2, colonic mucosa damage score, LTB4 level, serum TNF-α and IL-10 were significantly decreased in group G3 and group G4, while SOD and GSH-Px activity were significantly increased (P<0.05). The expressions of COX-2 and 5-LOX were significantly lower in group G1, G3, G4 than those in group G2 (P<0.05).Compared with group G3 and G4, the levels of COX-2 and 5-LOX were significantly decreased in group G1 (P<0.05).Conclusion The effects of Rebamipide in treatment of TNBS-induced colitis may be related to the mechanisms of up-regulating SOD and GSH-Px activity, regulating cytokine, and reducing the expressions of COX-2 and 5-LOX.
Ulcerative colitis; Rebamipide; Cyclooxygenase-2; 5-Lipoxygenase
10.3969/j.issn.1006-5709.2016.07.008
徐进,硕士,主治医师,研究方向:炎症性肠病的基础与临床。E-mail:xujin200725@126.com
杨洁,硕士,副主任医师,研究方向:胃肠道疾病的基础与临床。E-mail:syrmyjfbk@163.com
R574.62
A
1006-5709(2016)07-0745-04
2015-09-14

