澳洲茄边碱对前列腺癌细胞增殖的抑制作用及机制研究
张秋红 李静 周建甫 向松涛
·实验研究·
澳洲茄边碱对前列腺癌细胞增殖的抑制作用及机制研究
张秋红李静周建甫向松涛
510405 广州中医药大学第二临床医学院(张秋红);广东省中医院泌尿外科(李静、周建甫、向松涛)
【摘要】目的研究澳洲茄边碱(solamargine, SM)对人前列腺癌激素非依赖细胞增殖的影响及可能的作用机制。 方法用不同浓度SM(0、1、2、4、6、8、10 μmol/L)处理DU145和PC3细胞,MTT法检测SM对细胞生长的影响,Western blot检测SM对相关信号通路蛋白p38 MAPK、ERK1/2 MAPK、MUC1表达的影响。 结果6 μmol/L SM作用24 h后DU145和PC3细胞活力分别为(52.53±9.05)%、(56.28±2.36)%,并具有时间和剂量依赖;10 μmol/L SM作用24 h后细胞活力分别为(27.36±2.72)%、(32.07±2.53)%。流式细胞术分析显示不同浓度SM(0、4、6、8 μmol/L)处理PC3细胞能引起PC3细胞阻滞在G1期,G1期细胞比例分别为(52.61±0.50)%、(52.96±1.49)%、(66.16±2.84)%和(69.03±2.38)%。且能激活MAPK信号通路减少下游蛋白MUC1的表达。 结论SM能明显抑制DU145和PC3细胞生长,该作用可能与MAPK信号通路的激活以及下游MUC1蛋白表达下调有关。
【关键词】前列腺癌;细胞增殖;MAPK;MUC1;澳洲茄边碱
澳洲茄边碱(solamargine, SM)是从中药龙葵中提取的天然甾体生物碱糖苷化合物和细胞毒性剂,能引起肿瘤细胞的凋亡或与其他化学药物起到协同作用,增强治疗效果[1]。研究证明SM能抑制肺癌细胞生长并引起肺癌细胞凋亡[2],但有关SM抗前列腺癌特别是激素非依赖性前列腺癌的报道很少。本研究将SM作用于激素非依赖前列腺癌细胞,研究其对前列腺癌细胞生长的影响并探讨其可能的作用机制。
材料与方法
一、材料
1.细胞株:人前列腺癌细胞株DU145、PC3,由中山大学孙逸仙纪念医院林百欣医学研究中心实验室提供。
2.试剂:SM购自成都曼彻斯特公司;DMEM高糖培养液、胰酶及胎牛血清购自美国Gibco公司;MTT购自广州威佳科技有限公司。一抗MUC1、p-p38、p38、p-ERK1/2、GAPDH购自Abcam公司,兔抗二抗购自Cell Signal Technology公司。
二、方法
1.细胞培养:DU145和PC3细胞使用含有10%胎牛血清的DMEM高糖培养液,在含5% CO2、37℃恒温培养箱中培养,取对数生长期细胞待用。
2.MTT细胞活力测定:取对数生长期的DU145和PC3细胞,制成细胞悬液接种于96孔板,细胞密度为5×103个/孔,待细胞贴壁加入不同浓度SM(0、1、2、4、6、8、10 μmol/L),每个浓度设4个平行复孔,继续培养24、48、72 h,向每孔加入10 μl MTT溶液继续培养4 h,测定570 nm处吸光度(A)值。细胞活力(%)=(加药组A值/空白组A值)×100%。
3.流式细胞术检测细胞周期:取对数生长期PC3细胞以3×105个/孔的密度接种于6孔板,贴壁后加入不同浓度的SM,24 h后收集细胞,按细胞周期检测试剂盒说明操作上机。
4.Western blot分析:细胞以3×105个/孔的密度接种于6孔板,贴壁后加入不同浓度的SM,24 h后每孔加入40 μl裂解液,提取蛋白,BCA法测定蛋白浓度,等量蛋白上样,12%聚丙烯酰胺凝胶电泳。电泳结束后半干转1 h,5%脱脂牛奶封闭1 h,加入一抗孵育过夜。TBST洗膜3次,加入二抗孵育1 h,TBST洗膜3次,ECL化学发光法显影。
三、统计学方法
所有实验数据均采用均数±标准差表示,采用SPSS 18.0统计软件分析,多组均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结果
一、SM对DU145和PC3细胞生长的影响
加药之后细胞活力明显下降并呈时间和剂量依赖(图1,表1、2)。说明SM对DU145和PC3细胞的生长具有抑制作用。

图1不同浓度SM对DU14和PC3细胞生长的影响(细胞活力的计算:将未加药组作为空白对照,加药组A
值依次与其相比,得出细胞活力曲线,且对照组与自身相比比值为1)
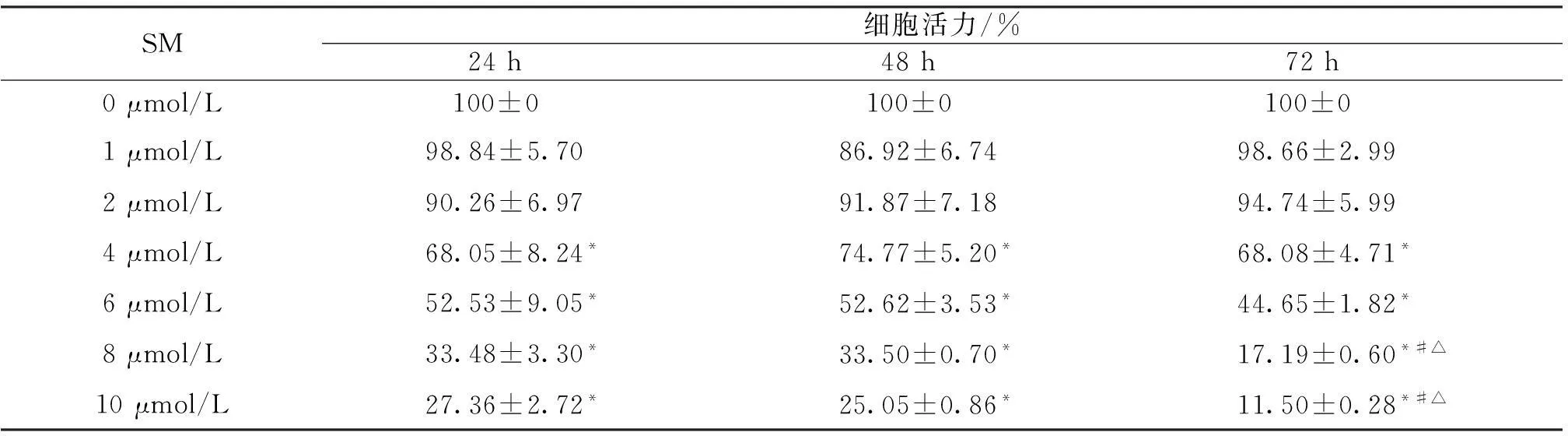
表1 SM对DU145细胞活力的影响
与未加药组相比*P<0.05;与24 h相比#P<0.05;与48 h相比△P<0.05

表2 SM对PC3细胞活力的影响
与未加药组相比*P<0.05;与24 h相比#P<0.05;与48h相比△P<0.05
二、SM对PC3细胞周期的影响
MTT实验可以看出1 μmol/L和2 μmol/L对PC3细胞的生长几乎没有任何抑制作用,且IC50约为7.0 μmol/L,因此细胞周期的检测中并未设立1 μmol/L和2 μmol/L组。不同浓度SM(0、4、6、8 μmol/L)处理PC3细胞24 h,流式细胞术分析结果显示,与空白对照组相比,药物处理组PC3细胞发生G0/G1期阻滞(图2)。4、6、8 μmol/L SM组G0/G1期细胞比例与对照组[(52.61±0.50)%]相比,分别上升至(52.96±1.49)%、(66.16±2.84)%和(69.03±2.38)%,6、8 μmol/L SM组与对照组相比差异有统计学意义(P<0.05)。

A:对照组各时期的细胞百分比,G0/G1 (52.61±0.50)%、S (32.92±0.82)%、G2/M (14.48±1.25)%;B:4 μmol/L处理细胞24 h后G0/G1为 (52.96±1.49)%、S (32.12±1.62)%、G2/M (14.92±0.48)%;C:6 μmol/L处理细胞24 h后G0/G1为 (66.16±2.84)%*、S (17.99±1.44)%*、G2/M (15.85±1.49)%;D:8 μmol/L处理细胞24 h后G0/G1为 (69.03±2.38)%*、S (14.97±1.38)%*、G2/M (16.00±2.37)%;E:将上述数据整理后画出柱状图(与对照组相比*P<0.05)
图2SM引起PC3细胞周期阻滞,并呈剂量依赖[使用Multicycle AV DNA 分析软件统计细胞周期每个阶段
(G0/G1、S、G2/M)的细胞比例]
三、SM对MAPK信号通路相关蛋白表达的影响
SM(6 μmol/L)处理DU145和PC3细胞,Western blot检测不同时间点(0、0.5、2、4、8、24 h)p-p38 MAPK、p-ERK MAPK等蛋白的表达。SM可以增加p-p38 MAPK的磷酸化水平,其中DU145细胞4 h、8 h与0 h相比差异具有统计学意义(P<0.05),PC3细胞0.5 h、2 h、4 h与0 h相比差异具有统计学意义,且可降低p-ERK MAPK的磷酸化水平(图3A)。不同浓度SM(0、1、2、4、6、8 μmol/L)处理DU145与PC3细胞24 h,Western blot检测MUC1的表达,SM引起MUC1表达下调,其中6 μmol/L、8 μmol/L与0 μmol/L相比,差异具有统计学意义(P<0.05)(图3B)。

A:SM能增加p38的磷酸化水平,伴随p-ERK MAPK的下调;B:SM引起MUC1表达下调(与未处理对照组相比*P<0.05)
图3SM对p-p38 MAPK、p-ERK MAPK和MUC1蛋白表达的影响
讨论
内分泌治疗为晚期前列腺癌患者赢得了一定的生存期,但前列腺癌由激素依赖向激素非依赖的转化仍然是临床面临的难题和威胁患者生命的罪魁祸首[3],其转变机制目前尚不明确。由于现存治疗方法的局限性,许多患者死于肿瘤复发和转移,因此探索新的辅助药物,揭示其作用机制和寻找其细胞内作用的分子靶点是国内外研究的热点之一。中药龙葵近年来由于其抗癌活性而日益成为研究的热点[4],澳洲茄碱、SM是其主要活性成分。其中SM是一种天然甾体生物碱糖苷化合物和细胞毒性剂,能引起肿瘤细胞的凋亡或与其他化学药物起到协同作用,增强治疗效果。有研究认为SM能够调节Fas和HER2蛋白表达并增加肺癌细胞对表柔比星和赫赛汀的敏感性[5];在白血病细胞中能激活溶酶体-线粒体途径的细胞死亡通路[6]。但SM对于激素非依赖前列腺癌的作用未见报道。
本研究中,我们证实了SM对DU145和PC3细胞的生长有明显的抑制作用,且呈现时间和剂量依赖性,并通过上调p-p38 MAPK和下调p-ERK MAPK而激活MAPK信号通路。MAPK是一组能被不同的细胞内外刺激激活的丝氨酸-苏氨酸蛋白激酶,其中ERK广泛存在于各种组织,主要参与调控细胞的增殖分化,JNK家族是细胞对各种应激原诱导的信号转导的关键分子,主要参与应激反应,p38介导炎症、凋亡等[7]。有研究证明SM可以通过上调p38 MAPK磷酸化水平引起肺癌细胞周期阻滞[2],与我们研究结果一致。因此我们认为在激素非依赖前列腺癌细胞中p38 MAPK主要介导肿瘤细胞的生长抑制作用,ERK主要介导了肿瘤细胞的生长和分化。但也有研究认为ERK在有些情况下也是肿瘤的抑制基因,介导肿瘤细胞的衰老和凋亡[8],提示了MAPK信号通路在不同的组织和环境中可能有着不同的功能,有待于更加细致和深入的研究进行阐明。
为了进一步阐明SM抑制激素非依赖前列腺癌细胞的生长机制,我们对SM对蛋白MUC1表达的影响进行了研究。MUC1 是单通道Ⅰ型跨膜蛋白,在肿瘤细胞中异常糖基化的MUC1常呈过表达的趋势,因此被作为一种致瘤因子受到广泛的关注。在对前列腺癌的研究中发现激素非依赖前列腺癌细胞DU145 和PC3细胞相对于正常的前列腺上皮细胞PrEC MUC1表达明显增多,而激素依赖前列腺癌细胞LNCaP MUC1表达缺失[9]。我们前期研究发现使用siRNA技术沉默MUC1基因后,PC3细胞的增值能力受到影响[10],且姜黄素可以通过下调MUC1而逆转比卡鲁胺的耐药[11],我们此次的研究结果表明SM可以抑制细胞生长并下调MUC1的表达,实验结果具有统一性。我们认为可以将MUC1作为激素非依赖前列腺癌的一个分子标志物,并以此为靶点开发新型药物,为前列腺癌激素非依赖患者提供新的治疗希望。
综上所述,我们认为SM能通过激活MAPK信号通路调节下游MUC1的表达从而抑制激素非依赖前列腺癌细胞的增殖,但有待于进一步的实验验证。
参考文献
[1]Liang CH, Shiu LY, Chang LC, et al. Solamargine upregulation of Fas, downregulation of HER2, and enhancement of cytotoxicity using epirubicin in NSCLC cells[J]. Mol Nutr Food Res,2007,51(8):999-1005.
[2]Zhou Y, Tang Q, Zhao S, et al. Targeting signal transducer and activator of transcription 3 contributes to the solamargine-inhibited growth and -induced apoptosis of human lung cancer cells[J]. Tumour Biol,2014,35(8):8169-8178.
[3]Bashir MN. Epidemiology of Prostate Cancer[J]. Asian Pac J Cancer Prev,2015,16(13):5137-5141.
[4]Liu LF, Liang CH, Shiu LY, et al. Action of solamargine on human lung cancer cells--enhancement of the susceptibility of cancer cells to TNFs[J]. FEBS Lett,2004,577(1-2):67-74.
[5]Liang CH, Shiu LY, Chang LC, et al. Solamargine enhances HER2 expression and increases the susceptibility of human lung cancer H661 and H69 cells to trastuzumab and epirubicin[J]. Chem Res Toxicol,2008,21(2):393-399.
[6]Sun L, Zhao Y, Li X, et al. A lysosomal-mitochondrial death pathway is induced by solamargine in human K562 leukemia cells[J]. Toxicol In Vitro,2010,24(6):1504-1511.
[7]Qi M, Elion EA. MAP kinase pathways[J]. J Cell Sci,2005,118(Pt 16):3569-3572.
[8]Deschênes-Simard X, Kottakis F, Meloche S, et al. ERKs in cancer: friends or foes?[J]. Cancer Res,2014,74(2):412-419.
[9]O'Connor JC, Julian J, Lim SD, et al. MUC1 expression in human prostate cancer cell lines and primary tumors[J]. Prostate Cancer Prostatic Dis,2005,8(1):36-44.
[10]李静,周建甫,张秋红,等. RNA干扰沉默MUC1-C对前列腺癌PC3细胞增殖的影响[J]. 现代泌尿生殖肿瘤杂志,2014,6(6):356-358.
[11]Li J, Xiang S, Zhang Q, et al. Combination of curcumin and bicalutamide enhanced the growth inhibition of androgen-independent prostate cancer cells through SAPK/JNK and MEK/ERK1/2-mediated targeting NF-kappaB/p65 and MUC1-C[J]. J Exp Clin Cancer Res,2015,34:46.
(本文编辑:熊钰芬)
通信作者:向松涛,E-mail:tonyxst@163.com
doi:10.3870/j.issn.1674-4624.2016.01.010
(收稿日期:2015-11-12)
Effect and mechanism of solamargine on proliferation of prostate cancer cells
ZHANGQiu-hong*,LIJing,ZHOUJian-fu,XIANGSong-tao.
*SecondClinicalMedicalCollegeofGuangzhouUniversityofChineseMedicine,Guangzhou510405,ChinaCorrespondingauthor:XIANGSong-tao,E-mail:tonyxst@163.com
【Abstract】ObjectiveTo investigate the effect of solamargine (SM) on the proliferation of prostate cancer cells and the possible mechanism. MethodsDU145 and PC3 cells were treated with different concentration of SM (0, 1, 2, 4, 6, 8, 10 μmol/L). MTT assay were used to detect the inhibiting effect of SM on the proliferation of DU145 and PC3. Expression of p38 MAPK, ERK1/2 MAPK, MUC1 protein were detected by Western blot. Cell cycle was detected by flow cytometry. ResultsThe cell viability of DU145 and PC3 cells after treated with 6 μmol/L SM for 24 h were (52.53±9.05)% and (56.28±2.36)%. With time and dose dependent, when treated with 10 μmol/L SM for 24 h were (27.36±2.72)%, (32.07±2.53)%. SM (0, 4, 6, 8 μmol/L) can induce cell cycle arrest at G0/G1 phase of PC3 and activate MAPK signal pathway which can reduce the downstream protein MUC1 expression. The cell rate of G1 were (52.61±0.50)%, (52.96±1.49)%, (66.16±2.84)% and (69.03±2.38)%, respectively.ConclusionsSM can inhibit the growth of DU145 and PC3. The mechanism may be related to the activation of MAPK signal pathway and cut on the downstream MUC1 protein expression.
【Key words】Prostate cancer;Cell proliferation;MAPK;MUC1;Solamargine

