酸浆种子诱导分化试验*
王 丹 舒 钰
(黑龙江省林业科学研究所,哈尔滨 150081)
酸浆种子诱导分化试验*
王丹舒钰
(黑龙江省林业科学研究所,哈尔滨150081)
摘要:采用MS基本培养基,添加不同种类和不同浓度的植物激素,通过变温冷冻处理种子,将无污染的酸浆种子进行组织培养试验,诱导发芽及分化,从而筛选酸浆种子诱导分化较适合的培养基。
关键词:酸浆;种子;分化
*黑龙江省森林工业总局科技计划资助项目(sgzjQ2014001)
酸浆(Physali alkekengi var.franchetii)别名红姑娘,为茄科酸浆属变种植物,1年或多年生草本[1-2]。果实成熟时呈橙红色,可直接采摘做干花,也可生食,味微酸,浆果外包围有膨大宿萼,果实富含维生素及钙、镁、硼、锌、硒、锗等多种对人体有益的营养元素[3-5]。近年来,酸浆市场需求量正逐步攀升,在食品、医药产业中前景可观,具有巨大的潜在开发价值。酸浆野生资源良莠不齐、染病率较高,而对酸浆无性繁育技术方面的研究不仅可以降低染菌率、提高产量、保持其优良性状,而且可为工厂化育苗及大规模生产打下基础。本试验通过对酸浆种子进行变温处理,同时促其萌发形成子叶,再通过子叶诱导分化形成分化芽,可在较短的时间内获得大量商品苗,并开辟了一条无性繁殖的新路径。
1试验材料和方法
1.1不同处理对种子萌发的影响
1.1.1变温处理对种子萌发率的影响
酸浆种子种皮较硬,不易萌发,因此在进行组织培养或播种繁殖时均需对种子进行处理,通过变温处理及浸泡烫种处理筛选出适宜种子萌发的方法,提高组织培养及大田播种中种子的萌发率。
试验选取当年无污染成熟的种子,将10月中旬下霜之后的果实放置-15℃冰箱内冷冻24h,取出后置室温(20℃)解冻,如此反复3次;再剥去果皮果肉,用去污粉搓洗种子,尽量搓去种皮表面的果肉及粘液,然后用流水冲洗多次;将不完整及干瘪的种子剔除。试验以不经冷冻处理的种子做对照。
1.1.2不同浸泡处理对种子萌发率的影响
先用60℃开水烫种,直至水温冷却,洗净其种皮外的粘液,将洗好的种子放入无菌水或0.1mg/L赤霉素中浸泡24~72h(表1),将其种皮软化,软化后将种子用潮湿的纱布包好放入培养皿中,25℃恒温箱内保存,每隔24h用20℃左右温水冲洗1次,直至萌发为止。期间每隔10h换1次水,促其萌发。
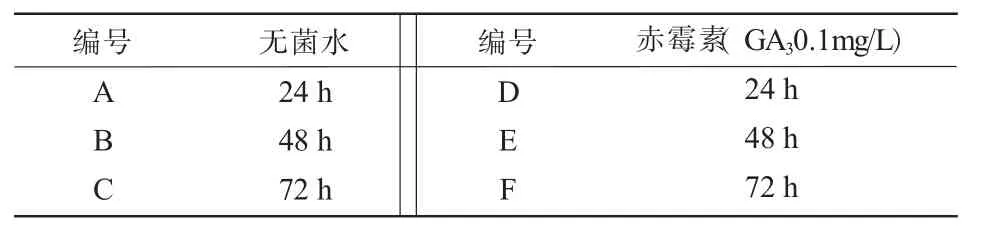
表1 种子浸泡时间
1.2培养基的筛选
将变温处理好的种子用漂白粉洗净后放入超净台上,倒入适量75%酒精消毒8s,立即放入无菌水中冲洗,然后放入1%升汞溶液中灭菌8 min,无菌水冲洗4~5遍,无菌滤纸吸干,备用。
1.2.1诱导种子发芽培养基的筛选
将备好的种子放入诱导种子发芽培养基(MS+蔗糖30g/L+琼脂7g/L)中,并加入不同的激素(表2)进行暗培养,每瓶10~15粒,待种脐露白后转入光下培养。
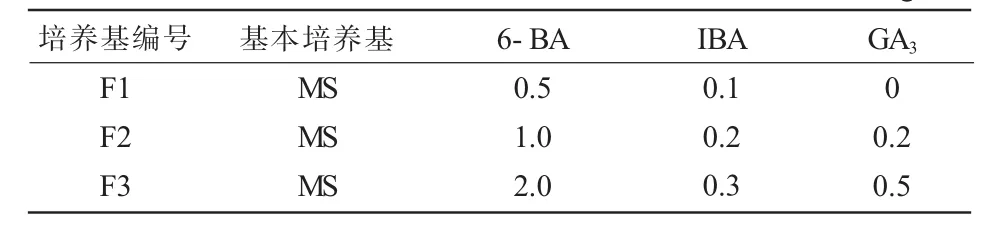
表2 诱导种子发芽培养基 mg/L
1.2.2诱导子叶再分化培养基的筛选
暗培养7天后种脐露白转入光照培养,光源采用日光灯,培养室内白天温度为24~28℃,照明时间12~14h,光照强度1 500~1 800 lx,湿度50%~60%。当子叶长成1cm高时剪下切成0.5cm×0.5cm的小块,接种于培养基J1~J4上进行光照培养(表3),蔗糖30g/L,琼脂7g/L。
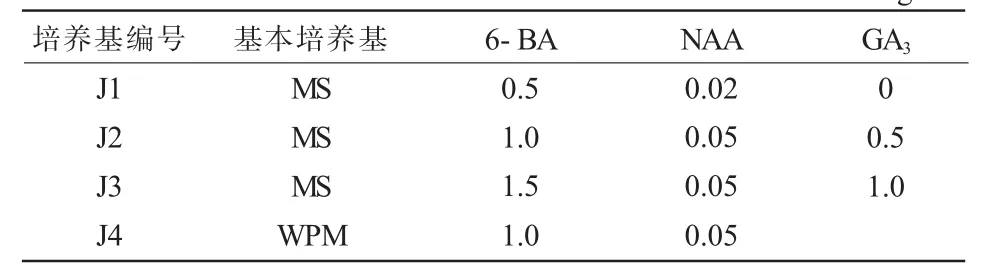
表3 诱导不定芽培养基 mg/L
1.3生根培养
将不定芽切成2.0cm~3.0cm长的小段,接入生根培养基MS+NAA(0.5mg/L)上生根。
2试验结果和分析
2.1不同处理对种子萌发的影响
2.1.1变温处理对种子萌发的影响
将变温处理与未处理的种子暗培养7天,对酸浆种子露白数进行调查,发现经过变温处理的种子更易发芽(图1),这可能与酸浆种子休眠特性有关,通过变温处理打破种子休眠,从而促进种子快速萌发。
2.1.2浸泡烫种处理对种子萌发的影响
据报道,酸浆果实的汁液含有抑致种子发芽的物质,而通过开水烫种及洗种处理,洗去种皮外的粘性物质,将有利于种子发芽,因此,本试验采用变温处理的种子进行不同浸泡处理的诱导试验。随着无菌水与赤霉素浸泡时间的延长,发芽率也随之增大(表4、图2、图3),48h与24h差异较显著,48h与72h差异不明显,当浸泡72h时达到最高;同时用赤霉素浸泡种子的发芽率明显高于无菌水,在72h时达到最高78%。浸泡不仅可将种皮外抑制种子萌芽的物质去除,还可以使酸浆种子的种皮软化,破除种子的硬实特性,促进种子萌芽。但若超过72h,发芽率将明显降低。因此在大田播种前应对种子进行烫种处理,并用0.1mg/L的赤霉素浸泡48~72h,可显著提高种子的萌发率。
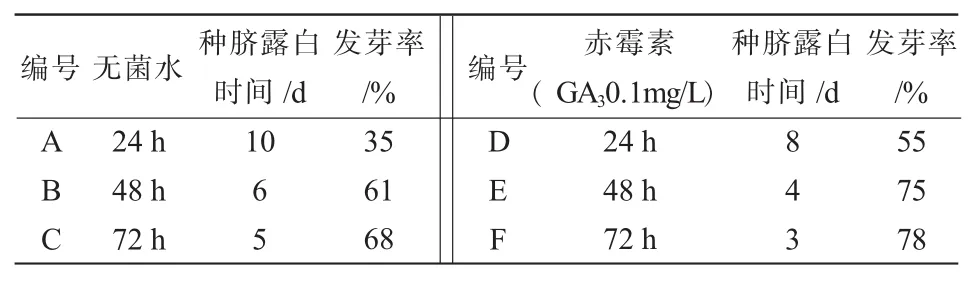
表4 不同浸泡处理对种子发芽率的影响

图1 变温处理对发芽率的影响
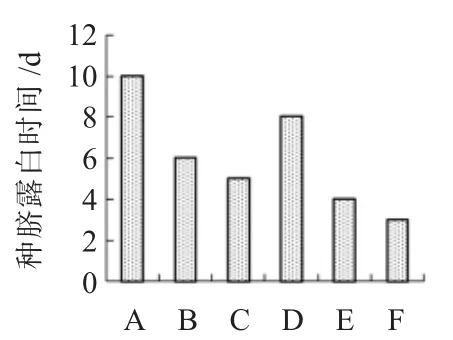
图2 不同浸泡处理的种脐露白时间
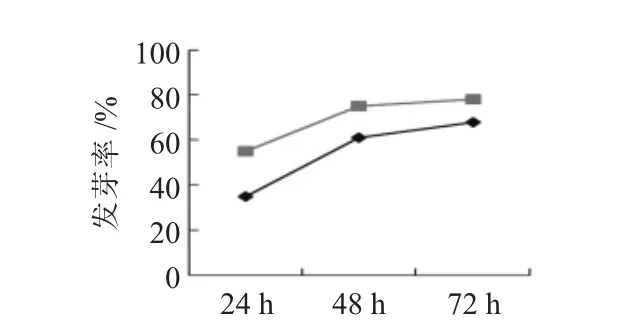
图3 不同浸泡处理的发芽率

2.2诱导分化培养基的筛选
2.2.1诱导种子发芽培养基的筛选
在暗培养处理7天后,F3培养基里的种子在种脐处裂开,长出胚结构,露出子叶、胚轴,子叶慢慢展开变大;F1培养基中未见分化迹象,F2培养基则在15天时出现分化,这可能与6-BA、GA3的用量有关,说明种子的分化需要有适当的生长调节物质,单纯使用6-BA并不能使种子发生分化,当加入一定量的GA3时,可促进种子的萌芽,因此F3培养基为最适种子萌发培养基。
2.2.2诱导子叶再分化培养基的筛选
光培养7天后,4种培养基上子叶均开始膨大弯曲,陆续产生愈伤组织及绿色的芽点,再过7天时愈伤组织分化可见3~5片叶芽,长势健壮,叶片翠绿;其中以培养基J3上产生的分化叶最多、分化率最高,达95%,且能形成大量健壮的不定芽,有利于快速繁殖。J1、J2、J4号培养基较次之,其中J4号培养基的分化苗长势较弱,呈玻璃化徒长现象(表5)。说明WPM培养基不适宜对酸浆进行分化及壮苗培养。

表5 不同培养基对子叶再分化的影响
2.3生根培养及移栽
将不定芽剪成2~3cm长,接入生根培养基MS+NAA(0.5mg/L)上,10天后生根率达到100%。再继续培养10天,待不定芽全部长出白色且粗壮的根系后,进行驯化移栽。首先在培养室将封口膜打开炼苗3天,然后取出,将植株根部洗净,移栽到营养钵中,覆膜保湿,大约1周后,发出新叶,去掉覆膜,移栽成活率达97%。
3结论
3.1最佳的取材时间为10月中旬下霜之后,在对种子进行组织培养诱导分化试验中,首先要通过-15℃及20℃室温的变温处理,反复3次,打破种子的休眠,从而提高种子的发芽率。
3.2大田播种需通过烫种浸泡处理,选择最适宜的浸泡溶液GA3(0.1mg/L),浸泡时间48~72h促进种子萌发。最适宜的诱导种子发芽培养基为F3,在启动时间、污染率和分化率等方面都优于F1、F2。最适宜的诱导子叶再分化的培养基为J3,在展叶时间、增殖叶数、分化率、长势等各方面都优于其他培养基。
参考文献
[1]中国科学院《中国植物志》编委会.中国植物志[M].北京:科学出版社,1980.
[2]栗东霞.冬春日光温室酸浆栽培技术[J].现代农业科技,2007(12):34-36.
[3]王洪成.酸浆优质丰产栽培模式及其利用价值的研究[J].黑龙江农业科学,2007(3):65-66.
[4]赵金凤,蔡龙,张旨安.酸浆栽培技术[J].现代化农业,2006(5):14.
[5]王家东,王荣荣.酸浆开发利用研究的进展[J].农技服务,2007,24(11):109-112.
(责任编辑:张亚楠)
Test of P.alkekengi var.franchetii Seeds Induced Differentiation
WANGDan
(Landscape Department of Heilongjiang Academy of Forestry Institute,Harbin Heilongjiang 150081)
AbstractUsing MS as basic culture medium,adding different kinds and different concentrations of plant hormones,the temperature of freezing treatment seeds,no pollution will be seeds for tissue culture experiment,induced germination and differentiation,and screening of seeds is more suitable for the differentiation inducing medium.
Key wordsP.alkekengi var.franchetii;Seed;Differentiation
中图分类号:S665.9,S602.2
文献标识码:A
文章编号:1001-9499(2016)03-0014-03
作者简介:第1王丹(1982-),女,硕士,助理研究员,主要从事园林育种研究。
收稿日期:2016-02-17

