溶液pH对Fe-Mn催化氧化甲基橙去除效果的影响研究
刘 蓓,张永丽,张 静,柯 武,周 鹏
(四川大学 建筑与环境学院,成都 610065)
溶液pH对Fe-Mn催化氧化甲基橙去除效果的影响研究
刘蓓,张永丽*,张静,柯武,周鹏
(四川大学 建筑与环境学院,成都 610065)
摘要:研究了Fe-Mn掺杂催化剂在溶液不同pH值条件下催化氧化及吸附对甲基橙降解情况的影响。结果表明,在碱性、中性和弱酸性条件下,催化氧化对甲基橙的去除效果比单独臭氧氧化有一定提高,但催化剂对甲基橙基本没有吸附作用;在强酸性条件下(pH=3),催化剂对甲基橙具有较好的吸附作用,同时催化氧化效果明显,在反应进行20 min时甲基橙的去除率能够达到88.15%,与臭氧单独氧化相比去除率提高了24%。反应中均伴随有Fe、Mn离子的溶出,但对催化氧化无明显的影响。
关键词:臭氧化;催化氧化;甲基橙;pH值
臭氧分子具有强氧化性,大量研究表明臭氧能够有效降解水中的有机物[1],但是臭氧对有机物的矿化度低,对难降解有机物的去除效果不好等也限制了臭氧氧化技术的发展[2]。目前很多与臭氧联用的高级氧化技术被提出,如O3/H2O2[3],O3/UV[4],O3/芬顿[5]等。但是这些方法对臭氧的激活效果严重依赖于体系的pH值,在应用中仍受限制。
非均相催化氧化技术在饮用水和污水处理中能够有效去除水中的有机物,该技术在国内外得到了较多的研究[6-7]。非均相催化氧化能够提高臭氧的利用效率,同时能够激活臭氧的链式反应从而增强臭氧对有机物的降解能力[8-10]。不论作为活性物还是支承物,金属氧化物是最重要而且研究最广泛的固体催化剂[11]。例如MnO2[12]、TiO2[13-14]、CeO2[15],无定形铝氧化物[16],铁氧化物[17]等都是常见的固体催化剂。
由于Mn和Fe的氧化物表现出来的催化氧化活性更为显著,有研究分别对Fe、Mn催化剂的催化氧化性能做了对比研究实验,发现通过Fe改性的铝土矿催化剂比通过Mn改性的铝土矿催化剂的活性强[17],也有研究提出Mn氧化物与Fe、Co、Ni、Cr、Cu、Ce等金属氧化物相比较具有更高的活性,能够有效促进臭氧分解[18-20]。本实验运用简单可行的共沉淀法将Fe、Mn离子进行掺杂,制成同时含有Fe和Mn两种氧化物的催化剂对水中的有机染料甲基橙进行降解。重点探讨了在不同pH值条件下Fe-Mn催化剂催化氧化和吸附对甲基橙的降解情况。同时考察了催化剂的离子溶出对催化氧化反应是否有影响。
1实验部分
1.1实验材料
硝酸铁,硝酸锰,磷酸,磷酸二氢钠,磷酸氢二钠,氢氧化钠,氨水,无水乙醇均为分析纯,由成都科龙化学试剂有限责任公司生产;甲基橙(纯度>98.5%),由国药生产;水为优普纯水仪制备的超纯水;臭氧由纯氧通过爱克臭氧发生器产生。
1.2实验方法
1.2.1催化剂的制备
将适量硝酸铁和硝酸锰溶于超纯水中,使溶液中Fe3+和Mn2+的浓度均为0.5 mol/L。将混合溶液置于机械搅拌仪中剧烈搅拌,逐滴加入氨水,使氨水与Fe、Mn充分、均匀反应。当氨水过量时即可停止滴加,继续用机械搅拌仪剧烈搅拌30 min,然后静置2 h。将悬浊液在50 ℃的水温下水浴并搅拌,使悬浊液中的氨气和水分蒸发,直至悬浊液pH为中性且失去流动性。取出样品加入一定量的乙醇,并超声分散30 min。得到的悬浊液在60 ℃下彻底烘干后用研钵研磨成细小颗粒,并在400 ℃的条件下煅烧2 h。
实验时使用的机械搅拌器为深圳国华仪器生产的大功率电动搅拌器,水浴锅为北京中兴伟业仪器有限公司生产的电子恒温水浴锅,煅烧用沈阳节能生成的箱式电阻炉。
1.2.2催化氧化实验
实验所用的反应器为底部带有取样口的平底烧瓶,并用磁力搅拌器进行搅拌。在反应器内加入300 mL纯水,一次性投加1.5 mg/L的臭氧,随后迅速在臭氧水中加入100 mg Fe-Mn催化剂、4.5 mg甲基橙和缓冲溶液,并定时取样,所取样品通过玻璃纤维滤膜过滤后迅速测定水中的甲基橙浓度。反应水温结合当时实验室温确定,将其控制在17 ℃,溶液pH为3、5、7、9时均用磷酸缓冲调节,pH为11时直接用NaOH溶液调节。
水中臭氧和甲基橙浓度均用紫外可见分光光度计测定,在254.7 nm的波长下测定臭氧浓度;在506 nm的波长下测定pH为3时甲基橙的浓度;在463 nm的波长下测定pH为5、7、9、11时甲基橙的浓度。水中溶解的Fe3+、Mn2+均采用PE公司生产型号为PinAAcle-900T的原子吸收仪进行测定。原子吸收仪采用高纯乙炔为燃烧剂,使用配套Fe灯和Mn灯产生光源。
2结果与讨论2.1在碱性条件下甲基橙的降解情况
溶液pH值为11和9时催化氧化对甲基橙的去除效果见图1和图2。由图1、图2可见,在碱性条件下,催化氧化均比臭氧单独氧化的去除效率有一定提高,但催化剂对甲基橙基本没有吸附效果。当pH=11、反应1 min时,臭氧单独氧化对甲基橙的去除率为20.05%,催化氧化对甲基橙的去除率为31.19%;反应20 min时,臭氧单独氧化对甲基橙的去除率为36.91%,催化氧化对甲基橙的去除率为45.87%。当pH=9、反应1 min时,臭氧单独氧化对甲基橙的去除率为18.33%,催化氧化对甲基橙的去除率为28.82%;反应20 min时,臭氧单独氧化对甲基橙的去除率为43.91%,催化氧化对甲基橙的去除率为52.51%。
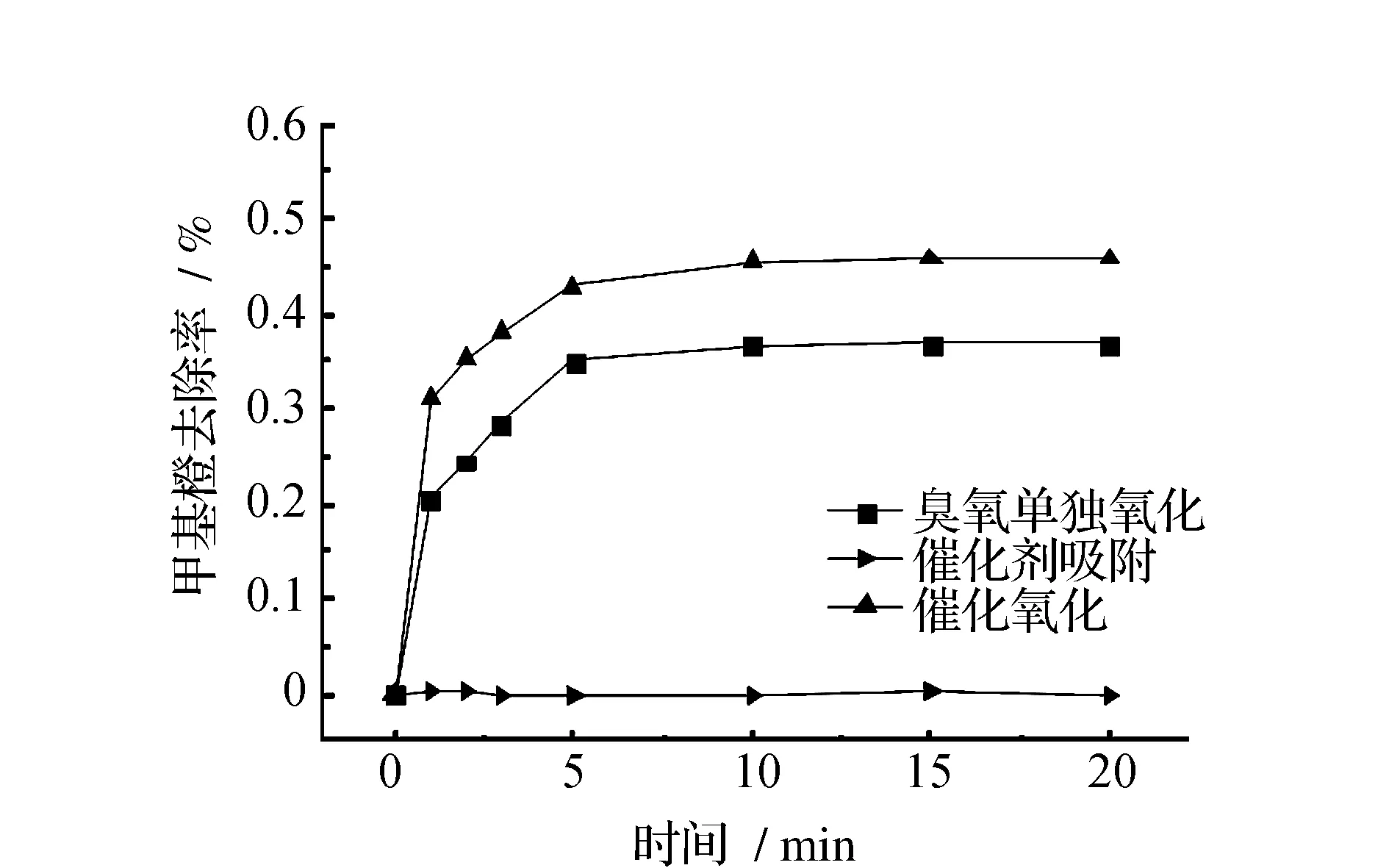
图1 pH=11时甲基橙降解曲线Fig.1 Methyl orange degradation when pH=11

图2 pH=9时甲基橙降解曲线Fig.2 Methyl orange degradation when pH=9
由此可见,在pH=11、9条件下催化氧化均对甲基橙的降解有一定促进作用,且均在反应1 min内促进作用明显,所以催化氧化的促进作用是在反应的初始阶段发生的。有研究表明催化氧化的活性来自于催化剂表面空隙的吸附作用,催化剂表面的空隙将目标物吸附不仅给臭氧氧化目标物提供了一个良好的反应场所,同时催化剂表面的羟基也能催化臭氧产生更强氧化性的自由基[15]。本实验在反应1 min内甲基橙去除效果得到明显提高,说明臭氧被催化剂表面的活性官能团激活的过程发生在反应的初始阶段。
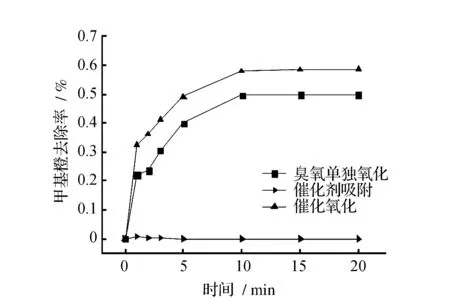
图3 pH=7时甲基橙降解曲线Fig.3 Methyl orange degradation when pH=7
2.2在中性条件下甲基橙的降解情况
在中性条件下催化剂对甲基橙基本没有吸附作用,催化氧化比单独臭氧氧化对甲基橙的去除也有一定提高。在反应1 min时,臭氧单独氧化对甲基橙的去除率为22.11%,催化氧化对甲基橙的去除率为32.43%。随着反应的进行,催化氧化对甲基橙的去除效果都比单独臭氧氧化高10%。可见在中性条件下甲基橙的降解情况与碱性条件基本一致,见图3。
2.3在酸性条件下甲基橙的降解情况
由图4可见,在pH=5时,反应的初始阶段催化剂对甲基橙有微小的吸附作用;催化氧化与臭氧单独氧化相比,对甲基橙的去除也有一定的提高。反应至20 min时催化氧化对甲基橙的去除率的提高与在碱性和中性条件下相似,但并非在反应1 min去除效果的提高最明显,而是在反应的前5 min逐渐增加的。该现象可能是因为在酸性条件下不利于催化剂对臭氧的激活,导致了在反应1 min时催化氧化未有明显促进甲基橙的降解。但是最终催化氧化对甲基橙的去除效果仍然能够达到与中性相近的效果。
在强酸性条件下(pH=3),催化剂对甲基橙具有明显的吸附作用,这与Fe-Mn催化剂表面的零电荷点(pHPZC)有关。pHPZC指在催化剂表面上存在的大量正电荷和负电荷达到了净电荷为零时的pH值。本实验采用电势滴定法[19]对Fe-Mn催化剂的零电荷点进行测定,测定结果为pHPZC=5.3。在溶液pH>5.3时,催化剂表面带负电荷;在溶液pH<5.3时,催化剂表面带正电荷。甲基橙是阴离子型偶氮染料,酸性条件下以醌式存在,碱性条件下以偶氮式存在[20]。不论溶液为酸性还是碱性,甲基橙在水溶液中均为阴离子,带负电荷。同时催化氧化对甲基橙的去除效果较臭氧单独氧化有一定提高。反应1 min时臭氧单独氧化对甲基橙的去除率为26.64%,催化氧化的去除率为34.29%;反应进行10 min后,臭氧单独氧化对甲基橙的去除已经未有明显的效果,但是催化氧化在反应的后10 min仍然对甲基橙有去除作用。最终在反应进行了20 min时,臭氧单独氧化对甲基橙的去除率为64.15%,催化氧化对甲基橙的去除率能够达到88.14%,去除效果提高了24%,见图5。

图4 pH=5时甲基橙降解曲线Fig.4 Methyl orange degradation when pH=5

图5 pH=3时甲基橙降解曲线Fig.5 Methyl orange degradation when pH=3
2.4不同pH条件下Fe、Mn离子的溶出

图6 Fe3+、Mn2+对臭氧降解甲基橙的影响Fig.6 Influence of Fe3+, Mn2+ to degradation of methyl orange
研究不同pH值条件下催化剂中Fe和Mn离子溶出情况的意义在于验证催化剂催化氧化的活性是否与催化剂溶出的Fe3+和Mn2+有关。在不同pH值下,催化剂浓度为333 mg/L,反应20 min时通过原子吸收仪测定所得的溶液中Fe3+和Mn2+的浓度见表1。在与催化氧化实验相同的反应条件下,不投加催化剂,用硝酸铁和硝酸锰配制成一定浓度的Fe、Mn离子水样进行催化氧化实验。Fe3+、Mn2+催化氧化降解甲基橙的效果见图6,在不同pH值下投加金属离子和臭氧单独氧化对甲基橙的去除效果基本相同,可见投加了Fe3+、Mn2+并不能起到催化氧化的作用。考虑到金属离子可能会产生混凝效果,进行了只投加对应溶出浓度金属离子的实验,结果表明微量的Fe3+、Mn2+离子对甲基橙的去除没有效果。在该实验条件下催化剂中溶出的金属离子既不会影响催化氧化作用,也没有产生混凝效果,说明投加催化剂能够提高甲基橙的去除率与催化剂表面的性质有关。
表1不同pH下溶液中Fe3+、Mn2+溶出浓度
Table 1Fe3+, Mn2+dissolution concentration at different pH solutions

pHFe3+/mg·L-1Mn2+/mg·L-130.02204.102850.02063.376570.01401.1748
3结论
在溶液不同pH值条件下,催化氧化能提高甲基橙的去除率,当pH值为3时,催化氧化的效果最好,反应进行20 min,催化氧化与臭氧单独氧化相比对甲基橙的去除率提高24%;只有在pH值为3时催化剂表现出了较好的吸附性能,这与催化剂的pHPZC以及甲基橙带电情况有关;在不同pH值下催化剂中Fe3+、Mn2+均有溶出,但溶出的离子对催化氧化去除甲基橙基本没有影响,也不会产生混凝效果,且随着pH的增加Fe3+、Mn2+的溶出量均减小。
参考文献:
[1]Camel V,Bermond A. The use of ozone and associated oxidation processes in drinking water treatment [J]. Water Resarch, 1998, 32(11): 3208-3222.
[2]Langlais B, Reckhow D A, Brink D R. Ozone in Water Treatment: Application and Engineering [M]. Lewis Publisher, Chelsea, 1991.
[3]Tahmasseb L A,Nelieu S, Kerhoas L, et al. Ozonation of chlorophenylurea pesticides in water: reaction monitoring and degradation pathways [J]. Sci. Total Environ, 2002, 291(1-3): 33-44.
[4]Garoma T, Gurol M D. Degradation of tert-butyl alcohol in dilute aqueous solution by an O3/UV process [J]. Environ. Sci. Technol, 2004, 38 (19): 5246-5252.
[5]Pillai K C, Kwon T O, Moon I S. Degradation of wastewater from terephthalic acid manufacturing process by ozonation catalyzed with Fe2+, H2O2and UV light: direct versus indirect ozonation reactions [J]. Applied Catalysis B:Environmental, 2009, 91(1-2): 319-328.
[6]Beltrán F J, Rivas F J. Kinetics of catalytic ozonation of oxalic acid in water with activated carbon [J]. Ind. Eng. Chem. Res, 2002, 41(25): 6510-6517.
[7]Faria P C C,rfão J J M, Pereira M F R. Activated carbon and ceria catalysts applied to the catalytic ozonation of dyes and textile effluents [J]. Applied Catalysis B:Environmental, 2009, 88(3-4): 341-350.
[8]Zhao L, Sun Z H, Ma J, et al. Enhancement mechanism of heterogeneous catalytic ozonation by cordierite-supported copper for the degradation of nitrobenzene in aqueous solution [J]. Environ. Sci. Technol, 2009, 43(6):2047-2053.
[9]Kim B, Fujita H,Sakai Y, et al. Catalytic ozonation of an organophosphorus pesticide using microporous silicate and its effect on total toxicity reduction [J]. Water Sci Technol, 2002, 46(4-5): 35-41.
[10] 杨威,任南琪,李圭百.超声-水合二氧化锰联合降解水中亚甲基盐[J].黑龙江大学自然科学学报,2014,31(4):511-516.
[11] Kasprzyk-Hordern B, Ziólek M, Nawrocki J. Catalytic ozonation and methods of enhancing molecular ozone reactions in water treatment [J]. Applied Catalysis B:Environmental, 2003, 46(4): 639-669.
[12] Faria P C C, Monteiro D C M,rfão J J M, et al. Cerium, manganese and cobalt oxides as catalysts for the ozonation of selected organic compounds [J]. Chemosphere, 2009, 74(6): 818-824.
[13] Ocampo-Pérez R, Sánchez-Polo M, Rivera-Utrilla J,et al. Enhancement of the catalytic activity of TiO2by using activated carbon in the photocatalytic degradation of cytarabine [J]. Applied Catalysis B:Environmental, 2011, 104 (1-2): 117-184.[14] 齐立江,张宏宇,潘凯.Cds量子点敏化TiO2光阳极的可控构筑及其光电传输特性[J].黑龙江大学工程学报,2015,6(1):43-47.
[15] Orge C A, Oefão J J M, Pereira M F R, at al. Ceria and cerium-based mixed oxides as ozonation catalysts [J]. Chem Eng, 2012, 200-202:499-505.
[16] Qi F, Xu B, Chen Z, et al. Catalytic Ozonation for Degradation of 2, 4, 6-Trichloroanisole in Drinking Water in the Presence of gamma-AlOOH [J]. Water Environment Research, 2009, 81 (6): 592-597.
[17] Moussavi G,Khosravi R, Omran N R. Development of an efficient catalyst from magnetite ore: Characterization and catalytic potential in the ozonation of water toxic contaminants [J]. Applied Catalysis A:General, 2012, 445:42-49.
[18] Gervasini A, Vezzoli G C, Ragaini V. VOC removal by synergic effect of combustion catalyst and ozone [J]. Catalysis Today, 1996, 29(1-4): 449-455.
[19] 陈利强,袁福龙.BaO对La0.8M0.2CoO3(M=Mg、Ca、Sr)催化分解NO的影响[J].黑龙江大学工程学报,2015,6(4):32-35.
[20] 王斌远,陈忠林,樊磊涛,等.pH值对Fe(Ⅱ)还原处理含饹废水的影响及动力学研究[J].黑龙江大学自然科学学报,2014,31(3):356-360.
[21] 张世芝, 吴丽娃, 程振民. 硅藻土零电荷点及吸附行为分析 [J]. 重庆理工大学学报, 2012, 26(2): 35-38.
[22] 王悦辉, 沈建红. 不同电性的纳米银对甲基橙光谱学性质的影响 [J]. 物理化学学报, 2012, 28(6): 1313-1319.
Effect of pH on the catalytic oxidation of Fe-Mn removal of methyl orange
LIU Bei, ZHANG Yong-Li*, ZHANG Jing,KE Wu,ZHOU Peng
(CollegeofArchitectureandEnvironment,SichuanUniversity,Chengdu610065,China)
Abstract:It studied how the Fe-Mn-doped catalyst’s catalytic oxidation and adsorption in solutions of different pH values affected the degradation of methyl orange. The results showed that the efficiency of the catalytic oxidation removing methyl orange was better than ozonation under alkaline, neutral and weakly acidic conditions, but there was basically no catalyst of methyl orange for the adsorption. The catalyst performed a good adsorption of methyl orange under strongly acidic condition (pH=3), meanwhile,the effect of catalytic oxidation was obvious. The removal rate of methyl orange can reach 88.15% higher 24% than the effect of ozonation when the reaction proceeded to 20 min. Reactions were accompanied by the dissolution of Fe and Mn ions which had no significant effect on the catalytic oxidation.
Key words:ozonation; catalytic oxidation; methyl orange; pH value
DOI:10.13524/j.2095-008x.2016.01.008
收稿日期:2015-11-19;
修订日期:2015-11-26
基金项目:教育部创新团队资助项目(ITR1027);四川环保科技计划资助项目(2013HB08)
作者简介:刘蓓(1992-),女,云南保山人,硕士研究生,研究方向:水处理技术,E-mail:940307231@qq.com;*通讯作者:张永丽(1958-),女,四川眉山人,教授,博士,研究方向:水处理理论与技术,E-mail:zxm581212@163.com。
中图分类号:X52
文献标志码:A
文章编号:2095-008X(2016)01-0041-05
网络出版地址:http://www.cnki.net/kcms/detail/23.1566.T.20160301.0926.004.html

