1-磷酸鞘氨醇对雄性小鼠生殖毒性损害的拮抗作用*
刘丹薇, 潘 卫, 徐国宾, 杨国珍**
(1.贵州医科大学 医学检验学院 生化学教研室, 贵州 贵阳 550004; 2.北京大学肿瘤医院 检验科, 北京 100142)
·基础研究·
1-磷酸鞘氨醇对雄性小鼠生殖毒性损害的拮抗作用*
刘丹薇1, 潘卫1, 徐国宾2, 杨国珍1**
(1.贵州医科大学 医学检验学院 生化学教研室, 贵州 贵阳550004; 2.北京大学肿瘤医院 检验科, 北京100142)
[摘要]目的: 探讨1-磷酸鞘氨醇(S1P)对雄性小鼠生殖细胞毒性损害的拮抗作用。方法: 健康雄性昆明小鼠40只,随机分为正常对照组、S1P低剂量(0.05 μg/g)、S1P中剂量(0.1 μg/g)、S1P高剂量(0.2 μg/g)组以及环磷酰胺染毒组;正常对照组予生理盐水,后4组予环磷酰胺,腹腔注射给药5 d;S1P低、中、高剂量组后再予相应剂量S1P腹腔注射,给药结束后第30天处死小鼠,分别采集血清、附睾及睾丸样本,检测小鼠睾丸精子计数和精子畸形率,比色法测定LDH活力,彗星实验检测精子DNA损伤。 结果: 与环磷酰胺染毒组相比,各S1P剂量组精子计数升高,畸形率降低,LDH活力升高,DNA损伤减低,差异有统计学意义(P<0.05)。结论: S1P对雄性小鼠生殖细胞毒性损害具有一定的拮抗作用,能提高精液质量与能量代谢酶LDH的活性,一定程度上抵御细胞DNA损伤。
[关键词]小鼠; 生殖细胞; 药物拮抗作用; 1-磷酸鞘氨醇
近年来,我国不孕不育家庭逐渐增多,不孕不育现状不禁令人堪忧,男性原因发生的不育症占比已经超过了一半。2015年的调查数据显示,男性与女性不孕不育的发病率为3∶2。过去25年间国内育龄男性精液质量分析报告显示,精子数量和精子活力均呈下降趋势。目前,不孕不育问题已成为一个重要的医学和社会问题。由于不孕不育症状发现时,生殖细胞势必已经发生了损伤,故如何修复和改善这些损伤成为了关键。近年来,许多研究发现,1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)可以抑制包括辐射和化学药物等许多应激因子所致的成体细胞、生殖细胞、胚胎的细胞凋亡[1-4]。此外,外源性S1P可减少早期胚胎细胞凋亡,从而改善胚胎发育潜能[5]。因此,SIP在提高人类辅助生殖技术临床结局方面有潜在的应用价值。本次研究使用的染毒组药物是环磷酰胺,它是目前常用的一种烷化剂类抗肿瘤药物。已经有报道证实,环磷酰胺可对雄性生殖系统造成毒性损害[6]。因此,本研究利用S1P对环磷酰胺导致的生殖毒性进行干预,通过对精液质量的相关指标以及精子DNA损伤情况的检测,揭示S1P对雄性生殖细胞毒性损害的拮抗作用,从而为生殖毒性损害的防治提供依据。
1材料和方法
1.1材料
1.1.1主要试剂与仪器环磷酰胺(江苏恒瑞医药股份有限公司),S1P(美国Sigma公司),乳酸脱氢酶(LDH)试剂盒(R&D公司),正常、低熔点琼脂糖(AMRESCO进口分装),二甲基亚砜(DMSO),曲拉通X-100(Triton-X-100,AMRESCO进口分装),三羟甲基氨基甲烷(Tris),N-十二烷基肌氨酸钠(SKL,AMRESCO进口分装),溴化乙锭(EB,AMRESCO进口分装),电子精密天平(JJ500,常熟双杰测试仪器),光学显微镜(NIKON YS100,日本尼康公司),正置荧光显微镜(Axio Imager A2,德国ZEISS公司)。
1.1.2动物选择健康成熟昆明种属雄性小鼠40只,体重25~30 g,购自贵州医科大学动物实验中心,动物许可证号SYXK(黔)2012-0001。
1.2实验方法
1.2.1动物分组与处理将雄性小鼠随机分为5组,每组8只,分别为正常对照组、S1P低、中、高剂量组、环磷酰胺染毒组。正常对照组按0.01 mL/10 g体重给予生理盐水;后4组给予环磷酰胺40 mg/kg,连续给药5 d,染毒期间小鼠自由饮食饮水。S1P低、中、高剂量组在给予环磷酰胺后,间隔2 h再分别根据小鼠体重,按0.05、0.1、0.2 μg/g剂量给予S1P腹腔注射。
1.2.2取材及标本制作 各组于给药结束后第30天,采用摘眼球法收集小鼠血液,离心取血清,待测LDH;颈椎脱臼后立即打开腹腔,取出双侧附睾、睾丸,附睾研磨后收集精子悬液,测定精子计数、精子活动率、精子畸形率以及DNA损伤。
1.2.3小鼠精子计数、精子活动率、精子畸形率精子活动率:完整分离小鼠附睾,将一侧附睾放入盛有1 mL 37 ℃预温的生理盐水的EP管中剪碎,用吸管轻轻吹打混匀数次,于37 ℃水浴箱中静置10 min,待精子自由流出;在室温条件下,取精子悬液于血细胞计数板上镜检,连续计数200个精子中活动精子数,计算活精子百分率=(活精子数/200)×100%。小鼠精子计数:将精子悬液置于60 ℃水浴箱中孵育10 min杀死精子,取精子悬液于血细胞计数板的计数池内,按红细胞计数法计数中央大方格内5个中方格中精子数,计算精子总数/mL=5个中方格精子总数×5×10×103。小鼠精子畸形率检查:取1滴精子滤液推片,室温自然干燥,甲醇固定、干燥,然后用2%伊红染色1~2 h,流水冲洗、晾干,高倍显微镜检验,计数1 000条精子中的畸形精子数,精子畸形率(%)=畸形精子数/1 000×100%。
1.2.4小鼠血清以及睾丸匀浆LDH活性测定用ELISA法检测,具体操作按LDH检测试剂盒说明书进行。
1.2.5精子DNA损伤测定彗星实验检测精子DNA损伤。利用小鼠精子悬液根据Singh彗星实验基本步骤[7],参考罗明志[8]等人对于彗星实验的改良进行操作,荧光显微镜下观察精子拖尾情况并采图,在200倍物镜随机取10个视野拍照,图像输入Cometscore彗星实验图像分析系统进行分析,得到尾矩(TM)以及Olive尾距(OTM)。
1.3统计学方法
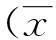
2结果
2.1小鼠精子数量、活动率和精子畸形率
与正常对照组相比,S1P低、中、高剂量组、环磷酰胺染毒组精子数量及精子活动率降低,精子畸形率增高,差异有统计学意义(P<0.01);与环磷酰胺染毒组相比,S1P低、中、高剂量组、正常对照组精子数量及精子活动率升高,精子畸形率降低差异有统计学意义(P<0.05)。见表1。
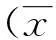
表1 各组小鼠精子数量、精子活动率及畸形率±s)
与环磷酰胺染毒组比较,(1)P<0.05,(2)P<0.01;(3)与正常对照组比较,P<0.01
2.2LDH活性
随着S1P剂量的增加,小鼠血清和睾丸LDH的活性均逐渐升高。环磷酰胺与染毒组相比,S1P中、高剂量拮抗组LDH活性差异有统计学意义(P<0.05),S1P低剂量组差异无统计学意义(P>0.05);与正常对照组相比,S1P低、中剂量拮抗组LDH活性降低,差异有统计学意义(P<0.05),与S1P高剂量拮抗组差异无统计学意义(P>0.05)。见表2。各组血清和睾丸之间的LDH活性趋势见图1。
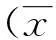
表2 各组实验小鼠血清和睾丸LDH活性±s)
与环磷酰胺染毒组组比较,(1)P<0.05,(2)P<0.01;与正常对照组比较,(1)P<0.05,(2)P<0.01
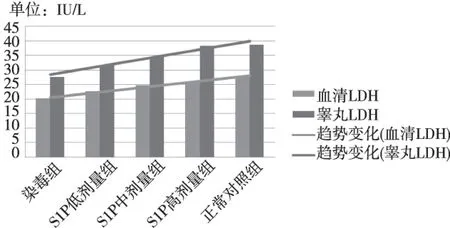
图1 各组小鼠血清和睾丸LDH活性Fig.1 Effect of S1P on activity of LDH of serum and testis in each experimental group of mice
2.3小鼠精子DNA损伤
荧光显微镜下,可见正常对照组的精子细胞大小均一,为一圆形荧光团,荧光强度均匀,边缘光滑,基本无拖尾现象(图2A);环磷酰胺染毒组精子细胞大部分出现明显拖尾,尾部荧光强度较强,彗星头部直径较正常对照组减小(图2B);S1P剂量组随着拮抗剂量的增加,出现拖尾的细胞逐渐减少,拖尾细胞的拖尾长度也逐渐缩短(图2C~E)。随着S1P剂量的增加,TM和OTM逐渐降低(表3),S1P中、高剂量组与环磷酰胺染毒组相比差异有统计学意义(P<0.05),S1P低剂量组与染毒组差异无统计学意义(P>0.05),S1P高剂量组与正常对照组相比差异无统计学意义(P>0.05)。
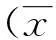
表3 各组实验小鼠生殖细胞DNA损伤情况±s)
(1)与环磷酰胺染毒组比较,P<0.01;(2)与正常对照组比较,P<0.01
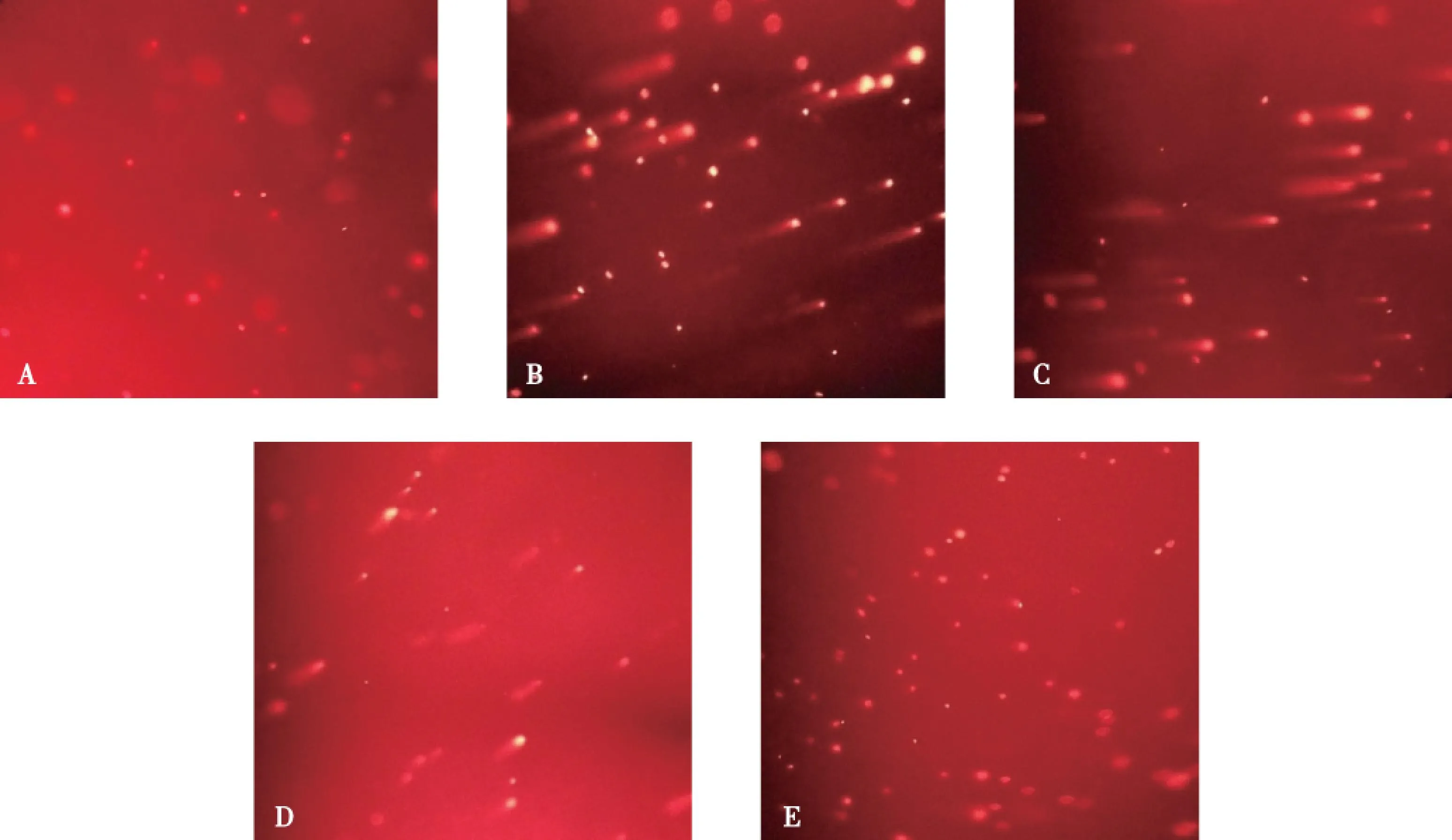
注:A为染毒组,B为S1P低剂量组,C为S1P中剂量组,D为S1P高剂量组,E为正常对照组图2 各组小鼠精子细胞彗星图像(×200)Fig.2 Comet image of sperm cells in each experimental group of mice
3讨论
精液质量是评价雄性生育能力的重要指标,其中精子数量、活动率、精子畸形率是检测各种理化因子对生殖细胞影响的敏感指标。本次研究结果显示,S1P剂量组小鼠虽然与正常对照组相比仍有差异,但与单纯环磷酰胺染毒组相比,精子数量、活动率显著增加,精子畸形率显著降低,精液质量已经明显改善。其可能的原因是环磷酰胺能对细胞信号传导通路损伤。目前研究表明,S1P能够通过与不同受体结合激活细胞内外信号转导通路,通过与5个G蛋白耦联受体(G-protein coupled receptor,GPCR)家族蛋白相互作用,触发不同的细胞反应,促进细胞存活和增殖[9]。故本研究中S1P可能抑制了环磷酰胺对细胞信号通路的损伤,从而对小鼠精子数量和精子畸形率的改变产生了一定的干预作用。另外,本结果显示S1P高剂量组与正常对照组比较依然有显著性差异,故下一步将考虑分组时再设计一个更高的剂量,以便达到更显著的效果。
LDH 是睾丸间质细胞、支持细胞和生精上皮细胞膜和精子的标志酶,其活力改变导致睾酮分泌减少,精细胞生长因子减少,精子的发生和发育受阻,生精功能受损[10]。LDH几乎存在于所有体细胞中,且有多种同工酶,分别为LDH1~LDH5,睾丸和精子中则是LDHX,其电泳迁移率介于LDH4和LDH5之间。本研究还同时检测了血清LDH,发现S1P各组血清总LDH活性与睾丸LDH的活性变化相一致,都呈现上升趋势,且从变化趋势线斜率上看,睾丸LDH活性较血清总LDH活性稍大,说明血清总LDH活性的升高是由于睾丸LDH活性的升高所致。本研究结果显示,环磷酰胺染毒组小鼠血清和睾丸LDH 活性显著降低,提示环磷酰胺可干扰生精细胞能量生成,从而导致成熟精子减少,活力下降。实验小鼠睾丸LDH随S1P剂量的增加,活性明显升高,推测S1P具有一定抗氧化作用,故对于环磷酰胺造成的小鼠睾丸组织损伤具有改善作用。其中,低S1P剂量组睾丸LDH活性虽然与染毒组相比未有明显差异,但联系该组的精子活力与畸形率结果,发现已经与染毒组有差异,说明低剂量S1P已经对环磷酰胺的毒性作用产生了一定的抵御作用,而该抵御作用有可能是通过其他途径来实现。
根据相关报道,彗星实验对于探索毒物对DNA 的直接损伤、DNA 或染色体突变的可能性的价值较高[11]。本研究在传统的彗星实验方法步骤的基础上增加了梯度脱水的环节,发现胶体在脱水后明显变薄,使视野中观察到的精子细胞基本上位于同一平面,提高了采图效率和结果的可靠性。本研究结果显示,环磷酰胺染毒组彗星拖尾明显,证明环磷酰胺在停药后对睾丸细胞DNA仍有持续的损伤作用,推测是环磷酰胺通过激活活性氧类物质(reactive oxygen species,ROS),使其超过了机体的抗氧化能力,直接氧化精子DNA碱基,造成精子DNA链损伤和断裂[12]。可能是为保持遗传分子的完整性,生殖细胞启动了DNA修复系统。然而当修复失败,DNA损伤会激活细胞凋亡的发生,以保持基因组的稳定性。而高、中剂量的S1P可以明显抑制由环磷酰胺引起的DNA损伤。低剂量S1P组与染毒组没有明显统计学差异,因本次结果只统计200个细胞,猜想可能是由于实验统计细胞量不够大,致使最终结果未能看出明显差异。推测如若将细胞量扩大3~5倍,有可能会产生统计学差异,此项内容将在以后的研究中进行。此外本次研究使用的是睾丸细胞混合悬液细胞,无法指出睾丸细胞中具体哪种细胞对环磷酰胺引起的遗传损伤比较敏感,下一步将分离睾丸组织中的各类细胞进行单细胞凝胶电泳,以便区分哪类睾丸细胞对环磷酰胺最为敏感。
综上,S1P对雄性小鼠的生殖毒性损伤有一定的拮抗作用,该作用可能与抗氧化有关,S1P可能活化了因环磷酰胺而降低的能量代谢酶LDH,提高精子的运动能力。S1P作用的具体机制及其与凋亡蛋白的相关性,仍有待下一步研究。
4参考文献
[1] Suomalainen L,Pentikiinen V,Dunkel L.Sphingosine-1-phosphate inhibits nuclear factor KB activation and germ cell apoptosis in the human testis independently of its receptors[J].Am J Pathol, 2015(3):773-781.
[2] Mofita Y,Perez GI,Paris F,et al.Oocyte apoptosis is suppressed by disruption of the acid sphingomyelinase gene or by sphingosine-1-phosphate therapy [J].Nat Med, 2010(10):1109-1114.
[3] Ruth Z,Hansen PJ.Sphingosine-1-phosphate protects bovine oocytes from heat shock during maturation.Biol Rcprod, 2004(6):2072-2078.
[4] Jee BC,Jo JW,Suh CS,et al.Dose-dependent effect of sphingosine-1-phosphate in mouse ooeyte maturation medium on subsequent embryo development[J].Gynecol Obstet Invest, 2011(1):32-36.
[5] Hannoun A,Ghaziri G,Musa AA,et al.Addition of sphingosine-1-phosphate to human oocyte culture medium decreases embryo fragmentation[J].Reprod Biomed Online, 2010(3):328-334.
[6] 杨群芳. 环磷酰胺对雄性生殖系统毒性损伤的研究进展[J]. 儿科药学杂志, 2013(3):62-65.
[7] Singh NP,MT,Tice RR,et al. A simple technique for quantification of low levels of DNA damage in dividual cells[J]. Exp Cell Res, 1988(175):184-191.
[8] 罗明志,齐浩,屈颖,等. 传统单细胞凝胶电泳方法的改良[J]. 中华劳动卫生职业病杂志, 2007 (11):674-675.
[9] 丁玉松,牛强,李述刚,等. 原花青素对氟致雄性小鼠精子数和畸形的改变[J]. 毒理学杂志, 2013 (3):197-200.
[10]Fyrst H,Saba JD.An update on sphingosine-1-phosphate and other sphingolipid mediators.Nat Chem Biol, 2010 (7):489-497.
[11]Marchlewica M,Michslska T,Wiszniewska B. Detection of leadinduced oxidative stress in the rat epididymis by chemil uminescence[J].Chemosphere, 2004(10):1553-1562.
[12]Simon L,Lutton D,McManus J,et al. Sperm DNA damage measured by the alkaline comet assay as an independent predicto of male infertility andinvitrofertilization success.Fertil Steril, 2011 (2) :652-657.
(2016-02-01收稿,2016-04-25修回)
中文编辑: 周凌; 英文编辑: 刘华
Study on Antagonistic Effect of S1P on Toxicity Damage to Male Mice' Reproductive Cells by Cyclophosphamide
LIU Danwei1, PAN Wei1, XU Guobing2, YANG Guozhen1
(1.DepartmentofMedicalLaboratory,GuizhouMedicalUniversity,Guiyang50004,Guizhou,China;2.DepartmentofMedicalLaboratory,BeijingCancerHospital,Beijing100142,China)
[Abstract]Objective: To study the antagonistic effect of S1P on toxicity damage to male mouse reproductive cells. Methods: Forty healthy male Kunming mice were randomly divided into 5 groups: normal control group( physiological saline), low S1P dose group(0.05 μg/g), middle S1P dose group(0.1 μg/g), high S1P dose(0.2 μg/g) and cyclophosphamide exposure control group.Mice in each group were given intraperitoneal injection for 5 days and killed on the 30th day after the first treatment. The serum, epididymis and testis of the mice were collected. The sperm count and the rate of sperm deformity were detected. The colorimetric method was adopted to detect LDH activity and the comet assay adopted to detect DNA damage of sperm. Results: Compared with cyclophosphamide exposure control group,sperm count increased, deformity rate decreased, LDH activity and cell DNA damage decreased in each experimental S1P group, and the differences between the two groups were statistically significant(P<0.05). Conclusion: S1P has antagonistic effect on toxicity damage to male mouse reproductive cells, can improve semen quality, activate energy metabolism enzyme LDH and resist DNA damage of sperm to some degree.
[Key words]mice; cerm cells; drug antagonism; sphingosine-1-phosphate
*[基金项目]国家自然科学基金(81560720)
[中图分类号]R321
[文献标识码]A
[文章编号]1000-2707(2016)05-0515-05
DOI:10.19367/j.cnki.1000-2707.2016.05.005
**通信作者 E-mail:yangguozhen-kong@hotmail.com
网络出版时间:2016-05-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160513.2040.024.html

