西安市不同园林植物根际效应及生态化学计量特征研究
罗 萌,刘长海
(延安大学 生命科学学院,陕西延安 716000)
西安市不同园林植物根际效应及生态化学计量特征研究
罗萌,刘长海*
(延安大学 生命科学学院,陕西延安 716000)
摘要:为了解西安市12种园林植物(三叶草、美人蕉、鸢尾、芍药、大叶女贞、桂花、香樟、广玉兰、石楠、夹竹桃、大叶黄杨和法国冬青)的根际效应及其生态化学计量特征,分析了各植物C、N、P与土壤C、N、P的相关性和差异性,以探讨园林植物的养分限制状况,为揭示城市生态系统植物的养分循环机制和植物对环境变化的响应与适应策略奠定基础。结果表明:(1)不同园林植物的根际土壤C、N、P均高于非根际土壤,表现出显著的富集作用,但不同植物的根际富集作用则不尽一致;根际土壤pH显著低于非根际;而且乔木对土壤C、N、P的吸收能力均较强。(2)不同园林植物土壤C、N、P垂直分布表现为依次递减趋势,呈现出明显的“表聚性”。(3)不同园林植物的相同器官中C、N、P含量均表现为乔木>灌木>草本,同种园林植物C、N、P含量在不同器官基本表现为叶>茎>根,说明不同植物对不同元素吸收迁移、累积不尽一致,并且不同器官对C、N、P元素的吸收、富集以及吸收特性也不同。(4)土壤C/N平均值依次表现为乔木>草本>灌木,但三者之间差异不显著,土壤C/P和N/P平均值依次表现为草本>乔木>灌木,土壤中较低的C/N和C/P初步说明了在自然条件下园林植物更容易受土壤N和P的限制。(5)叶片C/N平均值依次表现为灌木>草本>乔木,叶片C/P和N/P平均值依次表现为草本>灌木>乔木,而且三者之间差异均显著。(6)相关性分析显示,不同园林植物叶片C、N、C/N、N/P分别与所对应的土壤C、N、C/N、N/P呈显著相关关系,说明园林植物对营养元素的需求与土壤营养元素种类的供应基本保持一致,而土壤P含量对植物叶片P影响并不大。
关键词:园林植物;根际效应;生态化学计量;西安
根际是进行生物地球化学循环最活跃的区域,也是土壤-植物根际-微生物三者相互作用的场所和各种物质循环和能量流动的门户,对生态系统养分动态分布与循环发挥着重要作用[1]。由于根际是土壤-植物根际-微生物生态系统物质交换的活跃界面,植物通过一定的根际效应不断的摄取养分,土壤养分通过质流和扩散的方式向植物根系表皮迁移,使得根际微区的养分浓度、形态与分布都较为复杂[2]。因此,根际过程对于认识植物对土壤中养分的利用及适应显得非常重要。生态化学计量综合了生态学和化学计量学的基本原理探究,分析生态系统多种元素的循环与平衡,也是研究C、N、P等元素在生态系统过程中的耦合关系的综合方法[3]。土壤是植物生长所需养分的主要来源,植物叶片将部分养分元素转移并补偿给土壤,土壤养分供应量、植物养分需求量以及植物对其自身养分需求的自我调节,使得植物叶片、土壤养分含量具有明显的时空变化,同时也增加了植物叶片与土壤养分之间的复杂性[4]。C、P、N等元素作为结构性元素,在探究物质和能量循环以及多元素平衡过程中发挥着重要指示作用[4]。
园林植物是现代城市景观的重要元素之一,它不仅具有显著的时空节奏、独立的景观以及独特的园林意境,也是城市、自然和景观复合生态系统中具有重要自净功能的组成部分[5-6]。园林植物叶片和土壤C、P、N是生态系统中重要的生态因子,其土壤和植物C、N、P元素的变化对于揭示植物的营养需求和养分转移、累积差异有重要意义[7]。加强园林植物及其化学计量比的研究,一方面可以深入了解植物生长过程中的养分利用状况,对土壤中养分的可获性、有效性和C,N,P养分的循环和平衡机制研究至关重要;另一方面对理解区域生态系统物质循环过程与元素耦合关系具有重要意义[5,7]。目前,针对于中国园林植物的研究主要集中在城市生态系统形成与演化、服务功能及价值评估、景观格局动态变化等方面,城市园林植物根际土壤特征及对环境的适应中所起的作用等科学问题尚未得到充分的认识;另外,关于植物的根际效应及生态学计量特征研究较多,而城市不同园林植物根际效应及其地上和地下生态化学计量的研究尚不多见,同时,以根际效应为基础的城市园林植物生态化学计量研究是植被生态学研究的一个重要领域。因此,在对西安市绿地现状分布的全面调查的基础上,通过研究西安市不同园林植物根际效应及其土壤C、N、P化学计量变化规律和控制因子,以探讨园林植物的养分限制状况,为揭示城市生态系统植被的养分循环机制和植物对环境变化的响应与适应策略提供基础数据,亦为理解中国区域生态化学计量学格局的趋同与分异提供基础数据。
1材料和方法
1.1研究区概况
西安市位于黄河流域中部的关中盆地(107°40′~109°49′ E,33°39′~34°45′ N),总面积9 983 km2,海拔约424 m。西安市属于暖温带半湿润的季风气候,四季分明,雨量适中,无霜期227 d,年平均气温13.6 ℃,年极端最低气温-20.6 ℃,年极端最高气温43.4 ℃,年降水量507.7~719.8 mm,集中在7~9月,年平均湿度69.6%,年日照时数1 983~2 267 h。土壤类型复杂多样,多由石灰岩玄、页岩、武岩等成土母岩发育而成。截止2013年统计,西安市有578条道路和165条分车绿带,经过多年建设已全部进行了绿化,其中市管道路38条,绿化养护面积228万m2,区管道路540条,行道绿化树种42万多株,人均公共绿地面积大约7.15 m2,建成区绿地率约19.95%,建成区绿化覆盖率30.43%。据不完全统计,西安市园林植物种类繁多,可开发利用的园林观赏植物资源丰富,园林植物约有56科113属312余种(含变种、变型和亚种),主要包括:乔木类(悬铃木、国槐、红叶李、垂柳、大叶女贞、桂花、香樟、广玉兰、青岩油杉、翠柏、光叶木兰、乐东拟单性木兰、川含笑等)、灌木类(大叶女贞、南天竹、海桐、石楠、夹竹桃、大叶黄杨、法国冬青、阔叶十大功劳、山茶、腊梅、丁香、紫穗槐等)、草本类(三叶草、美人蕉、鸢尾、虞美人、凤仙花、一串红、金盏菊、鸡冠花、郁金香、孔雀草、芍药等)[8]。
1.2研究方法
2015年8月,根据西安市园林绿化植物的分布及种类,分别在西安市莲湖区、碑林区、雁塔区和新城区的主要街道上采集乔木(大叶女贞、桂花、香樟和广玉兰)、灌木(石楠、夹竹桃、大叶黄杨和法国冬青)、草本(三叶草、美人蕉、鸢尾和芍药)等12种园林植物(每种园林植物选取5株作为重复统计数据,结果见表1,数据为2015年),采集和挖取整株植物(乔木挖取部分根,枝剪部分茎和叶片,灌木和草本挖取整个植株带回实验室),枝剪剪取上、中、下部分茎(去皮,尽量不要干扰植物)。
土壤垂直方向取样与植物取样同时进行,四分法分层采集每种植物根系周围的土壤(0~10、10~20、20~30、30~40、40~50 cm,>1 kg),土壤经自然风干,去除石块、植物残体等残杂物,研磨后过60目筛后备用。
植物叶片分别从不同方向和不同部位均匀收集大量成熟叶片,将叶片小心封存于锥形瓶内,蒸馏水洗净整个植株(依次分为根、茎和叶),晾干,在105 ℃杀青30 min,70 ℃烘干至恒重,烘干样品粉碎过40目筛。
根际土壤样品采集采用Riley的抖落法[9]。挖取具有完整根际的土体(根际主要分布的范围),轻轻抖落大块不含根际的土壤为非根际土(S),装入塑料袋内混匀,然后用刷子刷下粘附在根围的土壤(距离根围0~5 mm)作为根际土(R),对于混杂于根际土中的根系要彻底去除。每种植物分别随机采集5株根际、非根际土壤,总共采集到植物60株和120个土样,刚采集的新鲜土样自然条件风干20 d后风干去除有机碎片,磨细,过2 mm筛用以测定土壤养分。
1.3测定方法
1.3.1土壤养分及理化性质的测定土壤碳氮(g·kg-1)测定采用元素分析仪(EA3000,Italy);土壤磷(g·kg-1)测定采用NaOH碱溶-钼锑抗比色法;土壤pH采用电位电极法(1∶5土水比浸提液)。
1.3.2植物叶片养分的测定叶片碳氮(mg·kg-1)测定采用元素分析仪;叶片磷(mg·kg-1)采用钒钼黄吸光光度法[10]。
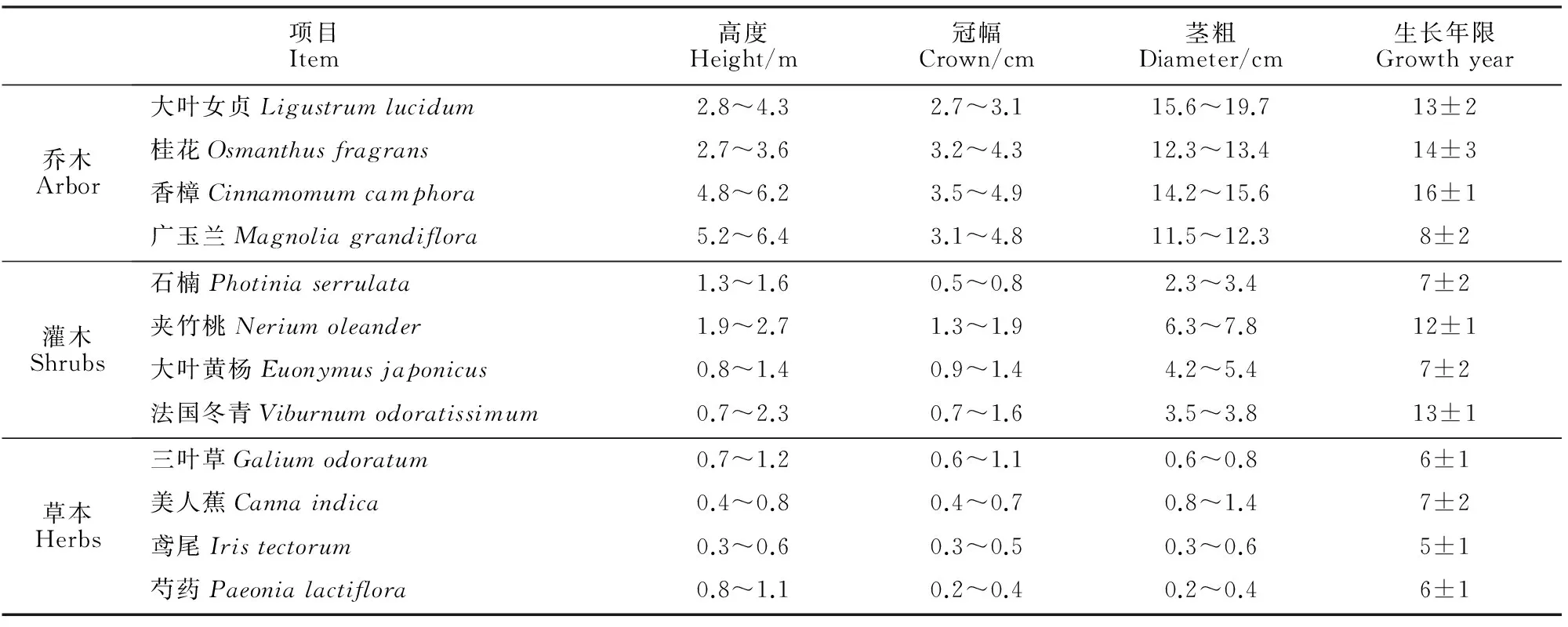
表1 不同园林植物生长特点
1.4数据处理与分析
实验所测数据用Microsoft Excel 2012和Spss 21.0进行显著差异分析、方差及相关性分析(平均数间的多重比较采用Ducan’s检验方法)。
根际富集率E(Enrichment ratio)反映养分的富集程度,E值的大小反映土壤性状值在植物根际的富集程度,同时也反映了植物根际效应的强弱,计算公式如下[9]:
E=[(根际含量-非根际含量)/非根际含量]×100%
2结果与分析
2.1土壤养分根际效应
2.1.1土壤根际效应由图1可知,不同园林植物根际和非根际土壤养分含量特征基本一致,其中根际土壤养分含量均高于非根际养分含量,根际土壤pH值均低于非根际;根际和非根际C含量大小基本表现为:草本>乔木>灌木;其中香樟、广玉兰、石楠、夹竹桃、法国冬青和芍药土壤根际C含量极显著高于非根际(P<0.01),大叶女贞、大叶黄杨、三叶草和美人蕉土壤根际C含量显著高于非根际(P<0.05);根际和非根际N含量大小基本表现为:草本>乔木>灌木,大叶女贞、桂花、香樟、广玉兰、石楠、夹竹桃、三叶草、美人蕉和芍药土壤根际N含量极显著高于非根际(P<0.01),大叶黄杨土壤根际N含量显著高于非根际(P<0.05);根际和非根际P含量大小基本表现为:草本>乔木>灌木;石楠、夹竹桃和大叶黄杨土壤根际P含量极显著高于非根际(P<0.01),大叶女贞、香樟、法国冬青和三叶草土壤根际P含量显著高于非根际(P<0.05);根际和非根际pH值大小基本表现为:乔木>灌木>草本,大叶女贞、桂花、香樟、广玉兰和夹竹桃土壤根际pH值极显著低于非根际(P<0.01),石楠土壤根际pH值显著低于非根际(P<0.05)。总体来看,灌木和乔木土壤C含量的根际效应高于草本植物,乔木、灌木和草本植物土壤N均表现出一定的根际效应,灌木和乔木植物土壤P表现出一定的根际效应,而草本植物土壤P的根际效应则不明显,乔木植物土壤pH值表现出明显的根际效应,草本植物土壤pH值没有明显的根际效应。
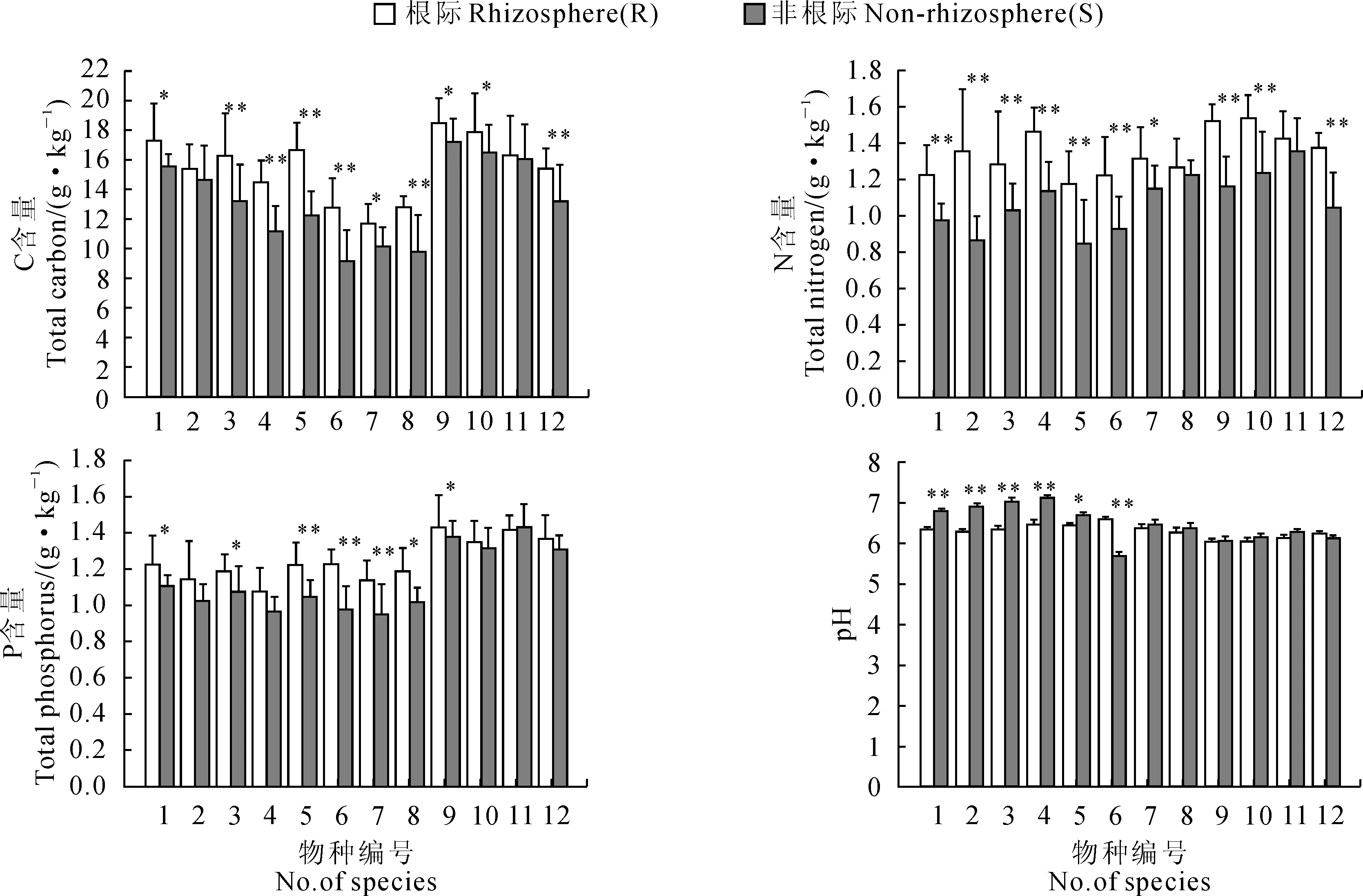
1.大叶女贞;2.桂花;3.香樟;4.广玉兰;5.石楠;6.夹竹桃;7.大叶黄杨;8.法国冬青;9.三叶草;10.美人蕉;11.鸢尾;12芍药;下同。*和**分别表示根际与非根际在0.05和0.01水平上差异显著
2.1.2根际与非根际土壤养分平均值和富集率植物根系在从外界环境吸收养分的过程中,主要是受根际吸收的影响,不同的根际吸收速率导致根际养分富集。由表2可知,不同植物根际与非根际土壤C、N含量和pH值差异均显著(P<0.05),而根际和非根际土壤P差异并不显著(P>0.05),不同植物根际土壤C、N、P含量均高于非根际,根际热pH值显著低于非根际(P<0.05)。相对于非根际土壤,根际C含量平均高出14.19%,N含量平均高出20.00%,P含量平均高出8.80%,由于根系呼吸分泌有机酸,同时也释放CO2,进而导致微生物活动加强,大量分泌和产生有机酸致使根际酸化,而根际pH值的降低能够提高多种矿质养分的有效性和促进养分有效性的转化和活化,本研究中土壤pH值平均低出0.3个单位,从而保证了其对营养元素的吸收。从综合根际与非根际土壤养分分布来看,不同园林植物根际土壤养分呈现出较为明显的富集和截存效应。
2.2土壤化学计量
2.2.1土壤C、N、P及pH平均值由图2可知,不同园林植物土壤C、N、P平均含量基本表现为一致的变化规律,土壤C含量变化范围为11.3~16.3
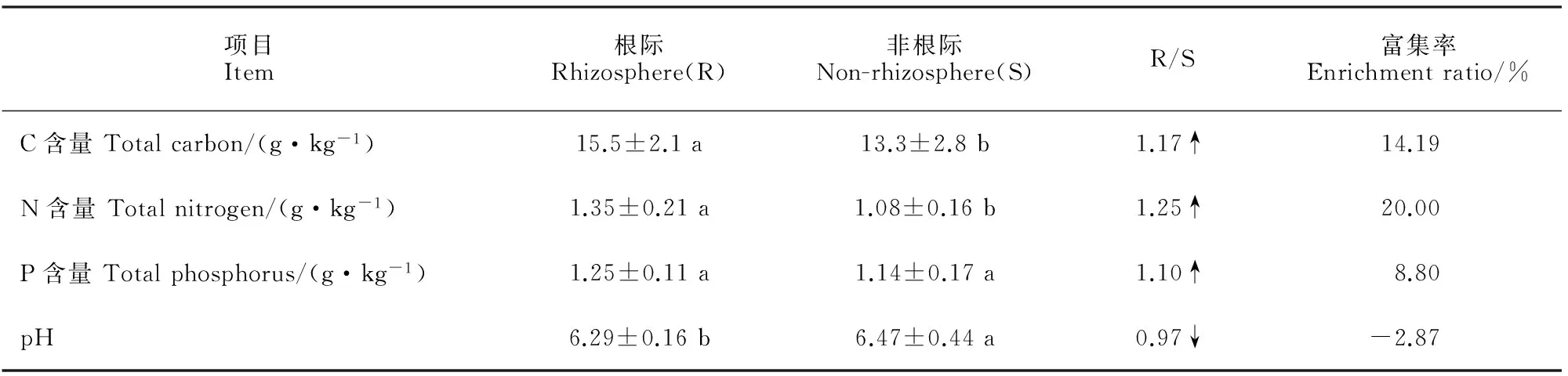
表2 根际与非根际土壤养分平均值和富集率
注:同种植物根际与非根际土壤若字母相同表示差异不显著(P>0.05)。
Note:The same letters of rhizosphere and non-rhizosphere soil indicate no significant difference at the 0.05 level.
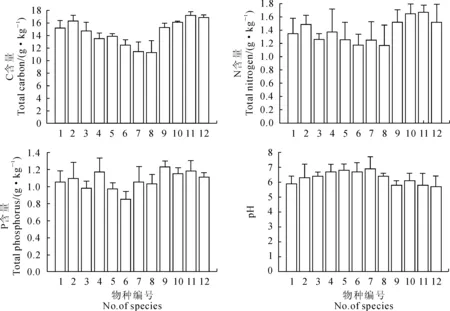
图2 不同园林植物土壤C、N、P及pH平均值
g·kg-1;土壤N含量变化范围为1.18~1.52 g·kg-1,土壤P含量变化范围为0.85~1.23 g·kg-1,土壤pH值变化范围为0.58~0.69;土壤C、N和P含量基本表现为草本(三叶草、美人蕉、鸢尾和芍药)>乔木(大叶女贞、桂花、香樟和广玉兰)>灌木(石楠、夹竹桃、大叶黄杨和法国冬青),而土壤pH基本表现为乔木(大叶女贞、桂花、香樟和广玉兰)>灌木(石楠、夹竹桃、大叶黄杨和法国冬青)>草本(三叶草、美人蕉、鸢尾和芍药)。
2.2.2土壤C、N、P垂直分布特征由图3可知,不同园林植物土壤养分含量(C、N和P)随土层深度的增加呈降低趋势,并且其降低范围越来越小,以0~10 cm土层最高,深层(40~50 cm)土壤养分含量最低,表现出明显的“表聚性”,在40~50 cm土层,不同园林植物土壤养分基本相等或者一致;对于同层土壤,土壤养分基本表现为草本(三叶草、美人蕉、鸢尾和芍药)>乔木(大叶女贞、桂花、香樟和广玉兰)>灌木(石楠、夹竹桃、大叶黄杨和法国冬青)。
2.3植物不同器官C、N、P
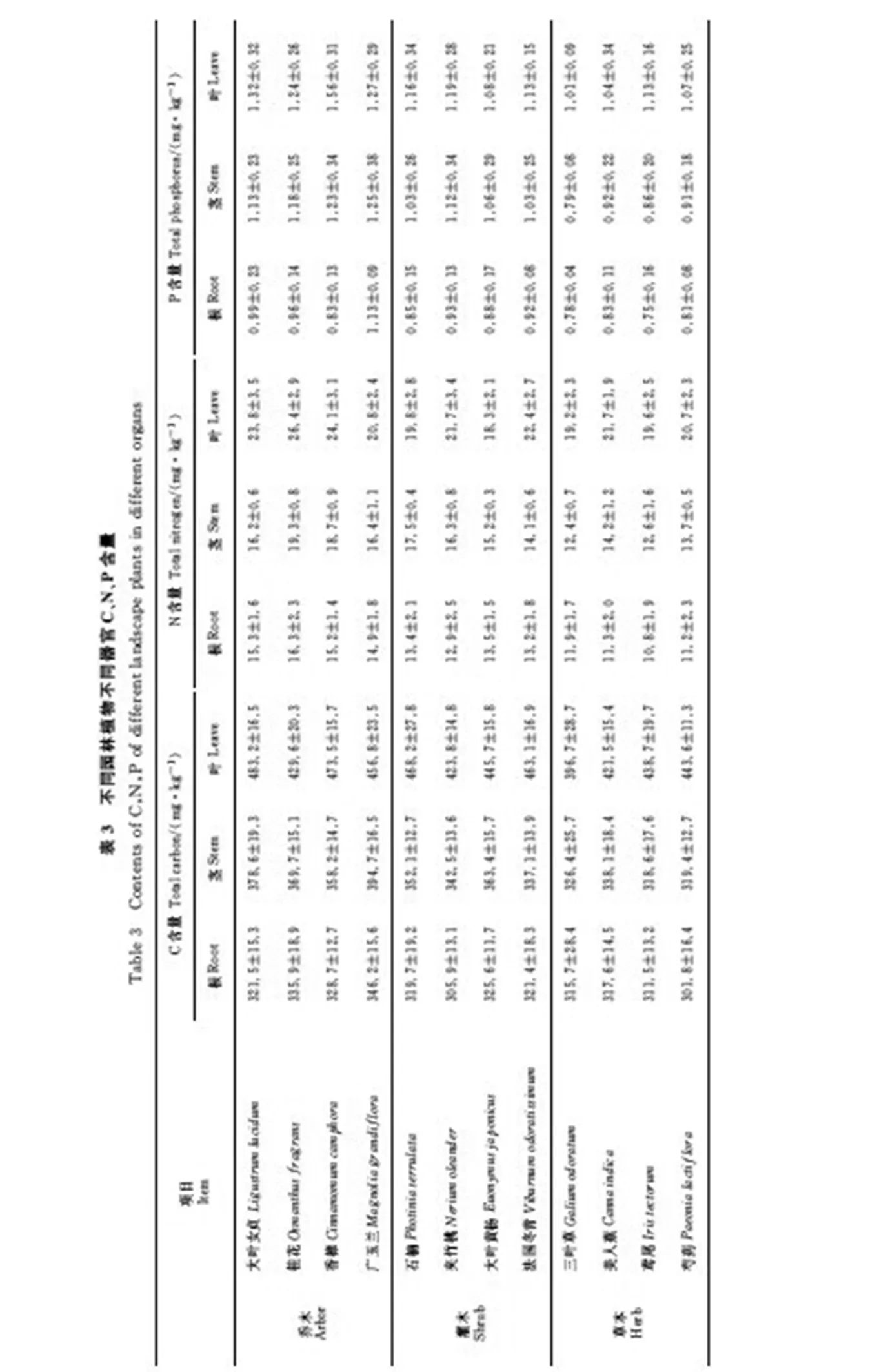
由表3可以看出,不同园林植物在相同器官中C、N和P含量差异较大,各器官C、N和P含量变化趋势相一致,基本表现为乔木(大叶女贞、桂花、香樟和广玉兰)>灌木(石楠、夹竹桃、大叶黄杨和法国冬青)>草本(三叶草、美人蕉、鸢尾和芍药);不同园林植物C、N和P含量基本表现为:C>N>P;即使是同种植物,不同器官C、N和P含量也不尽一致,同种植物C、N和P含量在各器官基本表现为叶>茎>根,并且叶和茎远高于根,呈现出明显的叶的富集作用。
2.4土壤与植物叶片化学计量
表4统计了不同园林植物叶片和土壤化学计量分布特征,由表可知,对于土壤化学计量,乔木土壤C/N变化范围为9.85~11.67(均值为10.93),灌木土壤C/N变化范围为9.12~11.03(均值为10.10),草本土壤C/N变化范围为9.76~11.12(均值为10.31),土壤C/N平均值依次表现为乔木>草本>灌木,并且三者额之间差异并不显著(P>0.05);乔木土壤C/P变化范围为11.54~15.00(均值为13.99),灌木土壤C/P变化范围为10.86~14.71(均值为12.72),草本土壤C/P变化范围为12.69~15.23(均值为14.20),土壤C/P平均值依次表现为草本>乔木>灌木,乔木和草本之间差异不显著(P>0.05),二者显著高于灌木(P<0.05);乔木土壤N/P变化范围为1.17~1.29(均值为1.28),灌木土壤N/P变化范围为1.14~13.39(均值为1.28),草本土壤N/P变化范围为1.29~1.43(均值为1.38),土壤N/P平均值依次表现为草本>乔木>灌木,乔木和灌木之间差异不显著(P>0.05),二者显著低于草本(P<0.05)。对于植物叶片化学计量,乔木叶片C/N变化范围为16.27~21.96(均值为19.55),灌木叶片C/N变化范围为19.53~24.36(均值为22.05),草本叶片C/N变化范围为19.42~22.88(均值为21.78),叶片C/N平均值依次表现为灌木>草本>乔木,草本和灌木之间差异不显著(P>0.05),二者显著高于草本(P<0.05);乔木叶片C/P变化范围为303.53~366.06(均值为343.93),灌木叶片C/P变化范围为356.13~412.69(均值为395.57),草本叶片C/P变化范围为388.23~414.58(均值为402.69),叶片C/P平均值依次表现为草本>灌木>乔木,三者之间差异均显著(P<0.05);乔木叶片N/P变化范围为15.45~21.29(均值为17.79),灌木叶片N/P变化范围为16.94~19.82(均值为18.02),草本叶片N/P变化范围为16.86~20.87(均值为18.61),叶片N/P平均值依次表现为草本>灌木>乔木,三者之间差异均显著(P<0.05)。
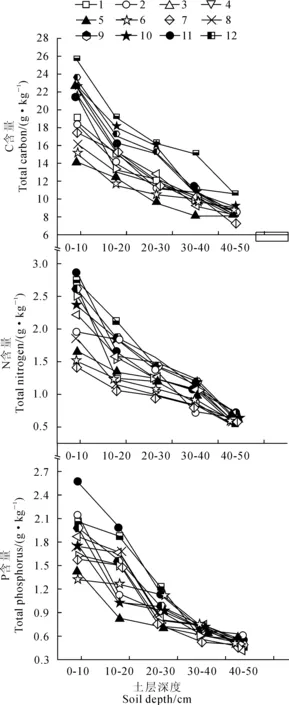
图3 土壤C、N、P垂直分布特征
2.5土壤与植物化学计量的相关性分析
由表5可知,经计算可知,由原始数据拟合得到的回归关系经统计学检验得到拟合度参数(R2)和显著性(P),并检验其相关系数显著性得出和筛选出最佳拟合方程,通过建立曲线回归关系得到下表,下表反应了不同园林植物土壤C、N、P与植物C、N、P之间的曲线相关关系,由表可知,不同园林植物叶片C与土壤C均呈极显著的线性相关关系(y=23.856x-15.237,P<0.01,R2=0.956,F=36.58);叶片N与土壤N均呈极显著的线性相关关系(y=0.569x+13.694,P<0.01,R2=0.859,F=45.13);叶片P与土壤P没有明显的相关关系(P>0.05);叶片C/N与土壤C/N呈极显著的线性相关关系(y=1.237x-1.056,P<0.01,R2=0.769,F=34.21);叶片N/P与土壤N/P呈极显著的对数相关关系(y=2.368e-1.574x,P<0.01,R2=0.899,F=42.06)。
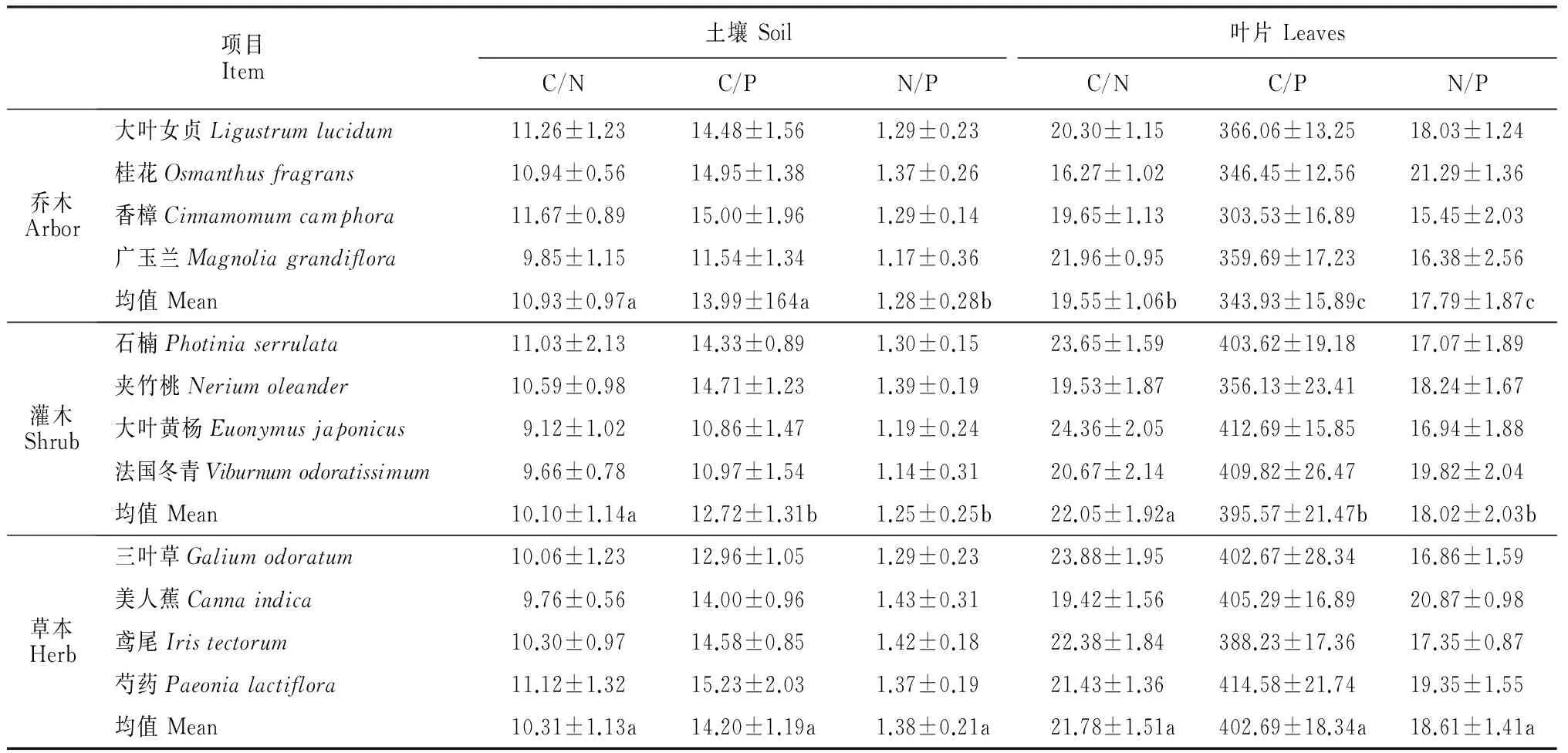
表4 不同园林植物土壤与植物叶片化学计量
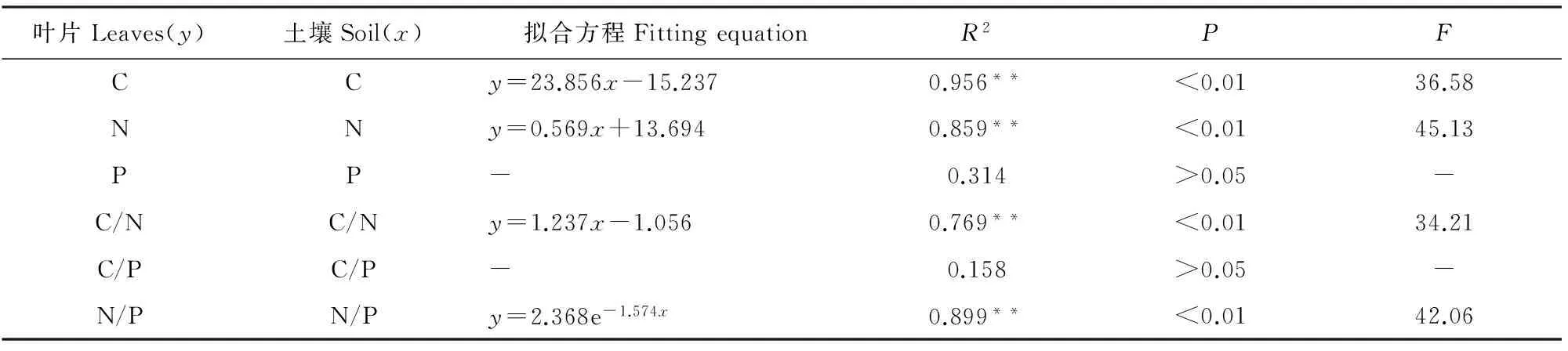
表5 土壤与植物化学计量的相关性分析
注:**.相关性在0.01水平上显著;*.相关性在0.05水平上显著;下同。
Note:**.Correlation is significant at the 0.01 level (2-tailed);*.Correlation is significant at the 0.05 level (2-tailed).
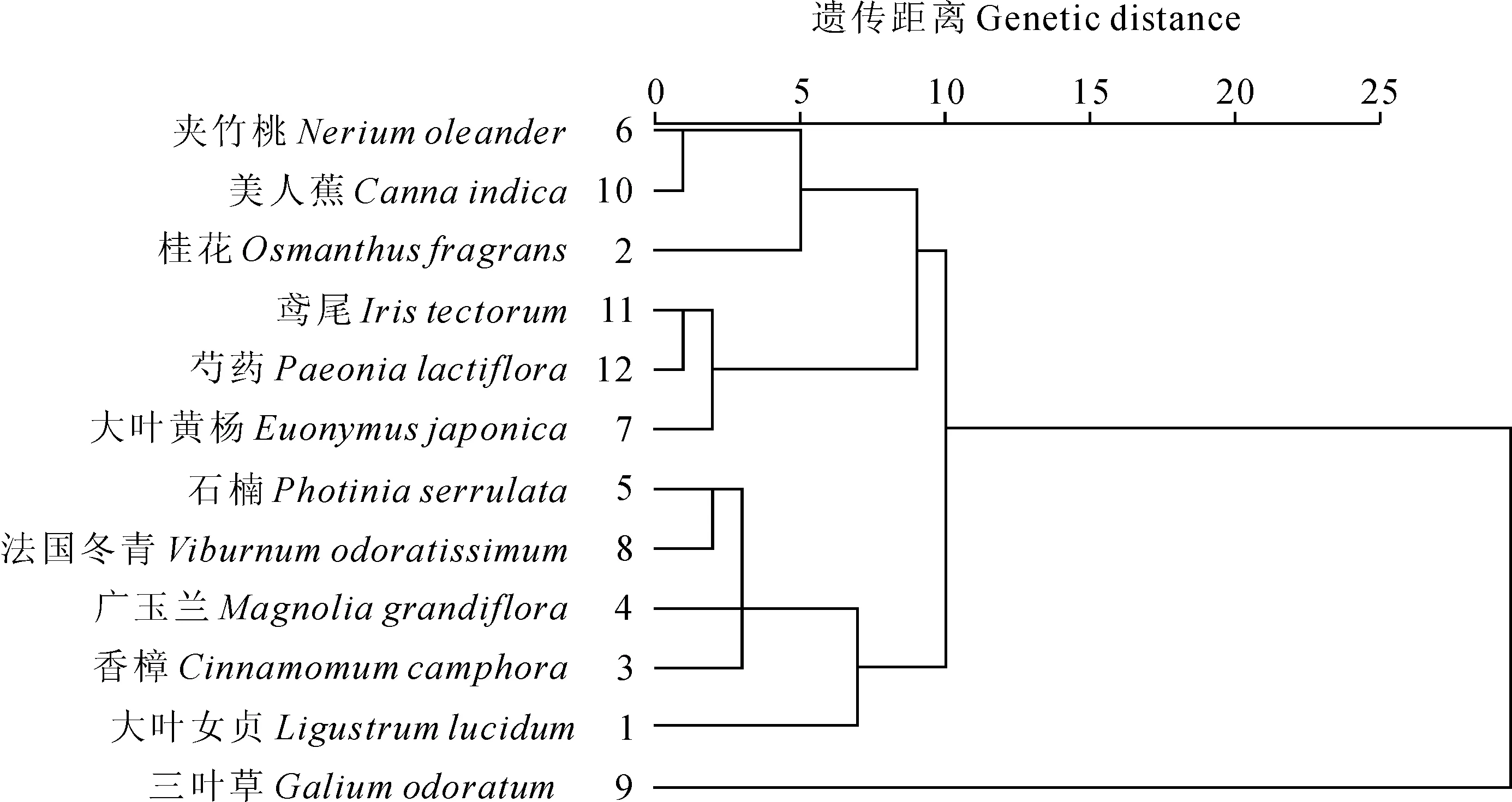
图4 土壤与植物化学计量的聚类分析
2.6土壤与植物化学计量的聚类分析
聚类分析作为一种科学分类方法,根据不同指标从特征和性质上的亲疏关系和亲密程度出发,确定2个或者2个以上物种间的亲疏和亲缘关系。本研究以不同植物土壤和植物C、N、P(包括根茎叶)主成分载荷系数作为评价指标,以欧氏距离作为衡量不同群落土壤和植物C、N、P差异的指标,最短距离法对不同园林植物进行系统分析(图4)。由聚类分析数据得到的聚类图较为直观地体现了物种之间的亲疏和亲缘关系。聚类分析的结果表明,当拟定临界值取15时,可将其划分为2类,三叶草归为一类,大叶女贞、桂花、香樟、广玉兰、石楠、夹竹桃、大叶黄杨、法国冬青、美人蕉、鸢尾和芍药归为一类;当临界值取9时,夹竹桃、美人蕉、桂花、鸢尾、芍药和大叶黄杨归为一类,石楠、法国冬青、广玉兰、香樟和大叶女贞归为一类,三叶草归为一类。
3讨论
大量关于植物根际的研究表明,元素在根际与非根际土壤中存在较大的差异,自然状态下不同植物根际对根际土壤中的养分(C、N、P)需求利用较高,这也导致了植物根际根际土壤C、N、P含量在一定程度上要高于非根际[3]。本研究显示不同园林植物根际土壤C、N、P均高于非根际土壤,可能是由于园林植物根际不断从外界摄取养分及其分泌物向根表的迁移,适应环境需要更多的营养维持根际的生长和发育,因而出现更多的根际沉淀和养分富集,使得根际微区域内的养分形态、浓度和分布等方面较为复杂,这充分体现了园林植物在定居和发育过程中对C、N、P的需求[3]。综合比较可知,乔木对土壤C、N、P的吸收能力均较强,主要是由于乔木对土壤凋落物的截获,通过发达根际以根际沉积的形式显著聚集于根际,并且其植物叶片的贡献相对较大。本研究还显示不同植物根际富集作用则不尽一致,主要是由于植物根际分泌的有机物质是不同的,引起其根际C、N、P的吸收和转移的差异,这也为根际周围有机质的产生提供有利条件[11]。有研究表明[12],根际通过呼吸释放CO2、根际分泌有机酸、根际微生物活动所产生有机酸和CO2等作用来降低根际土壤pH值。由于根际分泌物种类和数量繁多、影响因素相对复杂,不同分泌物之间可能存在相互替代和拮抗作用等,使得植物根际分泌物对C、N、P有多重影响。本研究中,不同园林植物根际和非根际土壤pH值差异显著(P<0.05),主要是由根际呼吸作用释放CO2以及在离子的主动吸收和根尖细胞伸长过程中分泌质子和有机酸以及外界生态系统环境所致,pH值越小有利于促进土壤养分的转化和活化,改善根际周围土壤的环境,同时也利于园林植物根际对土壤C、N、P的吸收。综上所述,本研究初步表明园林植物土壤C、N、P在根际存在一定的富集,它们通过降低根际pH值可以提高根际C、N、P含量。此外,土壤C、N、P差异主要与植物生物学特性、土壤理化特性、凋落物、土壤微生物种类、酶活性以及自身的生长节律有关,是各种因素综合作用的结果,仍存在较多的不确定性因素。
本研究的结果表明,不同园林植物土壤C、N、P垂直分布规律表现为依次递减。植物根系营养吸收大部分来自于处于土壤中的有机质,枯落物中有机质的输入、土壤微生物的分解、地下生物量和根系垂直分布等综合作用造成了这种分布格局,而土壤表层具有丰富的有机质和凋落物,土壤养分归还在垂直方向依次递减,因此,不同园林植物土壤C、N、P含量均表现出明显的“表聚性”,此外,这种结果不仅与其所处的土壤、气候条件有关,还受植物生长状况、植物吸收作用、土壤机械组成、沉积过程、水文状况等多种因素的影响[13]。本研究还表明,相同器官中植物C、N、P含量均表现为乔木>灌木>草本,局部有所波动;同种植物C、N、P含量在不同器官基本表现为叶>茎>根;说明了不同植物对不同元素吸收迁移、累积不尽一致,并且不同器官对C、N、P元素吸收、富集和吸收特性也不同;一方面反映植物本身的特性,另一方面也反映C、N、P在植物体内的迁移能力。
C、N、P在植物生长代谢中发挥着重要的作用,彼此独立而又相互影响,在生长过程中,植物能够调整养分需求改变各元素相对比例[3]。从均值来看,不同园林植物不同器官表现为C>N>P,此外,植物叶片C、N、P含量均高于根系,C元素主要以有机质形式存在,叶片作为光合作用的主要部位使得糖类得到有效的积累,成为导致叶片C含量高的原因。叶片C含量403.6~483.2 g·kg-1,接近于Elser等[14]对全球492种陆地植物叶片C(464±32.1) g·kg-1明显偏低;叶片N含量为18.3~26.4 g·kg-1,接近于全球[15]水平20.1 g·kg-1;与全球水平叶片P含量1.99 g·kg-1或1.80 g·kg-1相比[15],叶片P含量(0.98±1.56) g·kg-1明显偏低,大部分仍于高于全国平均水平[16]1.21 g·kg-1,这与植物叶片营养格局与生长节律有密切关系,植物体内要保持较高的P素含量以满足rRNA快速合成蛋白质,这也说明了不同园林植物叶片具有较高的N含量的假说[17]。
土壤碳氮磷比(C/N/P)是土壤有机质或其它成分中的C、N、P素总质量的比值,是衡量土壤有机质组成和营养平衡的一个重要指标,也是确定土壤C、N、P平衡特征的重要参数[16]。对于土壤化学计量,土壤C/N平均值依次表现为乔木>草本>灌木,并且三者之间差异并不显著(P>0.05),土壤C/P和N/P平均值依次表现为草本>乔木>灌木,根据土壤碳氮储量计算[16],全球土壤C/N平均值为13.33,中国土壤C/N平均值在10:1~12:1之间,不同园林植物土壤C/N分别为10.10~10.93,介于中国土壤C/N平均值。有研究指出[14],N和P的有效性是由土壤有机质的分解速率确定的,较低的C/N和C/P是N和P有效性的指标之一,本研究中较低的C/N和C/P初步说明了在自然条件下园林植物更容易受土壤中N和P的限制。此外,C/N/P主要受气候、水热等环境条件和土壤母质的影响,人类活动的干扰和土壤植被的空间差异也会造成C/N/P产生较大的变化[16]。C、N、P是植物生长过程中的重要元素,C、N、P生态化学计量比维持着生态系统过程及其功能的重要特性,C/N可以作为预测有机质分解速率的一个很好的指标,C/P和N/P可以很好地反映植物的生长速率,低的C/P和N/P表征植物较快的生长速率,并且植物叶片N/P来表征植物生长的限制性养分[15]。本研究中,对于植物叶片化学计量,叶片C/N平均值依次表现为灌木>草本>乔木,叶片C/P和N/P平均值依次表现为草本>灌木>乔木,三者之间差异均显著(P<0.05)。一般认为,植物叶片的N/P能够从植物个体、群落和生态系统水平判断N、P的养分限制模式,然而N/P的阈值至今仍没有得到一致的定论。以Koerselman[18]理论作为依据,N/P<14时,N成为限制性元素,N/P>16时,P成为限制性元素,介于二者之间时,受N和P的共同限制;而关于陆地生态系统的研究差异较大,Güsewell[19]在陆地生态系统中的研究认为,当N/P<10时,N是限制性元素,N/P>20时,P是限制性元素,介于二者之间时,受N和P的共同限制。本研究如果以Güsewell的理论作为判断依据,不同园林植物共同受到N和P的限制,以Koerselman和Meuleman的理论作为判断依据,不同园林植物受P限制,两种方法对园林植物生长的限制性养分判断结论并不一致,园林植物所表现出的养分适应策略差异较大,而今后需深入开展N和P的添加实验来验证园林植物生长过程中的限制性元素。
相关性分析可知,不同园林植物叶片以C含量最高,N含量其次,P含量最低,与土壤中营养元素组成特征基本一致,在一定程度上秉承了土壤的某些特性。对植物和土壤C、N、P与叶片C、N、P的相关分析表明,土壤C与叶片C呈极显著的相关关系(P<0.01),土壤C、N与植物叶片C、N呈显著相关关系(P<0.01),说明不同园林植物土壤C对叶片C的影响和贡献较大,土壤中营养元素储量远大于植物的吸收量,土壤是营养元素的最大储存库,植物对营养元素的需求与土壤营养元素种类的供应一致,也说明了园林植物叶片营养元素受土壤中营养元素的影响;同时,土壤P含量对植物叶片P影响并不大,这表明在小尺度区域,植物叶片P含量较低可能不是由于土壤P含量低导致[14]。植物对土壤元素的吸收和运输是复杂而精细的过程,受到土壤环境及叶片C、N、P化学计量受植物的生活史、进化史、系统位置、遗传漂变和环境因子的影响,未来研究植物C、N、P与土壤C、N、P关系还需综合考虑多种因素的影响。此外,本研究首次尝试了以不同园林植物和土壤C、N、P主成分载荷系数作为评价指标将不同园林植物进行聚类分析,根据聚类分析结果可作为不同园林植物分类和判别的参考和依据,而聚类分析的结果与实际情况基本吻合,这有助于对园林植物某些生态和生理现象的合理解释。在今后的研究中,可尝试将植物所处生长环境的土壤特性、大气环境污染特性、植物生理等作为综合指标,集合化学计量,从多角度将园林植物按照其自身特性以及对环境的适应性进行归类,从而判断园林植物的类型、生态位以及限定养分和抗环境干扰能力等,由于不同园林植物生存的环境具有广泛的变异,不仅与多种生态环境条件(光照、温度、水分)和人类干扰等众多因素密切相关,其判断的可靠性尚需接受实践的检验。
参考文献:
[1]CHENG W,JOHNSON D W,FU S.Rhizosphere effects on decomposition[J].SoilScienceSocietyofAmericaJournal,2003,67(5):1 418-1 427.
[2]PHILLIPS R P,FAHEY T J.Tree species and mycorrhizal associations influence the magnitude of rhizosphere effects[J].Ecology,2006,87(5):1 302-1 313.
[3]QUIGG A,FINKEL Z V,IRWIN A J,etal.The evolutionary inheritance of elemental stoichiometry in marine phytoplankton[J].Nature,2003,425(6 955):291-294.
[4]CROSS W F,BENSTEAD J P,Frost P C,etal.Ecological stoichiometry in freshwater benthic systems:recent progress and perspectives[J].FreshwaterBiology,2005,50(11):1 895-1 912.
[5]FACELLI J M,PICKETT S T A.Plant litter:its dynamics and effects on plant community structure[J].TheBotanicalReview,1991,57(1):1-32.
[6]WIMP G M,MARTINSEN G D,FLOATE K D,etal.Plant genetic determinants of arthropod community structure and diversity[J].Evolution,2005,59(1):61-69.
[7]甘露,陈伏生,胡小飞,等.南昌市不同植物类群叶片氮磷浓度及其化学计量比[J].生态学杂志,2008,27(3):344-348.
GAN L,CHEN F S,HU X F,etal.Leaf N and P concent rations and their stoichiometric ratios of different functional groups of plants in Nanchang City[J].ChineseJournalofEcology,2008,7(3):344-348.
[8]LAMBERS H,BRUNDRETT M C,RAVEN J A,etal.Plant mineral nutrition in ancient landscapes:high plant species diversity on infertile soils is linked to functional diversity for nutritional strategies[J].PlantandSoil,2010,334(1-2):11-31.
[9]RILEY D,BARBER S A.Salt accumulation at the soybean [Glycinemax(L.) Merr.] root-soil interface[J].SoilScienceSocietyofAmericaJournal,1970,34(1):154-155.
[10]RILEY D,BARBER S A.Bicarbonate accumulation and pH changes at the soybean [Glycinemax(L.) Merr.] root-soil interface[J].SoilScienceSocietyofAmericaJournal,1969,33(6):905-908.
[11]PHILLIPS R P,FAHEY T J.Tree species and mycorrhizal associations influence the magnitude of rhizosphere effects[J].Ecology,2006,87(5):1 302-1 313.
[12]WESTOBY M,WRIGHT I J.Land-plant ecology on the basis of functional traits[J].TrendsinEcology&Evolution,2006,21(5):261-268.
[13]BALDWIN D S,MITCHELL A M.The effects of drying and re-flooding on the sediment and soil nutrient dynamics of lowland river-floodplain systems:a synthesis[J].RegulatedRivers:Research&Management,2000,16(5):457-467.
[14]ELSER J J,FAGAN W F,DENNO R F,etal.Nutritional constraints in terrestrial and freshwater food webs[J].Nature,2000,408(6 812):578-580.
[15]ELSER J J,BRACKEN M E S,CLELAND E E,etal.Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater,marine and terrestrial ecosystems[J].EcologyLetters,2007,10(12):1 135-1 142.
[16]MAKINO W,COTNER J B,STERNER R W,etal.Are bacteria more like plants or animals?Growth rate and resource dependence of bacterial C∶N∶P stoichiometry[J].FunctionalEcology,2003,17(1):121-130.
[17]GOROKHOVA E.Effects of preservation and storage of microcrustaceans in RNAlater on RNA and DNA degradation[J].Limnol.Oceanogr.Methods,2005,3:143-148.
[18]KOERSELMAN W,MEULEMAN A F M.The vegetation N∶P ratio:a new tool to detect the nature of nutrient limitation[J].JournalofAppliedEcology,1996,5:1 441-1 450.
[19]GUSEWELL S.N∶P ratios in terrestrial plants:variation and functional significance[J].NewPhytologist,2004,164(2):243-266.
(编辑:潘新社)
Rhizosphere Effects and Ecological Stoichiometry of Different Landscape Plants in Xi’an
LUO Meng,LIU Changhai*
(College of Life Sciences,Yan’an University,Yan’an,Shaanxi 716000,China)
Abstract:Twelve dominate landscape plants,Galium odoratum,Canna indica,Iris tectorum,Paeonia lactiflora,Ligustrum lucidum,Osmanthus fragrans,Cinnamomum camphora,Magnolia grandiflora,Photinia serrulata,Nerium oleander,Euonymus japonicus,Lonicera japonica and Viburnum odoratissimumin Xi’an,Northern China.However,the distribution of soil nutrients in the rhizosphere and non-rhizosphere areas and ecological stoichiometry of landscape plants in this region have been largely unknown,This paper discusses the rhizosphere effects and ecological stoichiometry of twelve landscape plants in Xi’an.The results were as follows:(1)the content of soil C,N,and P in rhizosphere were higher than that of non-rhizosphere,while pH was lower than that of non-rhizosphere.The soil C,N,and P of different landscape plants showed significant enrichment and pH showed significant loss.(2)The content of soil C,N,and P presented the obvious “surface-aggregation”,which gradually declined with the increasing soil depth.(3)The content of soil C,N,and P in the same organs showed arbors>shrubs>herbs,and in the same landscape plants showed leaf>stem>root,which suggested that the landscape plants had its own absorption migration,accumulation characteristics.(4)As to soil stoichiometric,soil C/N showed arbors>shrubs>herbs,and had no significantly difference (P>0.05),soil C/P and N/P showed herbs>arbors>shrubs,the lower C/P and N/P preliminary showed the landscape plants more easily restricted by N and P in the soil under the natural conditions;As to plant stoichiometric,leaf C/N showed shrubs>herbs>arbors,C/P,N/P showed herbs>shrubs>arbors,and had no significantly difference (P>0.05).(5)Correlation analysis showed that the leaf C,N,C/N,N/P had significant correlation with soil C,N,C/N,N/P (P<0.05),which illustrated the demand for nutrition elements of the landscape plants basically consistent with soil nutrients,while the content of soil P had no effect with plant leaves P.
Key words:landscape plants;rhizosphere effects;ecological stoichiometry;Xi’an
文章编号:1000-4025(2016)04-0766-11
doi:10.7606/j.issn.1000-4025.2016.04.0766
收稿日期:2015-11-24;修改稿收到日期:2016-02-26
基金项目:国家自然科学资金(313770541);陕西省教育厅科研计划(2013JK0734);延安市科技计划(KZD-08)
作者简介:罗萌(1980-),女,硕士,讲师,主要从事植被和园林生态学、景观规划设计研究。E-mail:Luo_meng80@163.com
*通信作者:刘长海,博士,教授,硕士生导师,主要从事土壤及植被生态学研究。
中图分类号:Q945.12
文献标志码:A

