EGCG通过NGF/TrkA通路影响APP/PS1小鼠脑内Aβ沉积的研究
钟欣 刘明妍 姚维凡 杜可 杨时伦 赵海山 魏敏杰
中国医科大学药理教研室
EGCG通过NGF/TrkA通路影响APP/PS1小鼠脑内Aβ沉积的研究
钟欣刘明妍姚维凡杜可杨时伦赵海山魏敏杰
中国医科大学药理教研室
摘要:目的探讨绿茶的有效多酚成分表没食子儿茶素没食子酸酯(EGCG)对淀粉样前体蛋白/早老素基因(APP/PS1)转基因小鼠脑内β-淀粉样蛋白(Aβ)沉积及其对海马内神经生长因子(NGF)相关神经生长因子受体(TrkA)信号通路的影响。方法采用免疫组化及Western blot法分别检测小鼠海马Aβ1-40、淀粉样前体蛋白(APP)的蛋白表达水平,Western blot检测小鼠海马NGF及神经生长因子前体(proNGF)的表达水平及其共同受体TrkA下游细胞外信号调节激酶(ERK)通路相关蛋白的表达水平。结果免疫组化结果显示,模型组小鼠海马内Aβ1-40和APP表达(42.35±8.25、143.63±24.30)较对照组(13.04±4.36、19.89±4.93)均显著增加(均P<0.05),治疗组(19.72±6.55、38.07±18.19)较模型组明显降低(均P<0.05)。Western blot结果显示,与对照组(均为100)比较,模型组小鼠海马内Aβ1-40、APP的相对表达量增加(分别为363.39±45.77、499.51±65.75,均P<0.01),与模型组比较,治疗组Aβ1-40、APP相对表达量显著降低(分别为179.77±18.17、160.42±44.55,均P<0.01)。与对照组(均为100)比较,模型组NGF(16.39±4.03)、pro-NGF(25.92±5.37)、NGF/pro-NGF(63.64±10.68)、p-TrkA(7.92±2.13)、p-c-raf(7.37±2.66)、p-ERK1/2(13.53±4.44)及p-CREB(3.95±1.56)的相对表达量降低(均P<0.05);与模型组比较,治疗组NGF(80.78±12.18)、pro-NGF(48.63±3.83)、NGF/pro-NGF(165.84±19.02)、p-TrkA(72.33±6.21)、p-c-raf(88.12±5.33)、p-ERK1/2(60.21±10.34)及p-CREB(25.31±8.48)的相对表达量明显增加(均P<0.05)。治疗组与对照组上述指标比较差异均无统计学意义(均P>0.05)。结论EGCG主要通过上调NGF/proNGF比例,增加NGF的相对表达,继而激活其下游特异性TrkA通路,显著增加TrkA、c-raf、ERK1/2及其下游效应蛋白CREB的磷酸化水平,从而抑制Aβ1-40和APP的表达,改善学习记忆障碍,发挥神经保护作用。
关键词:表没食子儿茶素没食子酸酯;神经生长因子;TrkA;APP/PS1转基因小鼠;β-淀粉样蛋白
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性认知障碍为主要特征的神经系统退行性疾病,其典型的病理改变为神经细胞间出现大量以β-淀粉样肽(β-amyloid,Aβ)沉积为核心的老年斑(senile plaques,SP)及神经元丢失等[1]。研究表明,淀粉样前体蛋白(APP)在β-分泌酶的作用下水解产生大量Aβ沉积,Aβ的大量沉积通过氧化应激、钙超载、细胞调亡等方式启动了神经细胞发生退行性改变,进而出现AD样病变[2]。本文作者课题组前期的试验结果已证实表没食子儿茶素没食子酸酯〔(-)-epigallocatechin-3-gallate,EGCG〕可通过抑制神经营养因子受体p75信号通路抑制神经细胞凋亡,改善AD中的学习记忆障碍[3],然而,与p75通路密切相关的神经生长因子(nerve growth factor,NGF)以及酪氨酸激酶A(tyrosine kinase A,TrkA)通路在EGCG抑制Aβ沉积过程中所发挥的作用未明,因此,本研究拟进一步以淀粉样前体蛋白/早老素1(APP/PS1)双转基因小鼠为研究对象,从EGCG改善NGF相关TrkA信号通路的角度,探讨其改善APP/PS1转基因小鼠学习记忆障碍及抑制其脑内Aβ沉积的可能机制。
1材料和方法
1.1材料
1.1.1实验动物:9月龄C57 BL/6J小鼠10只,雌雄各半,体质量(21±4)g;9月龄APP/PS1转基因小鼠20只,雌雄各半,体质量(19±3)g。动物均由中国医科大学实验动物中心提供,实验过程中动物饲养及取材均遵守实验动物管理和保护的有关规定。
1.1.2主要试剂及仪器:Aβ1-40抗体及EGCG购自sigma公司,APP、TrkA、p-TrkA、c-raf、p-c-raf、ERK1/2、p-ERK1/2抗体、辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记山羊抗小鼠IgG抗体购自CST公司,NGF、NGF前体(pro-NGF)、环磷腺苷效应元件结合蛋白(CREB)、磷酸化环磷腺苷效应元件结合蛋白(p-CREB)、β-actin抗体购自Santa Cruz Biotechnology公司,RIPA Buffer裂解缓冲液、BCA试剂盒购自碧云天生物技术研究所,PMSF购自Roche公司,Super ECL Plus超敏发光液购自北京普利莱基因技术公司。
1.2方法实验分三组进行。APP/PS1转基因小鼠分为EGCG处理APP/PS1组(治疗组)和模型组两组,每组10只,雌雄各半,治疗组按体质量2 mg/(kg·d)给予EGCG〔EGCG配制成0.04%(质量浓度)的水溶液〕灌胃,模型组给予相同体积的双蒸水灌胃,1次/d;对照组:为C57BL/6J小鼠10只,以等体积于治疗组的双蒸水灌胃,1次/d。三组均连续灌胃4周,4周给药结束后,处死动物,取海马组织,或组织固定。
1.2.1免疫组化法检测小鼠脑组织中Aβ1-40和APP蛋白表达:行为学实验结束24 h后,将各组小鼠各5只先以水合氯醛麻醉并以200 mL生理盐水心室内灌流,继而更换4%(质量浓度)多聚甲醛溶液灌流,取脑固定24 h,常规石蜡包埋、切片进行免疫组化染色。切片进行脱蜡、水化,3%(质量浓度)H2O2于37℃孵育20 min,微波修复,正常山羊血清封闭液37℃封闭30 min,一抗抗体(Aβ1-40抗体和APP抗体)4℃孵育过夜,PBS洗后,二抗37℃孵育1 h,DAB显色,每张切片随机数海马区3个视野,用计算机图像分析系统分别测定各组小鼠每张切片内阳性表达Aβ1-40和APP蛋白神经元的整合光密度值,其整合光密度值的大小与Aβ1-40和APP的表达水平成正比。Aβ1-40和APP抗体标记的棕色区域即为阳性表达Aβ1-40和APP蛋白的神经元。使用图像分析软件对图片中阳性染色区域的累积光密度进行定量,再对单位面积的光密度值进行平均得到的数值即称为整合光密度值。
1.2.2小鼠海马中相关蛋白表达检测:以Western blot法检测小鼠海马中Aβ1-40、APP、NGF、pro-NGF、p-TrkA、p-c-Raf、p-ERK1/2、p-CREB等蛋白表达。取各组5只小鼠海马组织,放入预冷的RIPA Buffer裂解缓冲液及0.1%PMSF混合物中,冰上匀浆后,4℃以12000 g离心30 min,取上清,BCA法蛋白定量。每孔蛋白上样量50 μg,SDS-PAGE电泳分离蛋白并电转移至PVDF膜上。以5%(质量浓度)BSA的PBST中室温封闭2 h,分别加入NGF、pro-NGF、TrkA、p-TrkA、c-raf、p-c-raf、ERK1/2、p-ERK1/2、CREB1、p-CREB、APP、Aβ1-40、β-actin等一抗于4℃过夜,次日TBST洗膜后,加入相应的山羊抗兔或山羊抗鼠二抗,室温孵育2 h,ECL显影。按照蛋白相对分子质量(Mr)确定目的条带位置并测定灰度值,以目的条带灰度值与β-actin灰度值的比值为上述蛋白相对表达量。
1.3统计学处理采用SPSS16.0软件包进行分析。数据以均数±标准差( ±s)表示。三组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用Turkey’s post hoc test法。以P<0.05为差异有统计学意义。
2结果
2.1各组海马内Aβ1-40和APP蛋白的表达 免疫组织化学结果显示,模型组海马区Aβ1-40和APP阳性染色的棕色斑块与对照组比较显著增多,治疗组的斑块较模型组明显减少(图1)。模型组与对照组比较,Aβ1-40和APP阳性染色神经元的整合光密度值明显升高,治疗组与模型组比较显著下降(均P<0.05)。治疗组与对照组比较差异无统计学意义(P>0.05,表1)。
Western blot结果(图2、表1)亦显示,模型组海马内Aβ1-40和APP的蛋白灰度值与对照组比较明显增加,治疗组海马内Aβ1-40和APP的蛋白灰度值与模型组比较显著降低(均P<0.01),治疗组与对照组比较差异无统计学意义(P>0.05)。
2.2各组海马内NGF、pro-NGF、NGF/pro-NGF、p-TrkA、p-c-Raf、p-ERK1/2、p-CREB的相对表达比较 模型组海马内NGF和pro-NGF蛋白灰度值与对照组比较明显降低,治疗组海马内NGF和pro-NGF的蛋白灰度值与模型组比较增加(均P<0.05)(图3、表2);与对照组比较,模 型组NGF/pro-NGF比率降低(P<0.05)(表2),治疗组与模型组比较NGF/pro-NGF的比率明显上调(P<0.01);治疗组与对照组比较上述指标差异均无差异无统计学意义(P>0.05,表2)。 模型组小鼠海马内p-TrkA、p-c-Raf、p-ERK1/2、p-CREB相对灰度值与对照组比较明显降低,治疗组小鼠海马内的上述蛋白相对灰度值显著高于模型组(均P<0.05),治疗组与对照组比较上述指标差异均无差异无统计学意义(P>0.05,图4、表3)。
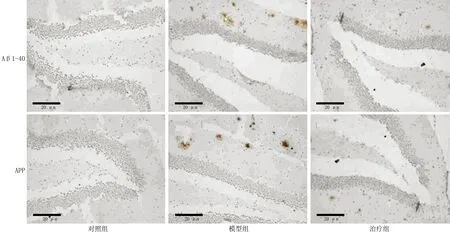
图1各组小鼠脑组织海马中Aβ1-40和APP表达比较(免疫组织化学)染色

表 1 两种方法检测各组小鼠海马内Aβ1-40及APP表达比较
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01

图2各组小鼠海马中Aβ1-40和APP蛋白表达比较(Western blot)

图3各组小鼠海马中NGF及pro-NGF表达比较(Western blot)

表 2 各组小鼠海马内NGF、pro-NGF、NGF/pro-NGF
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05

图4各组小鼠海马中p-TrkA、c-Raf、p-ERK1/2、p-CREB的蛋白表达比较(Western blot)

表 3 各组小鼠海马内p-TrkA、p-c-Raf、p-ERK1/2、p-CREB相对表达比较
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
3讨论
NGF作为一种神经营养因子,具有支持神经细胞发育、分化、维持和生存等生物学效应,NGF可通过与TrkA特异性结合,激活其下游信号通路发挥促进细胞增殖和存活作用,同时TrkA信号通路的激活还可阻抑p75NTR信号通路介导的细胞凋亡。proNGF作为脑内合成NGF的前体蛋白,在蛋白酶作用下被降解为NGF,其生物学效应与NGF相反,即与p75NTR发生特异性结合,激活p75NTR信号通路,介导神经细胞丢失和凋亡,并同时可抑制TrkA信号通路的激活,抑制细胞增殖和存活[4]。已有文献报道AD脑组织中NGF水平降低是导致神经元发生退行性变的机制之一。当脑内NGF匮乏时,NGF/TrkA信号通路受到抑制,从而影响其下游信号通路的活化和与学习记忆相关的下游效应蛋白的表达,最终导致神经元退化及Aβ沉积、学习记忆障碍[5]。此外,Autio等[6]发现TrkA磷酸化水平决定了CREB的磷酸化水平。Matrone等[7]研究发现NGF可诱导APP磷酸化,并与TrkA相互作用,调节NGF/TrkA信号通路的激活,从而调节细胞分化和生存,这表明NGF本身也与APP及Aβ的沉积也密切相关。因此,开发能够改善AD患者脑内NGF低表达水平并可以激活TrkA及其下游信号通路的功能,进而有效改善AD症状的新药,并对其进行相关机制的探讨,对于深入研究AD具有较大的意义。
EGCG是绿茶的一种主要多酚成分,具有抗氧化应激、抗炎和抗癌等作用[8]。已有报道EGCG在体外对3-羟基犬尿氨酸(3-Hydroxykynurenine,3-HK)诱导的人神经母细胞瘤SH-SY5Y细胞,转染瑞典型人类APP基因突变的啮齿类神经元样N2a细胞,APP过表达TgAPPsw2576单转基因小鼠原代神经细胞,以及对D-半乳糖诱导的AD小鼠、TgAPPswline 2576单转基因小鼠、PS2单转基因小鼠具有神经保护作用。
本研究发现,治疗组小鼠海马内APP和Aβ1-40蛋白表达水平与模型组比较明显下降,另外,模型组与对照组比较NGF及proNGF的蛋白表达水平皆下降,但proNGF相对表达降低程度不及NGF降低明显(即NGF/pro-NGF比值增高),表明APP/PS1双转基因小鼠脑内的NGF功能应以proNGF介导的生物学效应为主,提示EGCG可能通过增加NGF相对表达,激活其下游功能性受体TrkA进而发挥神经保护作用。而且,治疗组小鼠脑内p-TrkA及其下游p-c-Raf、p-ERK1/2和p-CREB等蛋白的表达水平显著高于模型组,并且EGCG使p-CREB表达水平的增加与抑制Aβ1-40和APP的沉积及改善APP/PS1双转基因小鼠的学习记忆功能障碍也存在密切关系。有研究证实,CREB蛋白的磷酸化和激活,也可阻断Aβ的寡聚化和形成,降低APP加工过程中的γ-分泌酶的mRNA及蛋白表达,从而减少Aβ形成,缓解APP/PS1双转基因小鼠的长时程增强缺陷,增加突触可塑性[9]。
综上所述,EGCG可能主要通过上调NGF的相对表达水平,激活NGF-TrkA通路及其下游ERK通路,从而在APP/PS1双转基因小鼠中降低Aβ沉积,发挥神经保护作用。
参考文献:
[1]Walsh DM, Selkoe DJ. A beta oligomers-a decade of discovery[J].JNeurochem,2007,101(5):1172-1184.
[2]Pimplikar SW, Nixon RA, RobakisNK,et al. Amyloid-independent mechanisms in Alzheimer’s disease pathogenesis[J]. J Neurosci, 2010,30(45):14946-14954.
[3]杨时伦, 刘明妍, 钟欣, 等. EGCG通过抑制p75NTR通路对APP/PS1小鼠学习记忆障碍的改善作用[J]. 中国药理学通报, 2014,30(10):1419-1424.
[4]Fortress AM, Buhusi M, Helke KL,et al.Cholinergic degeneration and alterations in the TrkA and p75NTR balance as a result of pro-NGF injection into aged rats[J].J Aging Res,2011,2011:460543.
[5]Matrone C, Barbagallo AP, La Rosa LR,et al.APP is phosphorylated by TrkA and regulates NGF/TrkA signaling[J]. J Neurosci, 2011,31(33):11756-11761.
[6]Autio H, Mätlik K,Rantamäki T,et al.Acetylcholinesterase inhibitors rapidly activate Trkneurotrophin receptors in the mouse hippocampus[J]. Neuropharmacology,2011,61(8):1291-1296.
[7]Lee JW, Lee YK, Ban JO, et al.Green tea (-)-epigallocatechin-3-gallate inhibits beta-amyloid-induced cognitive dysfunction through modification of secretase activity via inhibition of ERK and NF-kappaB pathways in mice[J].J Nutr, 2009,139(10):1987-1993.
[8]Singh BN, Shankar S, Srivastava RK.Green tea catechin, epigallocatechin-3-gallate (EGCG): mechanisms, perspectives and clinical applications[J]. Biochem Pharmacol,2011,82(12):1807-1821.
[9]Saura CA, Valero J. The role of CREB signaling in Alzheimer’s disease and other cognitive disorders[J]. Rev Neurosci, 2011,22(2):153-169.
(本文编辑:邹晨双)
Effects on Aβ depositionin in brains ofAPP/PS1 transgenic mice by EGCG through NGF/Trk Asignaling pathway
ZHONGXin,LIUMingyan,YAOWeifan,DUKe,YANGShilun,ZHAOHaishan,WEIMinjie*.
*DepartmentofPharmacology,CollegeofPharmacy,ChinaMedicalUniversity,ShenyangLiaoning110001,China
ABSTRACT:ObjectiveTo discuss the effects of (-)-epigallocatechin-3-gallate(EGCG) in green tea on Aβ deposition in brains of Amyloid precursor protein / presenilin-1 gene(APP/PS1) transgenic mice and the related nerve growth factor(NGF)/tyrosine kinase A(TrkA) signaling pathway in the hippocampus. MethodsImmunohistochemistry and Western blot methods were used to detect the levels of Aβ1-40 and APP in the hippocampus of APP/PS1 transgenic mice. The expressions of NGF and pro-NGF in the hippocampus were detected by Western blot, as well as the expression levels of its receptor TrkA and the downstream of the extracellular signal-regulated kinase(ERK) pathway. ResultsImmunohistochemical detection showed that the expressions of Aβ1-40 and APP of the model group(42.35±8.25,143.63±24.30) increased compared with the control group(13.04±4.36,19.89±4.93, P<0.05, respectively), while the expression levels of the treatment group(19.72±6.55,38.07±18.19) were far lower than the model group(P<0.05, respectively). Western blot results showed that compared with the control group(100, respectively), the relative expressions of Aβ1-40 and APP of the model group increased(363.39±45.77,499.51±65.75, P<0.01, respectively) and NGF(16.39±4.03), pro-NGF(25.92±5.37), NGF/pro-NGF(63.64±10.68), p-TrkA(7.92±2.13), p-c-raf(7.37±2.66), p-ERK1/2(13.53±4.44) and p-CREB(3.95±1.56) decreased(P<0.05, respectively). The relative expression levels of Aβ1-40 and APP of the treatment group179.77±18.17,160.42±44.55, P<0.01, respectively) were much lower than the model group, while the relative expression levels of NGF(80.78±12.18), pro-NGF(48.63±3.83), NGF/pro-NGF(165.84±19.02), p-TrkA(72.33±6.21), p-c-raf(88.12±5.33), p-ERK1/2(60.21±10.34) and p-CREB(25.31±8.48) of the treatment group were significantly higher than the model group(P<0.05, respectively). There were no significant differences between the treatment group and the control group(P>0.05, respectively). ConclusionsEGCG could reduce Aβ1-40 and APP expression levels in brains of the APP/PS1 transgenic mice by enhancing the relative expression level of NGF as well as increasing the NGF/proNGF ratio in the APP/PS1 mice. Moreover, after EGCG treatment, TrkA signaling was activated by significantly increasing the phosphorylation of TrkA c-Raf, ERK1/2 and downstream effector CREB, thereby the Aβ1-40 and APP expressions are inhibited, learning and memory disorders are improved, and EGCG finally plays a neuroprotective effect.
Key words:(-)-epigallocatechin-3-gallate; nerve growth factor;TrkA;APP/PS1 transgenic mouse;β-amyloid protein
doi:10.3969/j.issn.1006-2963.2016.02.006
基金项目:国家科技部“重大新药创制”科技重大专项子课题(2013ZX09103001-003);辽宁省教育厅科学研究一般项目(L2012279);辽宁省科学技术计划项目(2013225079)
通讯作者:魏敏杰,Email:mjwei@mail.cmu.edu.cn
中图分类号:R741.02
文献标识码:A
文章编号:1006-2963 (2016)02-0104-05
Corresponding author:WEI Minjie, Email:mjwei@mail.cmu.edu.cn
(收稿日期:2014-06-30)

