联合基因沉默TLR2、4对于LPA诱导的RASMCs表型转化的影响*
李小好,杨 波,姜 丹,周志斌△
(1.武汉科技大学附属天佑医院急诊科,武汉 430064 2.武汉工程大学校医院,武汉 430074;3.湖北省中山医院心内科,武汉 430030;4.武汉科技大学附属天佑医院神经内科,武汉 430064)
联合基因沉默TLR2、4对于LPA诱导的RASMCs表型转化的影响*
李小好1,2,杨波3,姜丹4,周志斌4△
(1.武汉科技大学附属天佑医院急诊科,武汉 430064 2.武汉工程大学校医院,武汉 430074;3.湖北省中山医院心内科,武汉 430030;4.武汉科技大学附属天佑医院神经内科,武汉 430064)
[摘要]目的应用RNA干扰技术单一或者联合沉默Toll样受体(TLR)2、4基因,探讨其在溶血磷脂酸(LPA)诱导的平滑肌细胞(VSMCs)表型转化中的作用。方法根据文献建立分化表型大鼠VSMCs(RASMCs)培养体系,予TLR2、4特异性小干扰RNA(siRNA)转染RASMCs,LPA 1 μmol/L处理4 h后,荧光定量RT-PCR法、Western blot法检测分化和去分化细胞表型标志基因平滑肌肌动蛋白(SMA-α)和骨桥蛋白(OPN)基因及蛋白水平的表达。结果TLR2、4-siRNA分别转染细胞后可显著抑制LPA诱导的RASMCs细胞SMA-α基因、蛋白下调及OPN基因、蛋白上调,TLR2、4联合干扰组对于LPA诱导的RASMCs细胞SMA-α基因、蛋白下调及OPN基因、蛋白上调的抑制作用较TLR2、4单独干扰组进一步加强。结论TLR2、4信号通路参与了LPA诱导的表型转化,联合干预TLR2、4,有可能成为稳定动脉粥样硬化斑块、抗粥样硬化治疗的一个新途径之一。
[关键词]Toll样受体;RNA干扰;溶血磷脂素类;血管;肌细胞,平滑肌;表型转化
Toll样受体(toll-1ike receptors,TLRs)是一个模式识别受体家族,其可以识别多种病原相关分子模式,是天然免疫和获得性免疫系统中非常关键的受体,其可调节、控制天然免疫向后天免疫的转变,被认为是联系二者之间的桥梁[1-2]。大量研究证明,TLR 信号通路在动脉粥样硬化进程中起着重要的作用,TLR与相应配体结合后,通过系列级联反应激活核因子-κB((nuclear factor -kappaB,NF-κB),启动受NF-κB 调控的炎性因子转录[3],参与动脉粥样硬化炎症反应。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)表型转化可导致血管重构,最终导致血管再狭窄和动脉粥样硬化等血管疾病。TLRs的重要内源性配体氧化脂蛋白的主要活性成份——溶血磷脂酸(lysophosphatidic acid,LPA)是血清中导致VSMCs表型转换的惟一成份[4]。本研究应用RNA干扰技术分别或联合沉默TLR2、4基因后,予LPA刺激体外培养的大鼠VSMCs(RASMCs),观察TLR2、4在LPA诱导的RASMCs表型转化中的作用,进一步探讨LPA致动脉粥样硬化相关信号传导途径。
1材料与方法
1.1材料健康SD大鼠5只,体质量150~200 g,雌雄不限,10~12周龄,购自北京维通利华验动物技术有限公司。18∶1溶血磷脂酸(1-oleoyl-sn-glycero-3-phosphate,18∶1 LPA)。LPA溶解于包含不含脂肪酸的0.1%牛血清蛋白(bovine serum albumin,BSA)磷酸盐缓冲液(phosphate buffered saline,PBS)中。胰岛素样生长因子-1(Insulin-like growth factor 1,IGF-1)购自Lab Vision Corporation。层粘连蛋白购自BD discovery labware。Trizol Reagent,(Invitrogen) Taq RevertAidTMH Minus First Strand cDNA Synthesis Kit (Fermentas) Deoxyribonuclease I (DNase I)(Fermentas)RiboLockTMRibonuclease Inhibitor,(Fermentas),SYBR Green PCR Master Mix(ABI),Lipofectamine®2000 (Invitrogen),Opti-MEM®Ⅰ低血清培养基(GIBCO )。
1.2方法
1.2.1细胞培养及干预试验根据文献[4]方法,取SD大鼠胸主动脉VSMCs,进行分化型血管VSMCs的原代培养,将TLR2、4特异性siRNA分别或联合转染RASMCs,LPA 1 μmol/L处理4 h,检测平滑肌肌动蛋白(smooth muscle actin,SMA-α)和骨桥蛋白(osteopontin,OPN)基因、蛋白的表达。
1.2.2荧光定量RT-PCRTrizol法提取各组细胞总RNA。行实时定量PCR扩增,以β-actin为内参,反应体系为:cDNA 1.0 μL、2×SYBR Green PCR Master mix 12.5 μL、上下游引物各100 nm、ddH2O补足至25.0 μL。扩增的反应条件:95 ℃预变性5 min,94 ℃变性20 s,56 ℃退火20 s,72 ℃延伸20 s,72 ℃再延伸5 min,55 ℃退火10 s,共40个循环。循环结束后进行融点曲线分析,于60~95 ℃进行测定,(升温幅度:每次0.5 ℃,每次5 s)。引物序列如下:TLR2上游5′-TGC TAT GAC GCT TTC GTG TC-3′,下游5′-TTC TCG GAA AGC ACG AAG AT-3′; TLR上游5′-ACA TCA AAT GCC CCT ACT CA-3′,下游5′-CTA AAC CAG CCA GAC CTT GA-3′;β-actin上游5′-CAT TAA GGA GAA GCT GTG CT-3′,下游5′-GTT GAA GGT AGT TTC GTG GA-3′;SMA-α上游5′- GCA TCC ACG AAA CCA CCT A-3′,下游:5′-CGC CGA TCC AGA CAG AAT A-3′;OPN 上游 5′-GCT GAA GCC TGA CCC ATC T-3′,下游 5′- GGT CTT CCC GTT GCT GTC-3′。反应结束后,根据Ct值通过公式2-ΔΔCt分析计算各目的基因相对表达量。
1.2.3Western blot检测收集RASMC,各组细胞蛋白抽提,BCA法定量。取蛋白样品10 μg 行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)转膜,脱脂奶粉封闭,然后分别与小鼠抗SMA-α、OPN(1∶300,Santa Cruz)室温反应2 h,洗膜3次,随后加入辣根过氧化物酶标记山羊抗鼠二抗(1∶80 000,Santa Cruz)室温反应2 h,于4-氯-1-萘酚,H2O2溶液中显色,显示蛋白条带。Gelpro4 版凝胶光密度分析软件分析阳性条带,测其IOD值,然后用其表达量与对应的GAPDH表达量的比值进行比较分析。
1.2.4干涉片段的设计针对TLR2、4的序列,设计干涉序列和阴性对照序列,TLR2正义和反义链序列如下:TLR2-siRNA-1正义链5′-CAA AGA GUC UGA GGU CAA UUC AGA A-3′,反义链5′-UUC UGA AUU GAC CUC AGA CUC UUU G-3′;TLR2-siRNA-2正义链5′-UGG ACA CAA UUA AAU CCC UCG GUA A-3′,反义链5′-UUA CCG AGG GAU UUA AUU GUG UCC A-3′;TLR2-siRNA-3正义链5′-CCU GUU CCC UUU CAC AGC AUU UAA A-3′,反义链5′-UUU AAA UGC UGU GAA AGG GAA CAG G-3′。TLR4正义和反义链序列如下:TLR4-siRNA-1 正义链5′-UCU AGA GCA CUU GGA CCT TTT-3′,反义链5′-TTA GAU CUC GUG AAC CUG GUU-3′;TLR4-siRNA-2正义链5′-GUU GAU CUA CCA AGC CUU GTT-3′,反义链5′-TTC AAC UAG AUG GUU CGG AAC-3′;TLR4-siRNA-3正义5′-CGA AUG GAA UGU GCA ACA CTT-3′,反义链5′-TTG CUU ACC UUA CAC GUU GUG-3′。阴性对照:siRNA正义链5′-UUC UCC GAA CGU GUC ACG UTT-3′,反义链5′-ACG UGA CAC GUU CGG AGA ATT-3′。
1.2.5RNA干扰转染前1 d,将RASMC细胞以1×105密度接种于6孔板上过夜,培养基为2 mL含FBS的基础培养基。第2天细胞达到70%融合后,培养基更换为无血清、无抗生素培养液,准备转染。 RASMC分为空白对照组(未转染组),阴性对照组(转染阴性siRNA)及转染阳性siRNA组。转染方法参照Lipofectamine2000说明书,细胞转染后24 h在荧光显微镜下观察转染效率,并进行荧光定量RT-PCR检测,以确定最佳干预片段。
1.2.6VSMCs表型判断选取SMA-α和OPN分别作为分化和去分化VSMC表型标志基因[4-5]。SMA-α在分化表型VSMC表达升高,在去分化表型VSMC则降低,OPN则与之相反。
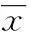
2结果
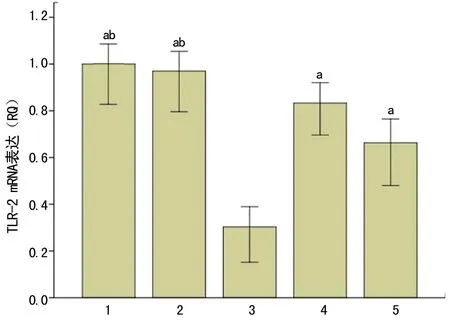
2.1最佳siRNA序列的筛选荧光定量RT-PCR法检测转染前、后细胞中TLR2、4 mRNA的表达,结果显示RASMCs表达TLR2、4 mRNA。转染TLR2-siRNA-1、TLR2-siRNA-3细胞组中TLR2 mRNA表达水平均显著低于空白对照组和阴性对照组(P<0.05);转染TLR2-siRNA-2细胞组中TLR2 mRNA表达水平与空白对照组和阴性对照组比较,差异无统计学意义(P>0.05)。各组细胞中,转染TLR2-siRNA-1的细胞组TLR2 mRNA的表达最低,空白对照组和阴性对照组比较差异无统计学意义(P>0.05) ,见图1。转染TLR4-siRNA-1、TLR4-siRNA-2和TLR4-siRNA-3的3组细胞中TLR4 mRNA表达水平均显著低于空白对照组和阴性对照组(P<0.05),且以转染TLR4-siRNA-2的细胞组TLR4 mRNA的表达最低,空白对照组和阴性对照组比较差异无统计学意义(P>0.05),见图2。上述结果证实了TLR2、4 siRNA分子对TLR2、4基因抑制作用的特异性,并排除了转染试剂的作用。因此,将TLR2-siRNA-1、TLR4-siRNA-2用于后续相关实验研究。
1:空白对照组;2:阴性对照组;3:转染TLR2-siRNA-1组;4:转染TLR2-siRNA-2组;5:转染TLR2-siRNA-3组。a:P<0.01,与转染TLR2-siRNA-1组比较;b:P<0.01与转染TCR2-siRNA-3组比较。
图1转染TLR2-siRNA对TLR2 mRNA表达的影响(n=3)
1:空白对照组;2:阴性对照组;3:转染TLR2-siRNA-1组;4:转染TLR2-siRNA-2组;5:转染TLR2-siRNA-3组。a:P<0.01,与空白及阴性对照组比较。
图2转染TLR4-siRNA对TLR4mRNA表达的影响(n=3)
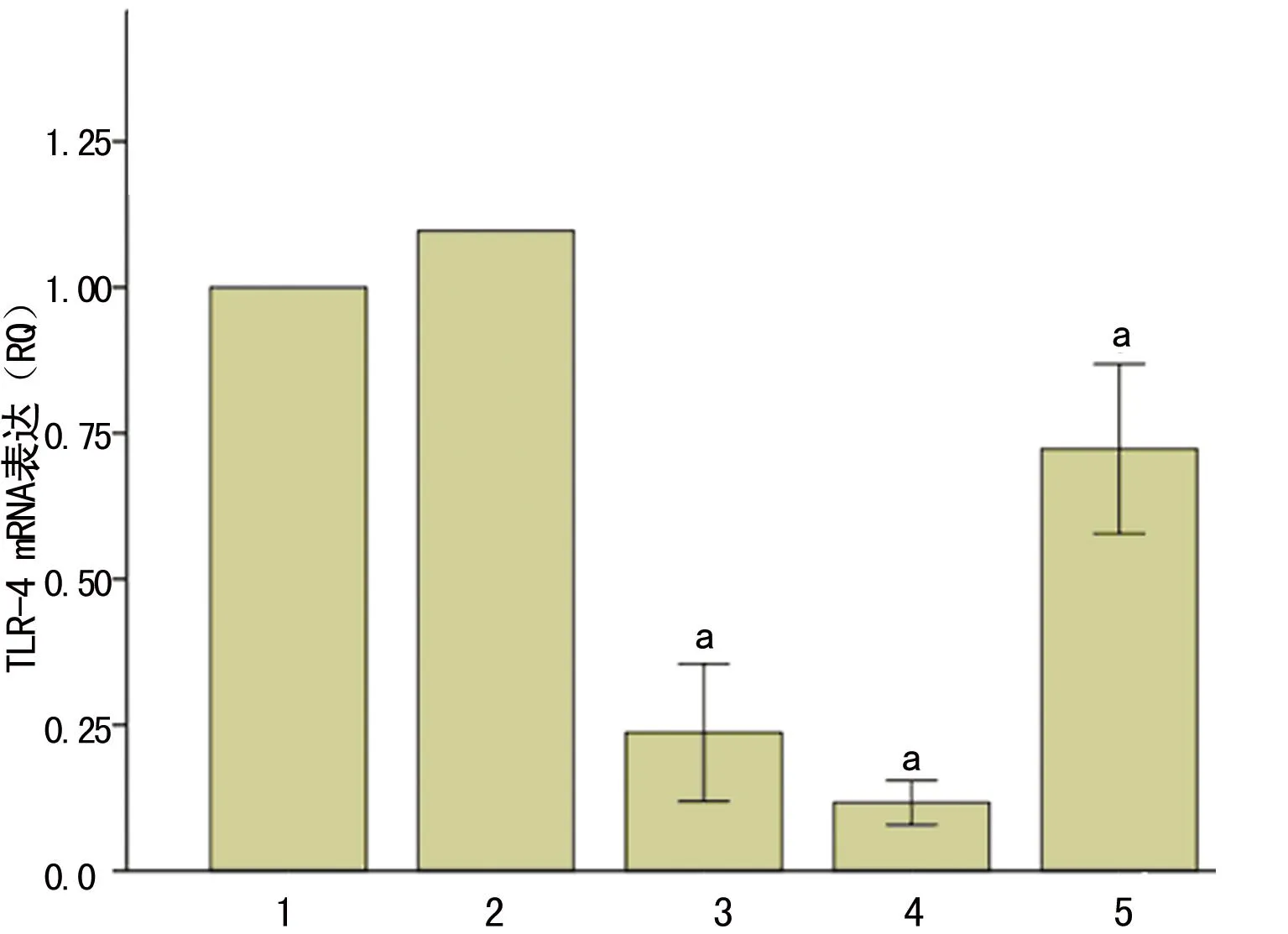
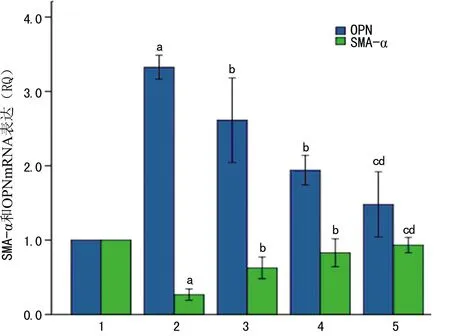
2.2TLR2-siRNA-1、TLR4-siRNA-2转染细胞后对LPA诱导的RASMCs细胞表型转化的影响原代培养的分化表型VSMC予LPA-1 μmol/L处理4 h后,显著下调SMA-α基因、蛋白的表达,并同时上调OPN基因、蛋白表达,TLR2-siRNA-1、TLR4-siRNA-2分别转染细胞后均可抑制LPA诱导的RASMCs细胞SMA-α基因、蛋白下调及OPN基因、蛋白上调,TLR2、4联合干扰组对于LPA诱导的RASMCs细胞SMA-α基因、蛋白下调及OPN基因、蛋白上调的抑制作用较TLR2、4单独干扰组进一步加强,见图3、4。
1:分化表型细胞组;2:LPA干预组;3:TLR2干扰组;4:TLR4干扰组;5:TLR2、4联合干扰组;a:P<0.01,与分化表型细胞组比较;b:P<0.01与LPA干预组比较;c:P<0.01,与TLR2干扰组比较;d:P<0.05,与TLR4干扰组比较。
图3TLR2、4干扰对LPA诱导的RASMCs表型
转化标志基因mRNA的影响(n=3)

1:分化表型细胞组;2:LPA干预组;3:TLR2干扰组;4:TLR4干扰组;5:TLR2、4联合干扰组;a:P<0.01,与分化表型细胞组比较;b:P<0.01,与LPA干预组;c:P<0.01,与TLR2干扰组比较;d:P<0.05,与TLR4干扰组比较;e:P<0.01,与TLR2、4干扰组比较。
图4TLR2、4干扰对LPA诱导的RASMCs表型转化
标志基因、蛋白水平的影响(n=3)
3讨论
血管疾病中VSMC的改变可以认为是其分化状态的改变,LPA则是低密度脂蛋白致血管内皮病变的活性成分[6],体内LPA主要来源于对损伤和炎症刺激应答所致激活的血小板、受损的细胞及生长因子刺激的细胞[7]。体外及活体实验均充分证明不饱和LPA可以诱导VSMC表型转化,刺激VSMC迁移和增殖[8],本课题前期研究表明LPA以剂量依赖的方式促进RASMCs表型转化[9],但LPA诱导RASMCs表型转化信号通路尚需进一步阐明。
多项研究证实,迄今发现的12种TLRs中,主要是TLR2和TLR4信号通路参与了动脉粥样硬化病理、生理过程[10-11]。参与动脉粥样硬化的巨噬细胞、树突状细胞、内皮细胞和血管平滑肌细胞均表达TLR2、4,某些T淋巴细胞表达TLR2[12]。在低密度脂蛋白受体缺失(LDLR-/-)和载脂蛋白E缺失(ApoE-/-)小鼠粥样硬化模型中,TLR2、4在粥样硬化斑块的表达均增高。TLR4或TLR2缺失的ApoE-/-小鼠粥样硬化损伤面积较正常小鼠粥样硬化模型比,显著下降[13-14],Cao等[15]对TLR4和ApoE双基因敲除小鼠高胆固醇喂养6个月后,发现小鼠主动脉窦处的巨噬细胞浸润程度较ApoE基因敲除小鼠降低了65%,斑块面积减少了55%;而TLR的下游基因MyD88与ApoE双基因敲除小鼠的巨噬细胞浸润程度较对照组降低了75%,斑块面积减少了60%。
本研究应用RNA干扰技术分别沉默TLR2、4基因后,发现LPA诱导的RASMCs细胞SMA-α基因、蛋白下调及OPN基因、蛋白上调均可被显著抑制,表明TLR2、4信号通路均参与了LPA诱导的平滑肌细胞表型转化,并且联合干扰TLR2、4对于LPA诱导的RASMCs细胞SMA-α基因、蛋白下调及OPN基因、蛋白上调的抑制作用较TLR2、4单独干扰组进一步加强。联合干扰TLR2、4对于LPA诱导的RASMCs表型转化具有更强的抑制作用,二者具有协同作用。
综上所述,TLR信号通路主要是TLR2、4参与了LPA诱导的表型转化,联合干预TLR2、4,抑制信号通路后的炎症反应及免疫反应,有可能成为稳定动脉粥样硬化斑块、抗粥样硬化治疗的一个新途径之一。
参考文献
[1]Kawai T,Akira S.Toll-like receptors and their crosstalk with other innate receptors in infection and immunity[J].Immunity,2011,34(5):637-650.
[2]Lin YT,Verma A,Hodgkinson CP.Toll-like receptors and human disease:lessons from single nucleotide polymorphisms[J].Curr Genomics,2012,13(8):633-645.
[3]Raveendran VV,Tan X,Sweeney ME,et al.Lipopolysaccharide induces H1 receptor expression and enhances histamine responsiveness in human coronary artery endothelial cells[J].Immunology,2011,132(4):578-588.
[4]Hayashi K,Takahashi M,Nishida W,et al.Phenotypic modulation of vascular smooth muscle cells induced by unsaturated lysophosphatidic acids[J].Circ Res,2001,89(3):251-258.
[5]Shanahan CM,Weissberg PL,Metcalfe JC.Isolation of gene markers of differentiated and proliferating vascular smooth muscle cells[J].Circ Res,1993,73(1):193-204.
[6]牛建平,周志斌,宋叶华,等.溶血磷脂酸对人单核细胞株THP-1细胞核因子-κB表达的影响[J/OL].中华脑血管病杂志:电子版,2013,7(5)236-242.
[7]CuiMZ.Lysophosphatidicacideffects
on atherosclerosis and thrombosis[J].Clin Lipidol,2011,6(4):413-442.
[8]Schober A,Siess W.Lysophosphatidic acid in atherosclerotic diseases[J].Br J Pharmacol,2012,167(3):465-482.
[9]李小好,杨波,尚桂莲,等.溶血磷脂酸受体3介导溶血磷脂酸诱导的平滑肌细胞表型转化[J].中华老年心脑血管病杂志,2012,14(10):1082-1086.
[10]Hodgkinson CP,Ye S.Toll-like receptors,their ligands,and atherosclerosis[J].Sci World J,2011,14(11):437-453.
[11]Lundberg AM,Yan ZQ.Innate immune recognition receptors and damage-associated molecular patterns in plaque inflammation[J].Curr Opin Lipidol,2011,22(5):343-349.
[12]Falck-Hansen M,Kassiteridi C,Monaco C.Toll-like receptors in atherosclerosis[J].Int J Mol Sci,2013,14(7):14008-14023.
[13]Mullick AE,Soldau K,Kiosses WB,et al.Increased endothelial expression of Toll-like receptor 2 at sites of disturbed blood flow exacerbates early atherogenic events[J].J Exp Med,2008,205(2):373-383.
[14]Michelsen KS,Wong MH,Shah PK,et al.Lack of Toll like receptor 4 or myeloid differentiation factor 88 reduces atherosclerosis and alters plaque phenotype in mice deficient in apolipoprotein E[J].Proc Natl Acad Sci U S A,2004,101(29):10679-10684.
[15]Cao F,Castrillo A,Tontonoz P,et al.Chlamydia pneumoniae--induced macrophage foam cell formation is mediated by Toll-like receptor 2[J].Infect Immun,2007,75(2):753-759.
Effects of joint gene silence of TLR2 and TLR4 on LPA induced phenotypic modulation of RASMCs﹡
LiXiaohao1,2,YangBo3,JiangDan4,ZhouZhibin4△
(1.DepartmentofEmergency,AffiliatedTianyouHospital,WuhanUniversityofScienceandTechnology,Wuhan,Hubei430064China;2.HospitalofWuhanInstituteofTechnology,Wuhan,Hubei430074,China;3.DepartmentofCardiology,HubeiProvincialZhongshanHospital,Wuhan,Hubei430030,China;4.DepartmentofNeurology,AffiliatedTianyouHospital,WuhanUniversityofScienceandTechnology,Wuhan,Hubei430064,China)
[Abstract]ObjectiveTo apply the RNA interference technology to singly or jointly to silence toll-like receptor(TLR)-2,4 genes and to investigate their effects on lysophosphatidic acid(LPA) induced phenotypic modulation of vascular smooth muscle cells(VSMCs).MethodsThe culture system of rat aortic smooth muscle cells (RASMCs) in differentiated phenotype rats was established according to the literature.Then TLR-2 and TLR 4 specially small interference RNA(TLR2-siRNA,TLR4-siRNA) were tranfected into RASMCs.After the treatment by 1 μmol/L of LPA for 4 h,the gene and protein levels of SMA-α and OPN as the marker genes for VSMC differentiated and dedifferentiated phenotype were detected by real-time quantitative RT-PCR and Western blot respectively.ResultsTLR2-siRNA and TLR4-siRNA transfection could significantly inhibit the down-regulation of SMA-α gene and protein,and the up-regulation of OPN gene and protein in LPA induced RASMCs,the inhibiting effect of the joint interference of TLR2 and TLR4 on the down-regulation of SMA-α gene and protein,and the up-regulation of OPN gene and protein in LPA induced RASMCs was further strengthened than the single interference of TLR2 and TLR 4.ConclusionThe TLR2 and TLR4 signal pathway participates in the LPA-stimulated phenotypic modulation of RASMCs.The joint intervention on TLR2 and TLR4 might become one of new pathway for stabilizing atherosclerotic plaque and anti-atherosclerotic therapy.
[Key words]toll-like receptors;RNA interference;lysophospholipids;blood vessels;myocytes,smooth muscle;phenotypic modulation
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.04.006
基金项目:湖北省卫生厅科研指导性项目(JX6C-19);湖北省教育厅科学技术研究计划优秀中青年人才项目(Q20121117)。
作者简介:李小好(1977-),副主任医师,大学本科,主要从事急诊医学研究。△通讯作者,Tel:13329732347;E-mail:zhouzhibin74@163.com。
[中图分类号]R34
[文献标识码]A
[文章编号]1671-8348(2016)04-0448-03
(收稿日期:2015-08-05修回日期:2015-10-13)

