肠杆菌科细菌SDD菌株特征及替加环素药敏结果分析*
邹自英,刘 媛,曾 平,胡宗海,朱 冰,吴丽娟
(成都军区总医院检验科,四川成都 610083)
肠杆菌科细菌SDD菌株特征及替加环素药敏结果分析*
邹自英,刘媛#,曾平,胡宗海,朱冰,吴丽娟△
(成都军区总医院检验科,四川成都 610083)
[摘要]目的分析医院肠杆菌科细菌剂量依赖性敏感(SDD)菌株的药物敏感性情况和检出分布特征,并检测产超广谱β内酰胺酶(ESBLs)大肠埃希菌和肺炎克雷伯菌对替加环素的敏感性,以指导临床对SDD菌株的抗菌药物及对ESBLs产酶株替加环素的选择。方法采用VITEK 2 COMPACT全自动微生物分析仪进行细菌鉴定及仪器法抗菌药物敏感性试验。对50株ESBLs阳性大肠埃希菌和50株肺炎克雷伯菌分别采用微量肉汤稀释法、MTS测试条法、Vitek2仪器检测法、纸片扩散法检测替加环素的敏感性。结果采用M100-S24标准头孢吡肟判断为敏感的肠杆菌科细菌有3.58%~12.50%的菌株为SDD菌株;ESBLs阳性大肠埃希菌和肺炎克雷伯菌的SDD菌株检出率分别为13.31%和 8.60%,显著高于ESBLs阴性菌株(P<0.05);所有肠杆菌科细菌SDD菌株最低抑菌浓度(MIC)4 mg/L菌株检出率显著高于SDD菌株MIC 8 mg/L菌株检出率(P<0.05);ESBLs阳性大肠埃希菌和肺炎克雷伯采用微量肉汤稀释法和MTS测试条法的敏感率均为100%。结论当肠杆菌科细菌头孢吡肟MIC 为4 mg/L或8 mg/L时,实验室应在检验报告提示SDD菌株的检出。替加环素对ESBLs阳性大肠埃希菌和肺炎克雷伯菌的敏感率为100%。
[关键词]头孢吡肟;剂量依赖性敏感菌株;替加环素;超广谱β内酰胺酶
2014年美国临床和实验室标准协会(CLSI)文件M100-S24首次对肠杆菌科细菌抗菌药物头孢吡肟引入了剂量依赖性敏感(susceptible-dose dependent,SDD)的概念,SDD概念的使用对于完善临床微生物药敏检验报告,避免临床将“中介”作为“耐药”的过渡进行处理,指导临床合理使用抗菌药物具有重要意义[1-2]。替加环素临床上多用于高耐药菌株引起的复杂性重症感染性疾病的治疗,如碳青酶烯耐药的肠杆菌科细菌、泛耐药的鲍曼不动杆菌、耐甲氧西林的金黄色葡萄球菌及耐万古霉素的肠球菌等引起的感染性疾病的治疗[3-5]。基于目前实验室商品化检测系统还未引入SDD概念,替加环素也未引入商品化肠杆菌科药敏检测卡,本研究通过分析2014年临床送检分离肠杆菌科细菌头孢吡肟SDD菌株的检出特征及产超广谱β内酰胺酶(extended β-lactamases,ESBLs)菌株的替加环素药物敏感情况,探讨实验室报告SDD菌株对临床抗菌药物选择的指导意义及替加环素对ESBLs产酶株的抗菌活性。
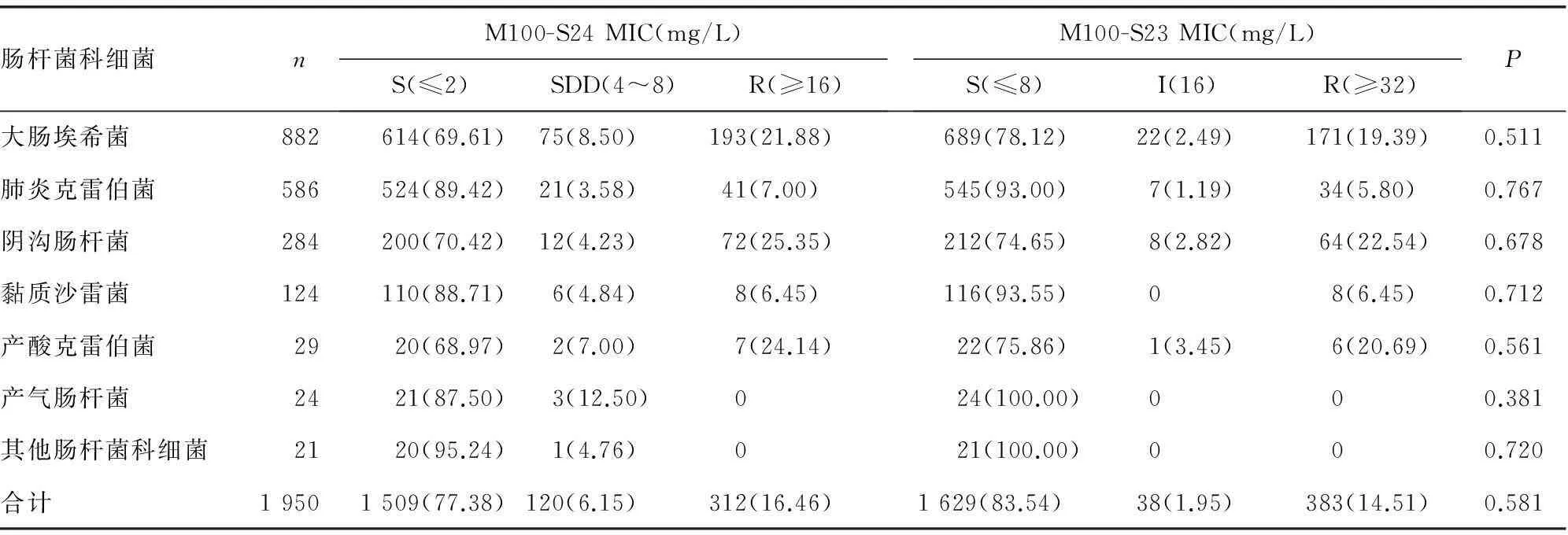
表1 肠杆菌科细菌M100-S24和M100-S23折点头孢吡肟药敏结果比较[n(%)]
P:S(≤2)与S(≤8)敏感率比较。
1材料与方法
1.1材料(1)菌株来源:收集2014年1~10月临床送检分离肠杆菌科菌株共1 950株,同一患者同一部位重复分离菌株只计首次分离菌株检测结果。标准菌株采用大肠埃希菌ATCC25922、霍氏肠杆菌ATCC 700323、肺炎克雷伯菌ATCC700603。(2)试剂与仪器: 替加环素药敏纸片购自Oxoid公司,替加环素MTS条购自意大利Liofilchem公司,替加环素干粉购自美国辉瑞公司。GN鉴定卡、GN-13和GN-16药敏检测卡及VITEK2 COMPACT全自动微生物分析仪为法国梅里埃公司产品。
1.2方法
1.2.1头孢吡肟最低抑菌浓度(minimum inhibitory concentration,MIC)检测方法采用法国梅里埃公司的VITEK 2 COMPACT仪器及AST-GN13药敏检测卡片检测菌株的头孢吡肟敏感性,菌株的鉴定采用GN卡进行鉴定。
1.2.2M100-S24和M100-S23肠杆菌科MIC折点变化M100-S24文件[1]规定肠杆菌科头孢吡肟:MIC≤2 mg/L敏感(S)、MIC 4~8 mg/L SDD、MIC≥16 mg/L耐药(R),取消中介(I)的概念。M100-S23文件规定[6]肠杆菌科头孢吡肟,S:MIC≤8 mg/L;Z:MIC 16 mg/L;R:MIC≥32 mg/L。
1.2.3替加环素药敏折点由于替加环素尚无CLSI推荐的药敏折点标准,本研究采用美国食品药品管理局(FDA)推荐的对肠杆菌科细菌的稀释法药敏折点标准:S≤2 μg/mL,I为4 μg/mL,R≥8 μg/mL;纸片扩散法药敏折点标准:S≥19 mm,I为15~18 mm,R≤14 mm。
1.2.4ESBLs确证试验AST-GN13药敏卡通过VITEK 2 COMPACT全自动微生物分析仪检测,提示ESBLs阳性的菌株按CLSI推荐的方法,将0.5麦氏单位菌液均匀涂布M-H平板,再将头孢噻肟(30 μg)和头孢噻肟/克拉维酸(30 μg/10 μg)、头孢他啶(30 μg)和头孢他啶/克拉维酸(30 μg/10 μg)粘贴在涂布菌液的M-H平板上,35 ℃培养18 h,测量抑菌圈直径,两对纸片或其中任何一对纸片的直径相差大于或等于5 mm,即为产ESBLs菌株。
1.3统计学处理LIS系统导出的DBF格式数据,采用WHONET5.6软件进行肠杆菌科细菌头孢吡肟敏感性分析。DBF格式数据转换为EXCELL格式数据,分别计数肠杆菌科细菌的MIC值分布范围,依据新旧CLSI标准分别计算头孢吡肟的敏感性状况。两组率的比较采用SPSS17.0软件进行χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1肠杆菌科细菌M100-S24和M100-S23折点头孢吡肟药敏结果比较采用M100-S23和M100-S24标准进行判断,所有肠杆菌科细菌对头孢吡肟的敏感率差异无统计学意义(P>0.05)。但采用M100-S24标准判断为敏感的菌株,有3.58%~12.50%的菌株为SDD菌株,见表1。
2.2ESBLs阳性与阴性菌株SDD菌株检出率比较大肠埃希菌共检出ESBLs阳性菌株511株(57.94%),其中SDD菌株68株;ESBLs阴性菌株371株(42.06%),其中SDD菌株7株。肺炎克雷伯菌共检出ESBLs阳性菌株 221株(37.71%),其中SDD菌株19株;ESBLs阴性菌株365株(62.29%),其中SDD菌株2株。大肠埃希菌和肺炎克雷伯菌的ESBLs阳性菌株SDD菌株检出率高于ESBLs阴性菌株(P<0.05),见表2。
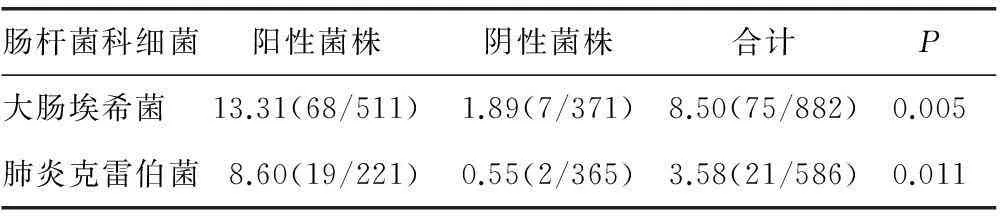
表2 ESBLs阳性与阴性菌株SDD菌株检出率
2.3SDD菌株MIC值分布肠杆菌科各细菌SDD菌株MIC主要分布在4 mg/L(77.50%),MIC 8 mg/L占22.50%,所有肠杆菌科细菌SDD菌株MIC 4 mg/L菌株检出率显著高于SDD菌株MIC 8 mg/L菌株检出率(P<0.05),见表3。
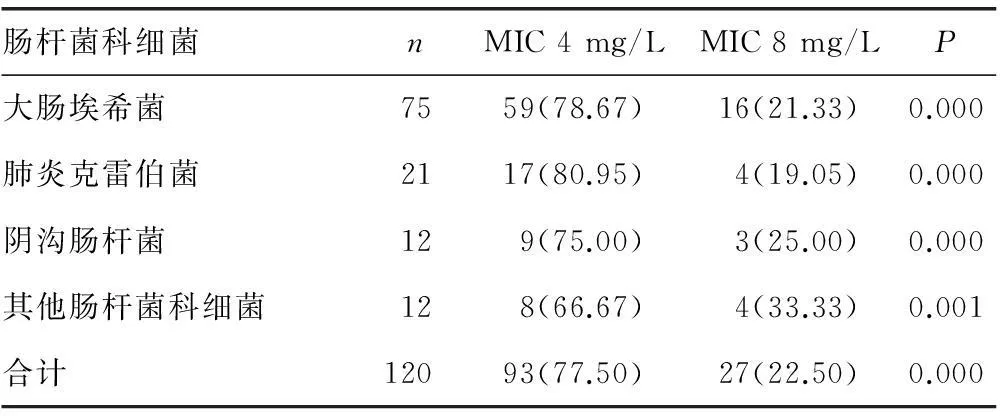
表3 SDD菌株MIC值分布[n(%)]
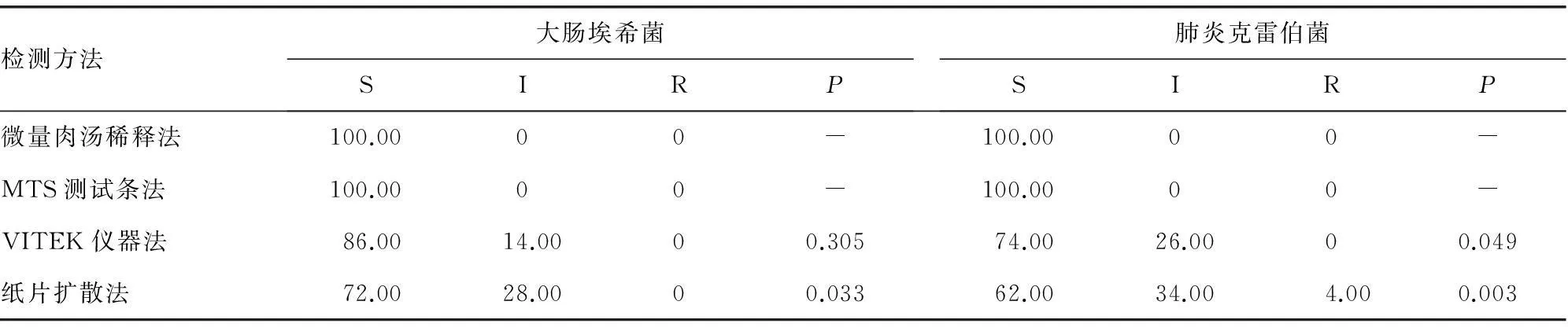
表4 不同检测方法的替加环素药敏检测结果(%)
P:与微量肉汤稀释法敏感率比较。
2.4ESBLs阳性菌株不同药敏检测方法替加环素药敏结果分析采用微量肉汤稀释法和MTS测试条法的敏感率均为100%,与微量肉汤稀释法比较,大肠埃希菌纸片扩散法的敏感率显著降低,肺炎克雷伯菌的VITEK仪器法和纸片扩散法敏感率显著降低,见表4。
3讨论
SDD是依赖于患者所用剂量的菌株敏感性,当菌株的MIC值或抑菌圈直径在SDD规定的范围时,临床应当提高抗菌药物的给药方案,才能达到预期的临床治疗效果。理解SDD的含义需要与 “中介”进行区分,后者指MIC接近血液和组织中通常可达到的浓度,疗效低于敏感菌株,表示药物在生理浓集的部位具有临床效力或可用高于正常剂量的药物进行治疗;另外,中介还可作为缓冲区,以防止微小的、未受控制的技术因素导致较大的错误结果,特别是毒性范围窄的药物[1]。药敏试验的中介已包括SDD的概念,CLSI M100-S24文件建议肠杆菌科头孢吡肟药敏试验MIC为4、8 mg/L时采用SDD替代中介,因为头孢吡肟有多种批准的剂量可供临床选择。
实验室普遍采用的商品化微生物分析系统受产品认证、更新等因素的影响,常无法及时采用最新的判断标准进行临床报告和解读。本研究采用M100-S24判断为敏感的肠杆菌科细菌有3.58%~12.50%的菌株为SDD菌株[6]。采用M100-S23标准把头孢吡肟MIC≤8 mg/L判断为敏感时,推荐的剂量方案是1 g/8 h或2 g/12 h。而采用M100-S24进行判断时,MIC≤2 mg/L为敏感,推荐剂量方案是1 g/12 h;MIC 为4 mg/L时,推荐剂量是1 g/8 h或2 g/12 h;MIC为8 mg/L时,推荐的剂量方案是2 g/8 h[1]。SDD概念的引入使得临床的用药方案更加详细和具体。可见,目前实验室使用的MIC≤8 mg/L敏感的标准没有专门考虑SDD菌株需要提高给药方案的问题,可能会导致临床治疗效果欠佳。而基于M100-S23或M100-S24进行报告发送,头孢吡肟的敏感率差异无统计学意义(P>0.05),即并不会影响临床医生判断是否可以选用头孢吡肟,但会影响临床用药方案的制订,从而影响治疗效果。
大肠埃希菌和肺炎克雷伯菌是临床最常检出的肠杆菌科细菌,产ESBLs是其常见的耐药机制之一[7-8]。产ESBLs菌株呈现对青霉素类、头孢菌素类、氟喹诺酮类等多种药物的耐药性[9-11]。本研究比较了ESBLs产酶株和非产酶株的SDD菌株检出率,发现ESBLs产酶株的SDD菌株检出率显著高于非产酶株,即临床在使用头孢吡肟治疗ESBLs产酶株时提高药物方案可能会取得较好的疗效。虽然CLSI文件指出检测ESBLs主要用于流行病学调查和医院感染控制的目的,实验室不用常规进行检测[12]。本研究的结果提示,产ESBLs的SDD菌株的头孢吡肟可能需要修改用药方案,所以实验室报告ESBLs及其注释可以给临床用药提供必要的参考信息。
肠杆菌科各细菌SDD菌株MIC主要分布在4 mg/L,MIC 4 mg/L菌株检出率显著高于MIC 8 mg/L菌株检出率。提示大部分SDD菌株采用1 g/8 h或2 g/12 h的剂量方案均可以取得较好的临床疗效,少部分SDD菌株需要采用2 g/8 h的更高剂量方案。实验室准确检测MIC值是非常重要的,若检测抑菌圈直径,则19~24 mm为SDD菌株,推荐采用2 g/8 h,因为抑菌圈直径还不能与MIC进行一对一的关联,只能视作8 mg/L处理[2]。而根据本研究的结果,SDD菌株大部分为MIC 4 mg/L,若检测抑菌圈直径则增加了用药风险。
替加环素适应证为复杂性腹腔感染,临床上用于多种细菌引起的各种重症感染的治疗[13-15],由于临床上常用于检测肠杆菌科的药敏检测卡不包含替加环素,文献报导替加环素的药敏结果受检测方法的局限[12]。本实验证实替加环素对本院ESBLs菌株的抗菌活性达到100%,但实验室如果采用非发酵菌药敏卡或纸片扩散法检测替加环素对肠杆菌科细菌的敏感性,中介和耐药菌株需要使用MTS测试条进行进一步确认,若临床确实有需要的患者可以采用微量肉汤法进行验证,以确保替加环素得到正确选用。
参考文献
[1]Clinical and Laboratory Standards Institute.M100-S24 Performance standards for antimicrobial susceptibility testing:twenty-second informational supplement[S].Wayne,PA:CLSI,2014.
[2]张雅薇,王辉.2014年CLSI M100-S24主要更新内容解读[J].中华检验医学杂志,2014,37(4):256-260.
[3]Viehman JA,Nguyen MH,Doi Y.Treatment options for carbapenem-resistant and extensively drug-resistant acinetobacter baumannii infections[J].Drugs,2014,74(12):1315-1333.
[4]Pascale GD,Montini L,Pennisi MA,et al.High dose tigecycline in critically ill patients with severe infections due to multidrug-resistant bacteria[J].Crit Care,2014,18(3):206-214.
[5]Duin D,Cober ED,Richter SS,et al.Tigecycline therapy for carbapenem-resistant Klebsiella pneumoniae (CRKP) bacteriuria leads to tigecycline resistance[J].Clin Microbiol Infect,2014,20(12):O1117-1120.
[6]Clinical and Laboratory Standards Institute.M100-S23 Performance standards for antimicrobial susceptibility testing:Twenty-second informational supplement[S].Wayne,PA:CLSI,2013.
[7]邹自英,杨继勇,朱冰,等.大肠埃希菌耐
药性分析及生物被膜形成能力研究[J].中华医院感染学杂志,2012,22(18):3934-3937.
[8]黄狄娜,邱卓婵,许韩波.肠杆菌科细菌的分布及其产ESBL菌株的耐药性变迁[J].中国医院用药评价与分析,2014,14(4):325-327.
[9]何礼贤,薛博仁,俞云松,等.多重耐药致病菌感染的危险因素及其治疗药物推荐[J].中国临床药理学杂志,2013,29(12):925-927.
[10]张樱,周光,杨继勇,等.不同环境下军人肠道大肠埃希菌耐药性分析[J].中华医院感染学杂志,2014,24(24):6009-6011.
[11]梁海军,崔艳慧,杨道坤.产ESBLs大肠埃希菌耐药性分析及qnr、gyrA、parC基因变异的检测[J].中华医院感染学杂志,2011,21(6):1068-1071.
[12]Clinical and Laboratory Standards Institute.M100-S22 Performance standards for antimicrobial susceptibility testing:Twenty-second informational supplement[S].Wayne,PA:CLSI,2012.
[13]Spiliopoulou A,Jelastopulu E,Vamvakopoulou S,et al.In vitro activity of tigecycline and colistin against A.baumannii clinical bloodstream isolates during an 8-year period[J].J Chemother,2015,27(5):266-270.
[14]Brust K,Evans A,Plemmons R.Tigecycline in treatment of multidrug-resistant Gram-negative bacillus urinary tract infections:a systematic review[J].J Antimicrob Chemother,2014,69(10):2606-2610.
[15]Wang RT,Wang H,She DY.Tigecycline minimum inhibitory concentration for carbapenem-resistant Acinetobacter baumannii by two methods[J].Chin J Med,2014,127(10):1997.
Characteristics of susceptible-dose dependent strains of Enterobacteriaceae bacteria and analysis of tigecycine sensitivity test results*
ZouZiying,LiuYuan#,ZengPing,HuZonghai,ZhuBing,WuLijuan△
(DepartmentofMicrobiologyandImmunology,GeneralHospitalofChengduMilitaryRegion,Chengdu,Sichuan610083,China)
[Abstract]ObjectiveTo analyze the drug susceptibility situation of susceptible-dose dependent(SDD) strains of Enterobacteriaceae bacteria and the detection distribution characteristics,and to detect the susceptibilities of extended spectrum β-lactamases (ESBLs) producing Escherichia coli and Klebsiella pneumonia to tigecycline.MethodsThe bacterial identification and drug susceptibility test to antibacterial drugs were detected by adopting the VITEK 2 COMPACT automatic microbiological analyzer.The susceptibility test to tigecycline in 50 strains of ESBLs positive Escherichia coli and 50 strains of Klebsiella pneumonia were tested by the mini broth dilution method,minimum inhibitory concentration(MIC) test strip,VITEK 2 compact system and disk diffusion method,respectively.ResultsAccording to M100-S24 criteria,about 3.58%-12.50% of the Enterobacteriaceae strains susceptible to cefepime were SDD strains.For ESBLs positive Escherichia coli and Klebsiella pneumonia strains,the detection rate of SDD strains were 13.31% and 8.60% respectively,which were higher than those for ESBLs negative strains(P<0.05).Moreover,the detection rate of SDD Enterobacteriaceae strains for the MIC 4 mg/L was higher than that for MIC 8 mg/L (P<0.05);the sensitivity rate of ESBLs positive Escherichia coli and Klebsiella pneumonia to tigecycine by adopting the mini broth dilution method and the MIC test strip was 100%.ConclusionThe laboratory should prompt that the SDD strain is detected out in the inspection report when the cefepime MIC is 4 mg/L or 8 mg/L.The sensitivity rate of tigecycline to ESBLs positive Escherichia coli and Klebsiella pneumonia is 100%.
[Key words]cefepime;susceptible-dose dependent strains;tigecycline;extended spectrum β-lactamases
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.06.018
基金项目:四川省卫生厅课题资助项目(130318);成都军区总医院院管课题资助项目(2013YG-B069)。
作者简介:邹自英(1977-),主管技师,医学硕士,主要从事细菌耐药机制研究。#共同第一作者:刘媛(1982-),主治医师,医学博士,主要从事病毒的致病机制研究。
[中图分类号]R378
[文献标识码]A
[文章编号]1671-8348(2016)06-0779-03
(收稿日期:2015-06-12修回日期:2015-10-21)
△通讯作者,Tel:028-86571052;wulijuan1638@126.com。

