调控血红素加氧酶-1诱导K562A02细胞增殖、凋亡及耐药机制研究*
柴其翔,韦四喜,王娅婷,方 琴,王季石△
(1.贵阳医学院附属医院血液科;2.贵阳医学院附属白云医院药剂科,贵州贵阳 550004)
调控血红素加氧酶-1诱导K562A02细胞增殖、凋亡及耐药机制研究*
柴其翔1,韦四喜1,王娅婷1,方琴2,王季石1△
(1.贵阳医学院附属医院血液科;2.贵阳医学院附属白云医院药剂科,贵州贵阳 550004)
[摘要]目的通过血红素加氧酶-1(HO-1)诱导剂Hemin及抑制剂ZNPP IX调控HO-1,并联合阿霉素逆转K562A02细胞化疗耐药机制的研究,为慢性髓系白血病(CML)的逆转耐药提供新的策略。方法培养K562及K562A02细胞,采用荧光原位杂交(FISH)法检测K562A02细胞中bcr-abl融合基因表达。分别用HO-1诱导剂Hemin及抑制剂ZNPP IX调控HO-1基因表达联合阿霉素处理K562A02细胞后;流式细胞术检测药物诱导细胞凋亡情况。Western blot检测耐药相关基因及凋亡基因蛋白表达水平。结果K562A02细胞中bcr-abl融合基因阳性细胞占94%。阿霉素处理细胞后,随着阿霉素浓度的增加,HO-1表达下降,耐药相关基因MDR1、NF-κB(P65)、MRP1、TopoⅡα、ABCD2表达亦降低;用HO-1诱导剂Hemin、抑制剂ZNPP IX、阿霉素单药分别及联合处理K562A02细胞后,显示HO-1高表达后耐药相关基因表达升高,细胞凋亡率下降。而降低HO-1表达,耐药相关基因表达下降,细胞凋亡率增加。结论HO-1可作为逆转耐药的靶基因,可以使K562A02对阿霉素重新敏感,起到增敏效应。
[关键词]白血病,髓系,慢性;bcr-abl融合基因;阿霉素;K562;K562A02;血红素加氧酶-1
慢性髓系白血病(chronic myelogenous leukemia,CML)是一种起源于造血干细胞的获得性克隆性疾病。目前为止,络氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)伊马替尼(imatinib,IM)仍然是治疗CML的首选药物。然而,部分CML患者在IM治疗后不久复发,表明耐药已成为影响IM治疗CML的重要问题。阿霉素,其作为周期非特异性药物,对合成RNA的抑制作用很强,可以广泛作用于多种肿瘤,均可杀灭各种生长周期的肿瘤细胞[1]。常用于血液肿瘤治疗,在使用阿霉素治疗血液肿瘤时,阿霉素通过P-糖蛋白(P-gp)在细胞内聚集和异常分布,从而降低药物敏感性,产生耐药。白血病细胞多药耐药的发生、发展为白血病化疗成功与否的主要障碍。因此,逆转阿霉素耐药是提高化疗疗效,延长生存期的手段之一。有研究报道,逆转阿霉素耐药的主要方法有:多重耐药(MDR)逆转剂如环孢霉素及类似物SDZPSC833和抗癌药新剂型等[2],联合两种及两种以上药物等增加细胞对药物的敏感性,都是通过抑制细胞中耐药相关基因mdr-1及P-gp的表达,从而达到逆转耐药目的。下调P-gp 的表达是逆转阿霉素耐药的最直接、最根本的方法[3-5]。本研究利用血红素加氧酶-1(heme oxygenase-1,HO-1)诱导剂Hemin及抑制剂ZNPP调控 HO-1,研究调控HO-1诱导K562A02对细胞增殖、凋亡及逆转耐药可能的分子作用机制,探讨白血病治疗新途径。
1材料与方法
1.1材料polybrene购自Sigma-Aldrich公司。人CML细胞株K562、人CML耐阿霉素细胞株K562A02由贵阳医学院附属医院造血干细胞移植中心实验室冻存。阿霉素购自浙江海正药业公司,TRIzol、逆转录试剂盒均为美国Invitrogen公司产品。MTT、DMSO为赛兰博科技有限公司产品。RPMI-1640培养基、胎牛血清购自杭州四季青公司,AnnexinV-FITC/PI试剂盒(凯基生物)、β-actin一抗及二抗购自碧云天生物技术研究所。核因子-κB(NF-κB)、拓朴异构酶Ⅱα(TopoⅡα)、ABCD2、MRP1及凋亡相关基因Caspace3、8、9、一抗购自上海晶天生物技术有限公司,HO-1一抗购自北京博奥森生物科技有限公司,PCR引物由上海捷瑞生物工程有限公司合成。
1.2方法
1.2.1细胞培养人CML细胞系K562及K562A02细胞培养使用含10%胎牛血清,100 U/mL青霉素及100 mg/L链霉素的RPMI 1640培养基中。37 ℃、5%CO2、100%饱和湿度CO2培养箱培养,细胞接种密度(4~5)×105个/mL。使用处于对数生长期的细胞进行实验。
1.2.2荧光原位杂交(FISH)法检测K562A02细胞中bcr-abl融合基因收集待测细胞,PBS洗涤2次并以0.075 mol/L氯化钾低渗,用甲醇∶冰乙酸(3∶1)连续固定3次,制片,计数1 000个间期细胞,记录杂交信号。正常间期细胞将显示随机分散的2红2绿4个杂交信号,异常则出现1红1绿2融合的杂交信号。
1.2.3细胞凋亡率检测取对数生长期的K562A02细胞,调整细胞密度2×105个/mL,接种于6孔板,每孔1 mL,同时设置空白对照组、慢病毒上调HO-1组、慢病毒沉默HO-1组。培养24 h后,用预冷的PBS洗涤细胞2次,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL膜联蛋白V-FITC,轻轻混匀。室温避光孵育10 min。1 000 r/min离心5 min,弃上清液,加入190 μL Annexin V-FITC结合液轻轻重悬细胞。加入10 μL碘化丙啶染色液,轻轻混匀,冰浴避光放置。随即进行流式细胞仪检测,每组平行实验3次。
1.2.4Western blot检测收集各组细胞,提取细胞总蛋白。每份样本取40 μg总蛋白,经10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至醋酸纤维素膜上,经封闭液封闭过夜后加鼠抗人β-actin一抗(1∶500),兔抗人HO-1一抗(1∶1 000),兔抗人MDR1一抗(1∶500),兔抗人MRP1一抗(1∶500),兔抗人TopoⅡα一抗(1∶1 000),鼠抗人ABCD2一抗(1∶800),鼠抗人NF-κB一抗(1∶500)室温摇膜90 min,后TBST洗膜,分别加入羊抗兔IgG二抗(1∶1 000)及羊抗鼠IgG二抗(1∶1 000)室温孵育60 min,TBST洗膜后用ECL试剂染色后曝光。每个实验至少重复3次。
1.2.5细胞分组及检测为了证实HO-1在阿霉素促进K562AO2细胞凋亡及逆转耐药中发挥重要的作用,了解调控HO-1表达后对阿霉素诱导细胞凋亡和逆转耐药的影响,将细胞分为6个组,空白组(未处理组),Hemin组(Hemin 10 μmol/L处理),ZnPP IX组(ZnPP IX 10 μmol/L处理),阿霉素组(32 μg/mL阿霉素单独处理),阿霉素+Hemin组(32 μg/mL阿霉素+10 μmol/L Hemin联合处理),阿霉素+ZnPP IX组(32 μg/mL阿霉素+10 μmol/L ZnPP IX联合处理)。Western blot检测不同分组处理K562A02细胞后 HO-1、Caspase9、Caspase3、Caspase8、MDR1、TopoⅡα、MRP1及NF-κB基因蛋白的表达。
1.3统计学处理采用SPSS15.0软件进行统计分析,组间比较采用方差分析及LSDt检验,以P<0.05为差异有统计学意义。
2结果
2.1FISH法检测K562A02细胞株bcr-abl融合基因表达K562A02细胞在FISH中表达为典型的t(9;22) (q34;q11)杂交信号(2融合),bcr-abl融合基因阳性细胞占细胞总数的94%,见图1。
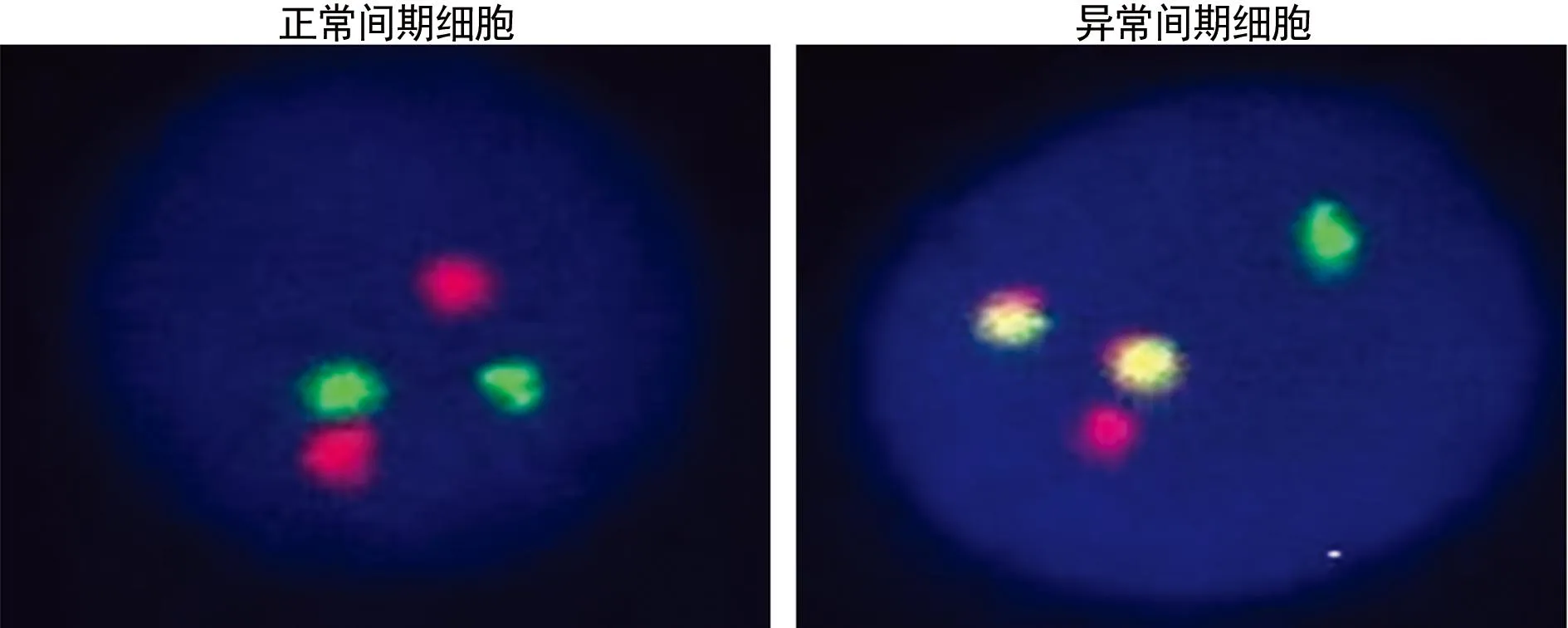
绿色:ABL;红色:BCR。
图1FISH双色双融合探针法检测BCR-ABL融合基因的荧光图
2.2流式细胞术检测阿霉素作用K562A02细胞后的细胞凋亡率阿霉素诱导K562A02细胞凋亡呈剂量依赖关系,K562A02细胞凋亡率随着阿霉素浓度的增加而增加,在浓度为32 μg/mL时,作用浓度达到峰值。阿霉素8、16、32、64 μg/mL诱导K562A02细胞凋亡率分别为21.09%、30.05%、69.08%、64.65%,见图2。

图2 流式细胞术检测不同浓度阿霉素处理K562A02细胞24 h后的细胞凋亡率
2.3Western blot检测耐药相关基因MDR1、NF-κB(P65)等蛋白的表达MDR1、NF-κB(P65)、MRP1、TopoⅡα、ABCD2及HO-1蛋白表达随阿霉素浓度增高而减低,呈剂量依赖关系,64 μg/mL浓度点表达最低。以β-actin为内参,MDR1、NF-κB(P65)、MRP1、TopoⅡα、ABCD2及HO-1各蛋白表达随阿霉素浓度增加而降低,在64 μg/mL时表达最低,与未处理组(0 μmol/L)比较,阿霉素8、16、32、64 μg/mL组蛋白表达降低(P<0.05),见图3。因流式细胞检测凋亡,其作用浓度同Realtime-PCR浓度一致,故联合使用药物时,阿霉素作用浓度设为32 μg/mL。
2.4调控HO-1表达对阿霉素诱导细胞凋亡及细胞耐药的影响调控HO-1表达后对耐药及凋亡相关基因Caspase9、Caspase3、Caspase8、MDR1、TopoⅡα、MRP1及NF-κB蛋白表达水平的影响,凋亡相关基因蛋白表达水平在阿霉素+Hemin组表达最低,而阿霉素+ZnPP IX组表达最高。耐药相关基因表达水平在阿霉素+Hemin组表达最高,而阿霉素+ZNPP组表达最低(图4A)。与空白组(未处理组)比较,在ZNPP IX组和阿霉素组,细胞凋亡蛋白均有所增加,阿霉素+ZNPPIX组中,HO-1及耐药相关基因蛋白表达水平最低,而凋亡蛋白表达水平最高。组间表达差异有统计学意义(P<0.05),见图4B、C。
2.5调控HO-1表达后对K562AO2细胞凋亡率的影响阿霉素+Hemin组K562A02细胞的凋亡率最低,而阿霉素+ZnPP IX组的K562A02细胞凋亡率最高。空白组、阿霉素组、Hemin组、ZNPP IX组、阿霉素+Hemin组及阿霉素+ZnPP IX组的凋亡率分别为(8.71±1.09)%、(3.65±1.65)%、(36.78±0.95)%、(34.83±1.24)%、(18.83±1.52)%及(68.95±1.17)%;组间表达差异有统计学意义(P<0.05),见图5。
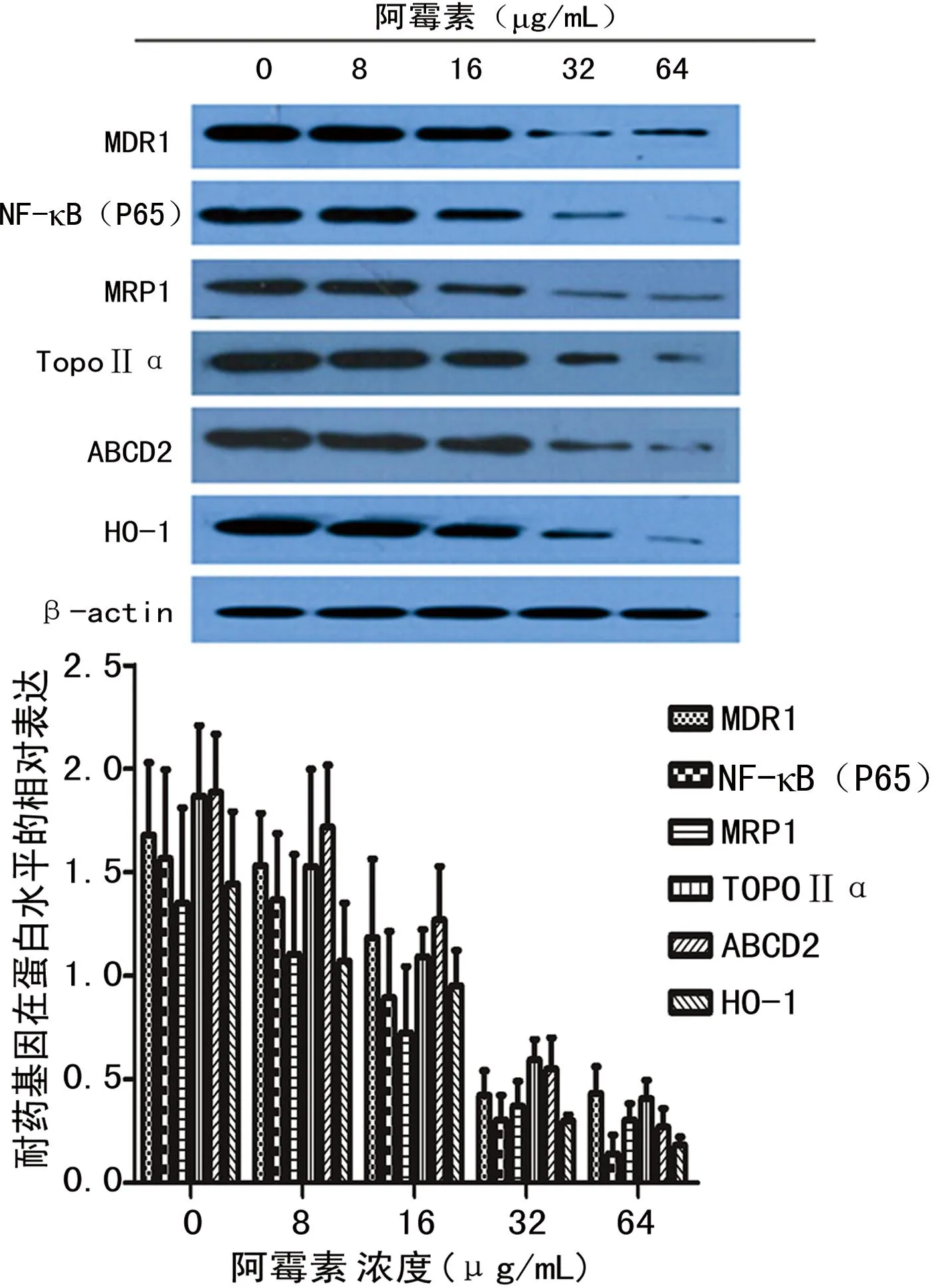
图3 不同浓度阿霉素处理K562A02细胞24 h后 MDR1、
A:电泳图;B、C:以β-actin为内参,HO-1及耐药、凋亡相关基因蛋白的相对表达直方图;1:空白组;2:Hemin组;3:ZNPP组;4:阿霉素组;5:阿霉素+Hemin组;6:阿霉素+ZNPP IX组;a:P<0.05,与空白组比较。
图4不同分组处理K562A02细胞后 HO-1及耐药及凋亡基因的蛋白表达水平
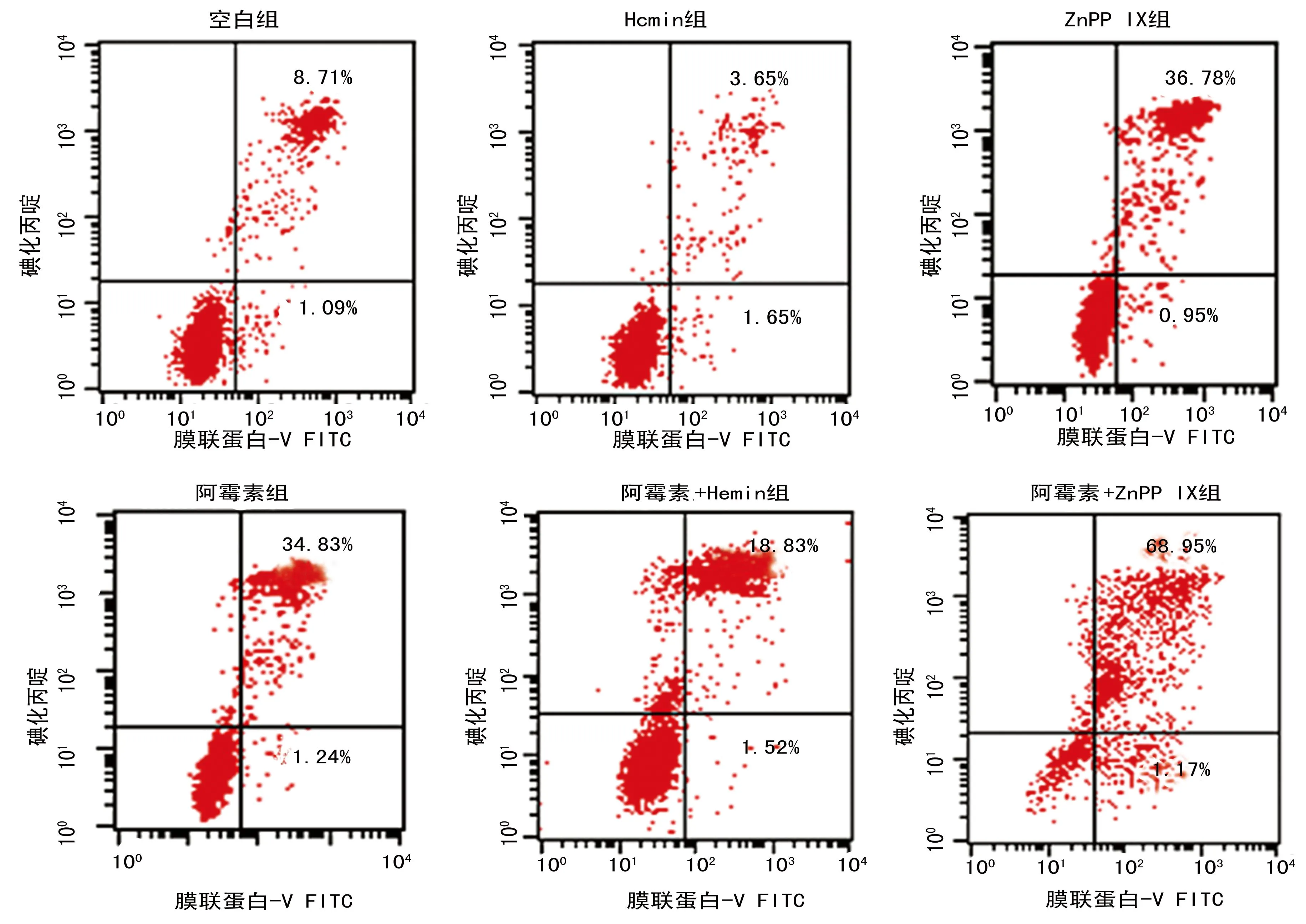
图5 流式细胞术检测不同分组处理后K562A02细胞的凋亡率
3讨论
HO-1 作为一种抗氧化防御酶在机体中广泛存在,既往许多实验结果都显示诱导HO-1的表达是细胞对抗外界环境刺激的一种防御性的保护反应[6]。有研究发现多种类型人类肿瘤高表达HO-1,说明HO-1以一种特殊方式改变细胞的生长状态,认为它可能是一种肿瘤细胞生长的促进因子[7]。仍有一部分患者出现病情复发或伴随较差的预后,其主要原因是白血病细胞多药耐药的产生[8],如何提高白血病细胞对化疗的敏感性是白血病治疗的关键所在。
阿霉素属于TopoⅡ抑制剂,可通过抑制双链DNA的合成来诱导肿瘤细胞的凋亡而发挥抗肿瘤作用。在CML治疗中常出现阿霉素耐药情况的发生。因此,在CML的治疗中出现耐药是影响获得良好疗效的主要障碍。阿霉素通过P-gp在胞内聚集和异常分布,从而降低药物敏感性,产生耐药。逆转阿霉素耐药的方式有联合用药等方式下调细胞mdr-1 mRNA 和P-gp 的表达以抑制P-gp 的功能。P-gp高表达,可以导致化疗失败或耐药,其机制可能为可使作用药物从细胞内通过泵泵出细胞外,细胞内药物作用浓度变低,药物对细胞的毒性降低[9]。
本课题使用HO-1作为靶基因,通过Hemin及ZNPP调控HO-1 表达同时联合阿霉素作用于k562AO2细胞。其耐药基因同HO-1表达呈现正相关性。因阿霉素的耐药逆转可促进细胞增殖抑制细胞凋亡增加血管新生受抑。故予HO-1作为逆转阿霉素耐药的分子靶点。随着对HO-1在肿瘤发生发展过程中的作用更深入研究,近年来关于HO-1与肿瘤耐药的相关研究已有报道,使得HO-1成为目前肿瘤耐药研究的热点之一[10]。并且本实验室前期已证实了HO-1的高表达与CML的病情进展有关[11-13]可见,HO-1在肿瘤组织中多呈高表达与化疗耐药相关。本研究中阿霉素+Hemin组K562A02细胞的凋亡率较阿霉素单独处理组降低,阿霉素+ZnPP IX组K562A02细胞的凋亡率明显高于阿霉素组及阿霉素+Hemin组。结果说明阿霉素对K562A02细胞有促进凋亡作用,但HO-1高表达时,这种促进作用会受到抑制,而HO-1低表达时,K562细胞的凋亡率明显升高,说明HO-1对K562A02细胞具有保护效应。
本课题组关于HO-1和白血病耐药的研究也证实急性髓系白血病(acute myelogenous leukemia,AML)患者中HO-1表达高于健康者,抑制HO-1表达可以增强AML细胞对化疗的敏感性[14]。因此,抑制肿瘤细胞中HO-1表达,可能是逆转阿霉素耐药的新思路。多药耐药相关蛋白(multidrug resistance-associated protein,MRP) 是ATP结合盒(ATP-binding cassette,ABC) 转运蛋白主要成员,MRP通过结合ATP 泵,将药物泵出细胞外来以降低细胞内药物浓度来介导耐药,其过度表达常常导致肿瘤MDR的产生[15]。由MDR-1编码的P-gp是产生阿霉素耐药的原因之一。但是在临床治疗中许多患者耐药的发生并不能单一以MDR-1的过表达来解释,MDR-1过度表达常常导致肿瘤多药耐药的产生,在不同细胞株的培养中均发现多种MRP蛋白高表达,且与抗肿瘤药物的耐药密切相关[16]。MRP1为膜转运蛋白,它产生耐药的机制是由于将抗肿瘤药物泵出细胞膜外所致[17-18]。目前研究显示,TopoII在肿瘤的多药耐药中发挥着重要作用,其耐药机制为:(1)活性及酶量下降、表达缺失或基因突变,从而使抗癌药的作用靶点减少或丧失;(2)通过参与其他耐药基因的调控诱导其他耐药基因的表达[19]。
综上所述,阿霉素可抑制K562A02细胞增殖且诱导细胞凋亡。HO-1基因高表达时,在CML耐药细胞凋亡过程中起保护作用,与促进CML耐药细胞的生长有关。沉默HO-1基因,其耐药基因相应的可通过MRP1、TopoⅡα、ABCD2、MDR1等信号通路逆转K562A02耐药。
参考文献
[1]Laginha KM,Verwoert S,Charrois GJ,et al.Determination of doxorubicin levels in whole tumor and tumor nuclei in murine breast cancer tumors[J].Clin Cancer Res,2005,11(19 Pt 1):6944-6949.
[2]Han Z,Hong L,Han Y,et al.Phospho Akt mediates multidrug and Bax[J].J Exp Clin Cancer Res,2007,26(2):261-268.
[3]Lavie Y,Harel-Orbital T,Gaffield W,et al.Inhibitory effect of steroidal alkaloids on drug transport and multidrug resistance in human cancer cells[J].Anticancer Res,2001,21(2A):1189-1194.
[4]Naito M,Matsuba Y,Sato S,et al.MS-209,a quinoline-type reversal agent,potentiates antitumor efficacy of docetaxel in multidrug-resistant solid tumor xenograft models[J].Clin Cancer Res,2002,8(2):582-588.
[5]Cuvier C,Treupel R,Millot JM,et al.Doxo nanospheres bypass tumor cell multidru[J] Biochem Pharmacol,1992,44(3):509-517.
[6]Hanselmann C,Mauch C,Werner S.Haem oxygenase-1:a novel player in cutaneous wound repair and psoriasis?[J].Biochem J,2001,353(3):459-466.
[7]Otterbein LE,Soares MP,Yamashita K,et al.Heme oxygenase-1:unleashing the protective properties of heme[J].Trends Immunol,2003,24(8):449-455.
[8]Koistinen P,Räty R,Itälä M,et al.Long-term outcome of intensive chemotherapy for adults with de novo acute myeloid leukaemia (AML):the nationwide AML-92 study by the Finnish Leukaemia Group[J].Eur J Haematol,2007,78(6):477-486.
[9]Wong HL,Bendayan R,Rauth AM,et al.Simultaneous delivery of doxorubicin and GG918 (Elacridar) by new polymer-lipid hybrid nanoparticles (PLN) for enhanced treatment of multidrug-resistant breast cancer[J].J Control Release,2006,116(3):275-284.
[10]Yu HM,Wang TC.Mechanism of cisplatin resistance in human urothelial carcinoma cells[J].Food Chem Toxicol,2012,50(5):1226-1237.
[11]王季石,杨畅,方琴,等.体外诱导K562细胞尼洛替尼耐药及其机制的初步探讨[J].中华血液学杂志,2012,33(11):906-910.
[12]陈埕,王季石,秦东,等.逆转录病毒介导的HO-1基因在尼洛替尼诱导K562/A02耐药细胞凋亡中的作用[J].中华血液学杂志,2012,33(5):383-387.
[13]王季石,柴柏胜,方琴,等.HO-1基因表达对伊马替尼耐药的慢性髓系白血病细胞增殖的影响[J].中华血液学杂志,2011,32(6):388-391.
[14]MaD,FangQ,LiY,etal.Crucialrole
of heme oxygenase-1 in the sensitivity of acute myeloid leukemia cell line Kasumi-1 to ursolic acid[J].Anticancer Drugs,2014,25(4):406-414.
[15]Daood M,Tsai C,Ahdab-Barmada M,et al.ABC transporter (P-gp/ABCB1,MRP1/ABCC1,BCRP/ABCG2) expression in the developing human CNS[J].Neuropediatrics,2008,39(4):211-218.
[16]Kläs J,Wolburg H,Terasaki T,et al.Characterization of immortalized choroid plexus epithelial cell lines for studies of transport processes across the blood-cerebrospinal fluid barrier[J],Cerebrospinal Fluid Research,2010,7(1)11.
[17]Kruh GD,Belinsky MG.The MRP family of drug efflux pumps[J].Oncogene,2003,22(47):7537-7552.
[18]Wei XL,Ni H,Wang QS,et al.Impact of STAT4 gene silencing on the expression profile of proteins in EL-4 cells[J].Chin Sci Bull,2009,54(18):3265-3270.
[19]Asano T,Zwelling LA,An T,et al.Effect of transfection of a Drosophila topoisomerase Ⅱ gene into a human brain tumour cell line intrinsically resistant to etoposide[J].Br J Cancer,1996,73(11):1373-1380.
Study on regulating heme oxygenase-1 for inducing proliferation,apoptosis and drug resistance mechanism of K562A02 cell*
ChaiQixiang1,WeiSixi1,WangYating1,FangQin2,WangJishi1△
(1.DepartmentofHematology,AffiliatedHospitalofGuiyangMedicalCollege,Guiyang,Guizhou,550004,China;2.DepartmentofPharmacy,AffiliatedBaiyunHospitalofGuiyangMedicalCollege,Guiyang,Guizhou,550004,China)
[Abstract]ObjectiveTo regulate heme oxygenase-1(HO-1) by the inducer Hemin of HO-1 and inhibitor ZNPP.IX and combined with adriamycin for reversing the chemotherapeutic drug-resistance mechanism of K562A02 cells so as to provide a new strategy for chemoresistance reversion of chronic myeloid leukemia (CML).MethodsK562 and K562A02 cells were cultured and the expression of bcr-abl fusion gene in K562A02 cells was detected by fluorescence in situ hybridization (FISH).Then the HO-1 gene expression was respectively regulated by Hemin as the HO-1 inducer and ZNPP as the inhibitor and adriamycin was combined for treating K562A02 cells with different concentrations.The apoptosis induced by medication was detected by flow cytometry.The expression levels of drug resistance related gene and apoptosis gene protein were detected by Western blot.ResultsThe positive cells of bcr-abl fusion gene in the K562A02 cells accounted for 94%.The HO-1 expression was decreased with the adriamycin concentration increase after treating cells by adriamycin,the expression levels of drug resistance related genes MDR1,NF-κB(P65),MRP1,TopoⅡα and ABCD2 were also decreased;after treating K562A02 cells by single drug and combination of Hemin,ZNPP.IX and adriamycin,increasing HO-1 expression elevated the expression of drug resistance related genes and decreased the cellular apoptosis,while reducing HO-1 expression could decrease the expression of drug resistance related genes and increased cellular apoptosis.ConclusionHO-1 can act as a target gene for drug resistance reversion and can make K562A02 cells to regain sensitivity to adriamycin,thus plays a sensitivity-increasing effect.
[Key words]leukemia,myelogenous,chronic;bcr-abl fusion gene positive;adriamycin;K562;K562A02;heme oxygenase-1
doi:·论著·10.3969/j.issn.1671-8348.2016.06.003
基金项目:国家自然科学基金资助项目(81360501)。
作者简介:柴其翔(1988-),住院医师,硕士研究生,主要从事常见白血病耐药的机制研究。△通讯作者,Tel:13985704057;E-mail:chaiqixiang@163.com。
[中图分类号]R552
[文献标识码]A
[文章编号]1671-8348(2016)06-0727-04
(收稿日期:2015-07-19修回日期:2015-10-24)

