荧光定量PCR检测猪链球菌2型主要毒力因子方法的建立
凌淑萍, 赵 健, 陈 国, 叶宇飞, 许秀琴, 吕 燕, 吴银良
(宁波市农业科学研究院,浙江宁波 315000)
荧光定量PCR检测猪链球菌2型主要毒力因子方法的建立
凌淑萍, 赵 健, 陈 国, 叶宇飞, 许秀琴, 吕 燕, 吴银良
(宁波市农业科学研究院,浙江宁波 315000)
摘要[目的]建立荧光定量PCR检测猪链球菌2 型(Streptococcus suis serotype 2,SS2)、溶菌酶释放蛋白(Muramidase-released protein,MRP) 和胞外因子(Extracellular protein factor,EF)3种主要毒力因子的方法。[方法]根据cps2j、mrp和ef基因的基因序列,分别设计并合成3对引物及相应的Taqman探针,其中cps2j和mrp的5′端标记FAM荧光发射基团,ef的5′端标记HEX荧光发射基团,3种基因的3′端都标记BHQ1淬灭荧光基团。通过优化反应体系和程序,建立了一种基于Taqman探针法的荧光定量PCR方法检测上述3种主要毒力因子,其中cps2j单独检测,mrp与ef的实行双重荧光PCR 方法检测。[结果]cps2j、mrp和ef的最低检测限分别为12、51和51 CFU,灵敏度很高;与其他病原菌无交叉反应,重复性及特异性均较好;此外,整个检测过程在60 min内即可完成。[结论]该试验所建立的双重荧光定量PCR方法的敏感性、重复性及特异性均较好,可用于同时快速检测猪链球菌2型3种主要毒力因子。
关键词猪链球菌2型;荧光定量PCR;毒力因子
猪链球菌是一种重要的人畜共患病原菌,猪链球菌分为33个血清型,其中以猪链球菌2型(Streptococcussuistype 2,SS2)致病力最强,也是全世界范围内引起人类疾病最常见的致病血清型[1-2]。SS2可引发猪脑膜炎、关节炎、心内膜炎、败血症和肺炎等,各年龄段猪均可感染猪链球菌病。SS2不仅是影响各国养猪业发展的重要疫病之一,同时该病还可感染养猪相关从业人员,引起细菌性败血症、休克、脑膜炎、永久性听力丧失,甚至死亡,给养猪业及公共卫生构成严重威胁[3]。
SS2在很多国家均受到广泛重视,对其研究主要集中在毒力相关因子(Virulence correlated facters, VAFs)的研究上。研究表明,VAFs与猪链球菌引起的病症密切相关[4]。其中,荚膜多糖(CPS)是目前已确定的猪链球菌2型主要的细菌毒力相关因子,具有抗吞噬的作用[5-6],因其具有很高的种特异性,csp2j常被作为检测猪链球菌2型的靶基因[7]。此外,溶菌酶相关蛋白(MRP)和细胞外蛋白因子(EPF)也是主要毒力相关因子,人工感染小鼠和猪的试验表明MRP+EF+菌株可致猪产生典型脑膜炎、多发性关节炎和多发性浆液炎等疾病,MRP+EF-菌株仅引起的疾病则较为温和,而MRP-EF-菌株则无致病性[8]。另外,mrp与ef基因串联表达蛋白具有重要的免疫保护作用[9]。目前,对猪链球菌2型的检测包括细菌培养、生化试验、乳胶凝集试验和qPCR等分子生物学检测方法,与传统的方法相比qPCR方法能够快速、准确检测猪链球菌2型,被广泛应用于猪链球菌病的检测与诊断方面[10]。笔者针对猪链球菌2型3个主要的毒力相关因子(cps2j、mrp、ef)分别设计引物与Taqman探针,cps2j单独实行荧光定量法,用以检测猪链球菌2型是否存在,而mrp和ef实行双重荧光定量PCR方法,检测猪链球菌2型的毒力情况,以期为猪链球菌的疾病防控与公共卫生提供指导。
1材料与方法
1.1材料
1.1.1菌株。猪链球菌2型ATCC43765,购自中国兽医微生物菌种保藏管理中心;金黄色葡萄球菌ATCC6538、单增李斯特菌ATCC29212、沙门氏菌ATCC14028、大肠埃希氏菌ATCC25922、乙型溶血性链球菌ATCC21059,均购自广东环凯微生物科技有限公司。
1.1.2主要试剂和仪器。脑心浸液肉汤和琼脂粉,均购自青岛海博生物技术有限公司;Ezup柱式细菌基因组DNA提取试剂盒提取基因组DNA(上海生工股份有限公司);Premix ExTaqTM试剂盒(TaKaRa);steponeplusTM定量PCR仪(ABI);溶菌酶(BIOSHARP);蛋白酶K(上海生工股份有限公司)。
1.2引物和TaqMan 探针根据GenBank 公布的猪链球菌2 型csp2j基因序列鉴定菌种参考基因序列(登录号JX986792.1),其他2个毒力因子基因mrp(登录号 X64450.1)、ef(登录号JF813371.1),探针的5’端分别标记FAM、FAM、HEX;3’端标记BHQ1。使用Beacon Designer 7设计引物和探针,均由Life公司合成。引物和探针序列如表1所示。
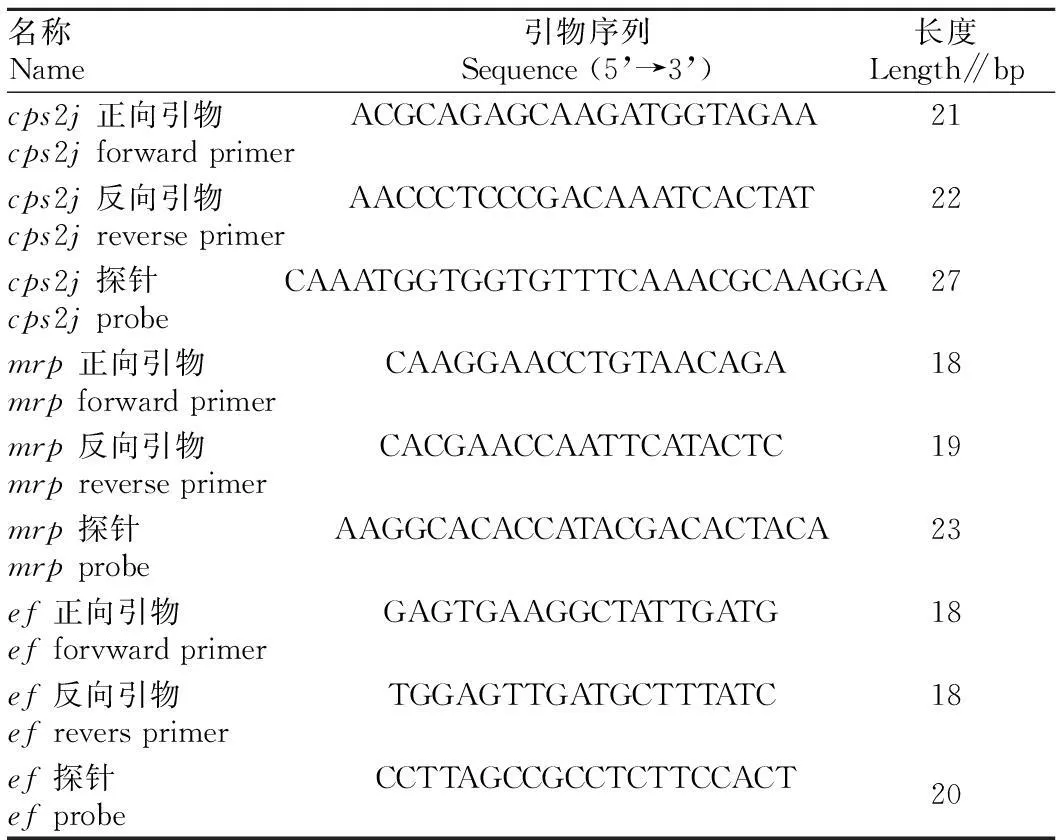
表1 引物和探针序列
1.3细菌计数猪链球菌2型标准菌株接种于脑心浸液肉汤,37 ℃下培养24 h。取1 mL培养液置于9 mL生理盐水中,摇匀,依次进行10倍梯度稀释,取适当稀释度的菌液1 mL置于培养皿中,加入含1.5%琼脂的脑心浸液肉汤,混合均匀,每个稀释度的细菌做2个平行,37 ℃下培养24 h ,取合适细菌生长数的培养皿,计算每毫升菌落形成单位(Colony forming units,CFU)。
1.4荧光定量PCR
1.4.1猪链球菌2型基因组DNA的提取。取2 mL细菌增菌培养液,10 000×g 离心1 min,弃上清,使用细菌基因组DNA提取试剂盒提取基因组DNA,具体方法参照使用说明书。
1.4.2荧光定量PCR 扩增。PCR 扩增反应在Stepone Plus(ABI)上进行,单荧光反应体系(20 μL):Premix ExTaqTM10 μL、10 μmol/L引物各0.4 μL、probe 0.8 μL、ROX Reference Dye(50×)0.4 μL、DNA模板2 μL、超纯水6.0 μL;双重荧光反应体系(20 μL):Premix ExTaqTM10 μL、10 μmol/L引物1、引物2各0.4 μl,probe 1、probe 2各0.8 μL,ROX Reference Dye(50×)0.4 μL,DNA模板2 μL,超纯水4.4 μL。反应条件:95 ℃ 20 s;95 ℃ 1 s,60 ℃ 20 s,40个循环,在每个循环的60 ℃时收集荧光信号。
1.4.3特异性试验。运用实验室保存的金黄色葡萄球菌、单增李斯特菌、沙门氏菌、大肠埃希氏菌、乙型溶血性链球菌作为特异性试验的对照组进行试验。
1.4.4标准曲线的绘制与灵敏度检测。取1 mL 37 ℃过夜培养的菌液,用生理盐水进行10-1、10-2、10-3、10-4、10-5、10-6、10-7稀释;取适量稀释液做细胞计数试验,使用试剂盒法提取细菌基因组,提取基因组通过荧光PCR进行检测。
2结果与分析

图1 S.suis 2 cps2j、mrp、ef实时荧光定量PCR的动力学扩增曲线Fig.1 The dynamic curve of the triple real-time qPCR for cps2j,mrp,ef in S.suis serotype 2

图2 纯培养猪链球菌2型DNA的实时PCR 标准曲线Fig.2 Real-time PCR standard curve of S.suis serotype 2 DNA
2.1标准曲线取10-2、10-3、10-4、10-5、10-6稀释度的猪链球菌2 型基因组DNA 进行定量扩增。扩增曲线如图1所示。取10-5、10-6稀释度的猪链球菌2 型菌进行进行细胞计数,结果表明10-5稀释度细菌数多不可计,10-6稀释度的细菌拷贝数为120 CFU。以起模板数的对数为X轴,以Ct值为Y轴,绘制标准曲线。根据标准曲线,得到cps2j、mrp、ef3种基因的标准曲线方程:y=-3.185 9x+39.901(R=0.999 2)、y=-3.165x+ 41.533(R= 0.997 5)、y=-3.275 7x+40.689(R2= 0.997 2)(图2)。
2.2灵敏度检测根据阳性对照细菌数计算拷贝数,检测倍比稀释的阳性对照,结果发现此体系中cps2j最低可检测细菌拷贝数为12 CFU,而mrp和ef最低可检测细菌拷贝数均为51 CFU(图3)。
2.3特异性试验运用保存的金黄色葡萄球菌、单增李斯特菌、沙门氏菌、大肠埃希氏菌、乙型溶血性链球菌作为特异性试验的对照组进行试验。 结果表明,该方法能够特异地检测出猪链球菌2型,而其他对照组的检测结果均为阴性,说明该体系具有良好的特异性。
3讨论与结论
猪链球菌是一种危害严重的条件性致病菌,亚临床的病原携带者是猪链球菌的主要传染源。该病原对我国食品安全、畜牧业生产安全以及相关从业人员具有巨大威胁。1998年和2005年已经分别在我国江苏省和四川省引起了猪链球菌2型2次大规模的爆发,并伴随着猪群大规模的链球菌中毒性休克综合症和异常升高的死亡率[11-13],引起了公众对猪链球菌2型的极大关注。加强对猪链球菌尤其是对猪链球菌2型的检测力度,对于预防和控制猪链球菌病具有重要的意义[14]。目前,PCR技术在病原菌的检测与诊断方面已被广泛应用。

图3 猪链球菌2型最低检出限DNA的实时PCR 标准曲线Fig.3 Real-time PCR standard curve of detection limit of S.suis serotype 2 DNA
该试验采用的qPCR技术是PCR技术中的一种,它不仅有常规PCR技术的扩增高效率的特点,还具有探针的高度特异性、光谱技术的高敏感性和精确性等特点,被广泛运用于医疗、药物研究、病原菌的检测等体外扩增技术[15]。此外,整个反应过程是由仪器自动控制并进行结果分析,避免了后续电泳等步骤,减少污染。猪链球菌菌株根据毒力因子的差异,可分为强毒力株(MRP+EF+)、弱毒力株(MRP+EF-)和无毒力株(MRP-EF-)[16]。该试验参照GenBank中猪链球菌2型3种毒力因子cps2j、mrp和ef基因序列,选择其高度保守区,利用Beacon Designer 7软件分别设计3对特异性的引物及相应的Taqman探针。cps2j基因采用单重荧光PCR技术,用于检测SS2是否存在。另外,通过优化反应体系和程序,建立一种基于Taqman探针法的双重荧光定量PCR方法检测mrp和ef2个毒力因子基因。优化反应体系后mrp和ef基因的扩增效率基本与单重qPCR相一致,而且2种荧光信号的收集不存在互相干扰,可建立良好动力学扩增曲线及标准曲线。该试验结果表明试验所建立的实时荧光定量PCR方法的敏感性、重复性及特异性均较好,而且操作方便,简单快速,可为猪链球菌2型菌株的分离和毒力鉴定提供参考。
参考文献
[1] LUN S,PEREZ-CASAL J,CONNOR W,et al.Role of suilysin in pathogenesi s ofStreptococcussuiscapsular serotype 2[J].Microb Pathog,2003,34(1):27-37.
[2] KIM D,HAN K,OH Y,et al.Distribution of capsular serotypes and virulence markers ofStreptococcussuisisolated from pigs with polyserositis in Korea[J].Can J Vet Res,2010,74(4):314-316.
[3] GOTTSCHALK M,SEGURA M,XU J.Streptococcussuisinfections in humans:The Chinese experience and the situation in North America[J].Anim Health Res Rev,2007,8:29-45.
[4] WU Z W,LI M,WANG C J et al.Probing genomic diversity and evolution ofStreptococcussuisserotype 2 by NimbleGen tiling arrays[J].BMC Genomics,2011,12:219.
[5] CHARLAND N,HAREL J,KOBISCH M,et al.Streptococcussuisserotype 2 mutants deficient in capsular expression[J].Microbiology,1998,144 (Pt 2):325-332.
[6] SMITH H E,DAMMAN M,VAN DER VELDE J,et al.Identification and characterization of the cps locus ofStreptococcussuisserotype 2:The capsule protects against phagocytosis and is an important virulence factor[J].Infect Immun,1999,67:1750-1756.
[7] YAO X,LI M,WANG J,et al.Isolation and characterization of a native avirulent strain ofStreptococcussuisserotype 2:A perspective for vaccine development[R].Scientific Reports,2015.
[8] VECHT U,WISSELINK H J,JELLEMA M L,et al.Identification of two proteins associated with virulence ofStreptococcussuistype 2[J].Infect Immun,1991,59(9):3156-3162.
[9] 李明,何孔旺,陆承平.猪链球菌2型MRP与EPF基因串联表达蛋白及其免疫保护作用[J].中国农业科学,2005,38(6):1264-1269.
[10] 罗宝正,薄清如,陈竞帆,等.实时荧光PCR检测Ⅱ型猪链球菌方法的建立[J].农业生物技术学报,2006,14(5):783-787.
[11] YU H J,JING H Q,CHEN Z H,et al.HumanStreptococcussuisoutbreak,Sichuan,China[J].Emerg Infect Dis,2006,12:914-920.
[12] TANG J Q,WANG C J,FENG Y J,et al.Streptococcal toxic shock syndrome caused byStreptococcussuisserotype 2[J].PLoS Med,2006,3:151.
[13] CHEN C,TANG J Q,DONG W,et al.A glimpse of streptococcal toxic shock syndrome from comparative genomics ofS.suis2 Chinese isolates[J].PLoS One,2007,2:315.
[14] 王蓉蓉,孙卫东,蒋蔚,等.猪链球菌2 型主要毒力因子三重荧光定量PCR 检测方法的建立[J].中国动物传染病学报,2014,22(6):25-31.
[15] 欧阳松应,杨冬,欧阳红生,等.实时荧光定量PCR技术及其应用[J].生命的化学,2004,24(1):74-76.
[16] V A N L E E N G O E D L A,V E C H T U,V E R H E Y E N E R .Streptococcussuistype 2 infections in pigs in the Netherlands (Part two)[J].Vet Q,1987,9(2):111-117.
Establishment of the Real-time qPCR method for Detection of Main Virulence Factors ofStreptococcussuisSerotype 2
LING Shu-ping,ZHAO Jian,CHEN Guo et al
(Ningbo Academy of Agricultural Sciences,Ningbo,Zhejiang 315000)
Abstract[Objective] Taq Man real-time qPCR was established for detection of Streptococcus suis serotype 2(SS2),muramidase-released protein(MRP) and extracellular protein factor(EF).[Method] The double Taq Man real-time PCR assay was developed to simultaneously detect virulence genes cps2j,mrp and ef of S.suis serotype 2.Three pairs of specific primers and fluorogenic-labeled probes were designed and synthesized in accordance with the above target genes.The 5′-ends of probes for cps2j and mrp were labeled with FAM,while the 5′-ends of ef were individually labeled with HEX,and their 3′-ends were all labeled with quencher BHQ1.The reaction system and procedures were optimized.[Result] The detection limits for purified recombinant plasmids of cps2j,mrp and ef were 12,51 and 51 CFU,respectively.There was no cross reaction between S.suis serotype 2 and other pathogens.The entire detection could be completed within 60 min.[Conclusion] The double Taq Man real-time PCR assay developed in this study is fast,sensitive,repeatable and specific,which can be used for rapid detection of three kinds of virulence factors of S.suis serotype 2.
Key wordsStreptococcus suis serotype 2; Real-time qPCR; Virulence factors
基金项目宁波市农科教结合项目(2015NK24)。
作者简介凌淑萍(1987- ),女,浙江宁波人,硕士研究生,研究方向:微生物检测。
收稿日期2016-02-24
中图分类号S 852.6
文献标识码A
文章编号0517-6611(2016)08-138-03

