停流荧光法研究牛血清白蛋白和叶酸反应动力学
叶三仙, 罗云敬*, 乔树亮, 李 莉, 刘彩虹, 史建龙,安学静
1. 北京工业大学生命科学与生物工程学院,北京 100124 2. 中国检验检疫科学研究院,北京 100123 3. 包头出入境检验检疫局,内蒙古 包头 014010
停流荧光法研究牛血清白蛋白和叶酸反应动力学
叶三仙1, 罗云敬1*, 乔树亮3, 李 莉2, 刘彩虹2, 史建龙1,安学静1
1. 北京工业大学生命科学与生物工程学院,北京 100124 2. 中国检验检疫科学研究院,北京 100123 3. 包头出入境检验检疫局,内蒙古 包头 014010
叶酸属于B族维生素,作为生物体内转移一碳单位酶系中的辅酶,与其他维生素相互作用,共同维持体内红细胞的稳定,对氨基酸之间的转化、细胞的分裂生长,蛋白质合成的反应都有重要意义。药物半衰期、峰浓度和反应速度常数是研究药代动力学的重要参数,实验运用荧光分光光度计和停流光谱分析仪研究了仿生环境下牛血清白蛋白和叶酸反应的动力学参数,为叶酸相关的药物代谢参数提供参考。结果表明:利用Stern-Volmer方程处理荧光猝灭实验数据,得到25, 30和37 ℃下叶酸对牛血清白蛋白内源荧光的静态猝灭常数分别为2.455×1010,4.900×1010和6.427×1010L·mol-1·s-1;动力学反应速率常数的计算结果表明不同温度、pH值和缓冲介质下BSA和叶酸反应的速率常数都大于100 mol·L-1·s-1,阐明了BSA与叶酸之间的猝灭机理是通过形成复合物的静态猝灭过程;生理温度下,牛血清白蛋白浓度与其初始浓度满足二级反应公式,相关系数为0.998 7,药代半衰期t1/2为0.059 s;反应的表观速率常数随着叶酸浓度的增加呈线性增加趋势,且叶酸催化牛血清白蛋白荧光猝灭的速率常数kcat=3.174×105mol·L-1·s-1。此外还测定了不同缓冲介质下牛血清白蛋白与叶酸相互作用的表观速率常数和反应速率常数,以此来探讨生理介质对于二者反应的影响,为确定临床用药方案、预测药物的疗效和毒性以及合理用药有着重要意义。
牛血清白蛋白;叶酸;荧光光谱;动力学参数
引 言
叶酸是一种水溶性维生素,它能传递一碳基团(甲基或甲酰)给脱氧尿苷酸,使之变为脱氧胸苷酸,进而合成DNA。叶酸的缺少会增加未成熟细胞量,使白血球减少,从而导致红血球的异常,引起贫血、心脏病、老年性痴呆及胎儿神经软管缺陷等疾病[1-3]。叶酸进入机体后,和各种生物分子结合在体内发挥作用,如氨基酸、蛋白质、受体和核酸等[4]。自1995年Green等证实了叶酸与同型半胱氨酸代谢有着密切的联系,以叶酸受体为治疗药物和分子探针方面的研究日益深入,已有部分叶酸的新药前体进入临床研究阶段,但对其作用时间和良好的生物利用度却不甚明了[5-6]。
血清白蛋白是血浆中含量最丰富和结合能力最广泛的载体蛋白。研究药物与血清白蛋白相互作用,对于了解药物在体内的存在状态、吸收与代谢及药理作用具有重要意义[7-8]。胡涛英等[9]将经典光谱法与内滤光校正和分子对接等技术相结合,探究了多西环素与人血清白蛋白的相互作用,为研究相关药物小分子的药理机制提供了理论依据。基于叶酸分子对血清白蛋白荧光的猝灭效应,白海鑫等[10-11]研究了叶酸和血清白蛋白相互作用时的结合方式、作用力类型和结合位点数。付彩霞等[12]研究了叶酸与牛血清白蛋白在含铁(Ⅲ)环境中的相互作用。Niki等[13]利用热力学原理研究牛血清白蛋白与叶酸相互作用的机制。尚未见有对血清白蛋白与叶酸反应动力学参数的报道。在仿生环境下,运用荧光分光光度计研究了叶酸和牛血清白蛋白相互作用时的三维荧光猝灭变化,同时运用停流光谱分析仪考察了不同温度、pH值和缓冲介质下牛血清白蛋白的荧光强度随叶酸浓度的动力学变化,计算出反应的表观动力学常数及速率常数,对叶酸新药的设计、筛选提供理论依据。
1 实验部分
1.1 仪器与试剂
F-4500荧光分光光度计(日本Hitachi公司),SFM-300/MOS-250停流动力学装置与光谱分析系统(法国比奥罗杰公司),Bio-Kine32V4.27动力学曲线模拟软件(法国比奥罗杰公司),PHS-25数显酸度计(上海精密科学仪器公司),ER-182A电子天平(上海天平仪器厂),TB-85水浴循环装置(日本岛津公司),PR020XXM1纯水机(北京PALL纯水公司)。
牛血清白蛋白(BSA)购自美国Sigma公司,叶酸(FA)购自Aladdin公司,低温避光保存。实验用水均为二次蒸馏水,实验测定所用缓冲液为磷酸缓冲液(PBS),其他试剂均为分析纯。
1.2 方法
1.2.1 荧光分光光度计实验
2 μmol·L-1的BSA和2 μmol·L-1的叶酸和一定量的缓冲液按不同比例混合置于水浴中充分反应,反应液中BSA的终浓度是0.4 μmol·L-1。取3 mL反应液加入到石英比色皿中测定荧光光谱,激发波长扫描范围为220~450 nm,发射波长扫描范围为290~550 nm。
1.2.2 停流光谱分析仪实验
50 μmol·L-1的BSA、缓冲液和50 μmol·L-1的叶酸分别注射到停流光谱分析仪的S1、S2和S3三个注射器中,实验中通过改变三个注射器中反应液的比例来控制叶酸的浓度和反应总体积,反应溶液中BSA的终浓度为12.50 μmol·L-1,叶酸浓度分别为0.00,6.25,12.50,18.75,25.00,31.25和37.50 μmol·L-1,激发波长为287 nm,发射波长为343 nm。实验过程中用停流光谱分析仪自带的恒温水浴装备来控制反应过程中的温度。
2 结果与讨论
2.1 BSA与叶酸相互作用三维荧光光谱分析
BSA中的Trp,Tyr和Phe残基能够发射内源荧光。生理温度下,三维荧光扫描结果显示280 nm的激发波长下,BSA在发射波长343 nm处有荧光峰,峰高为1 471[见图1(a)]。随着叶酸浓度的逐渐增加,BSA在343 nm处的发射波长保持不变,但此峰的荧光强度不断降低,当叶酸浓度达到1.2 μmol·L-1时,BSA的峰高降低到853,荧光强度减弱了42.01%[见图1(g)],说明叶酸对BSA内源荧光有猝灭作用。

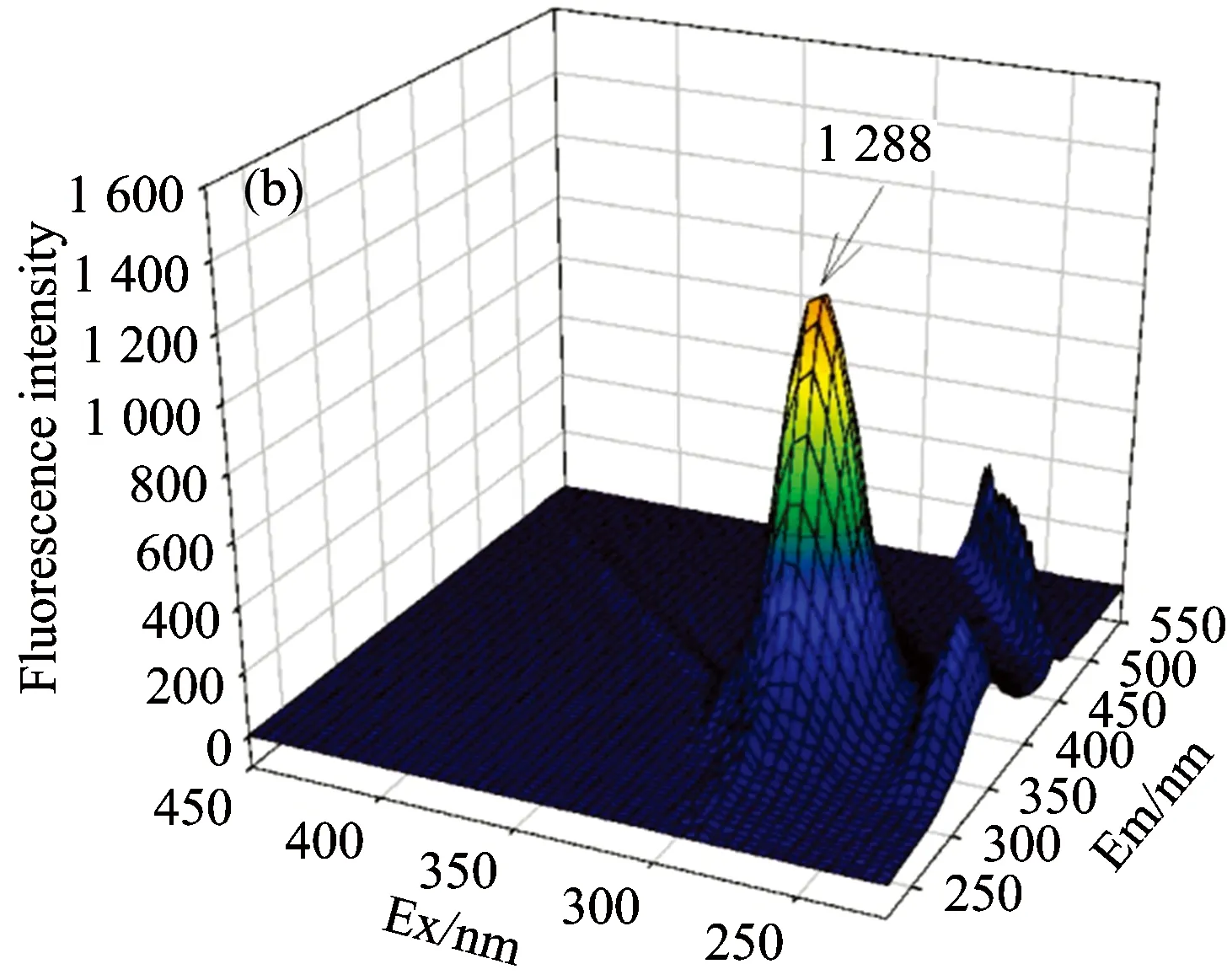

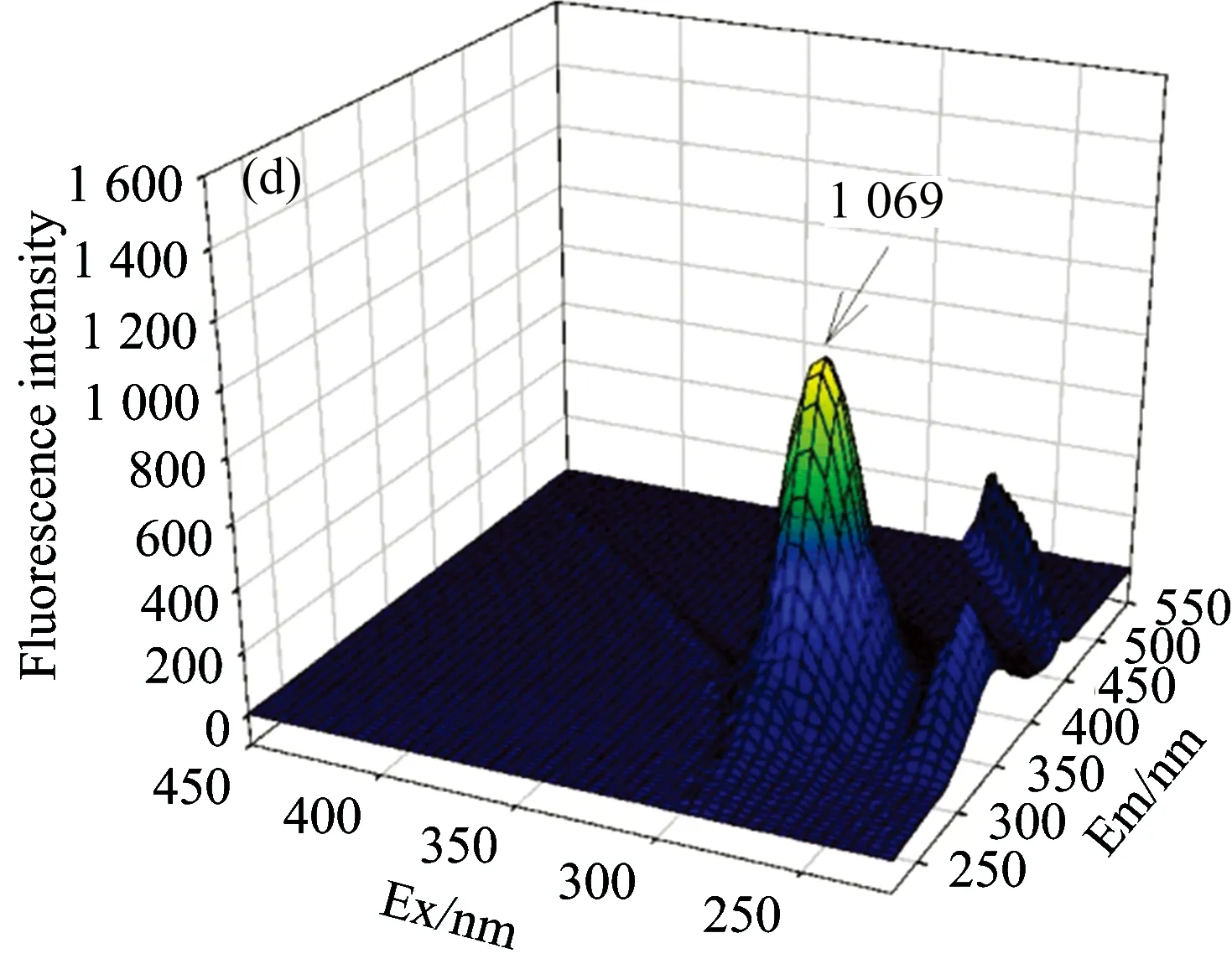

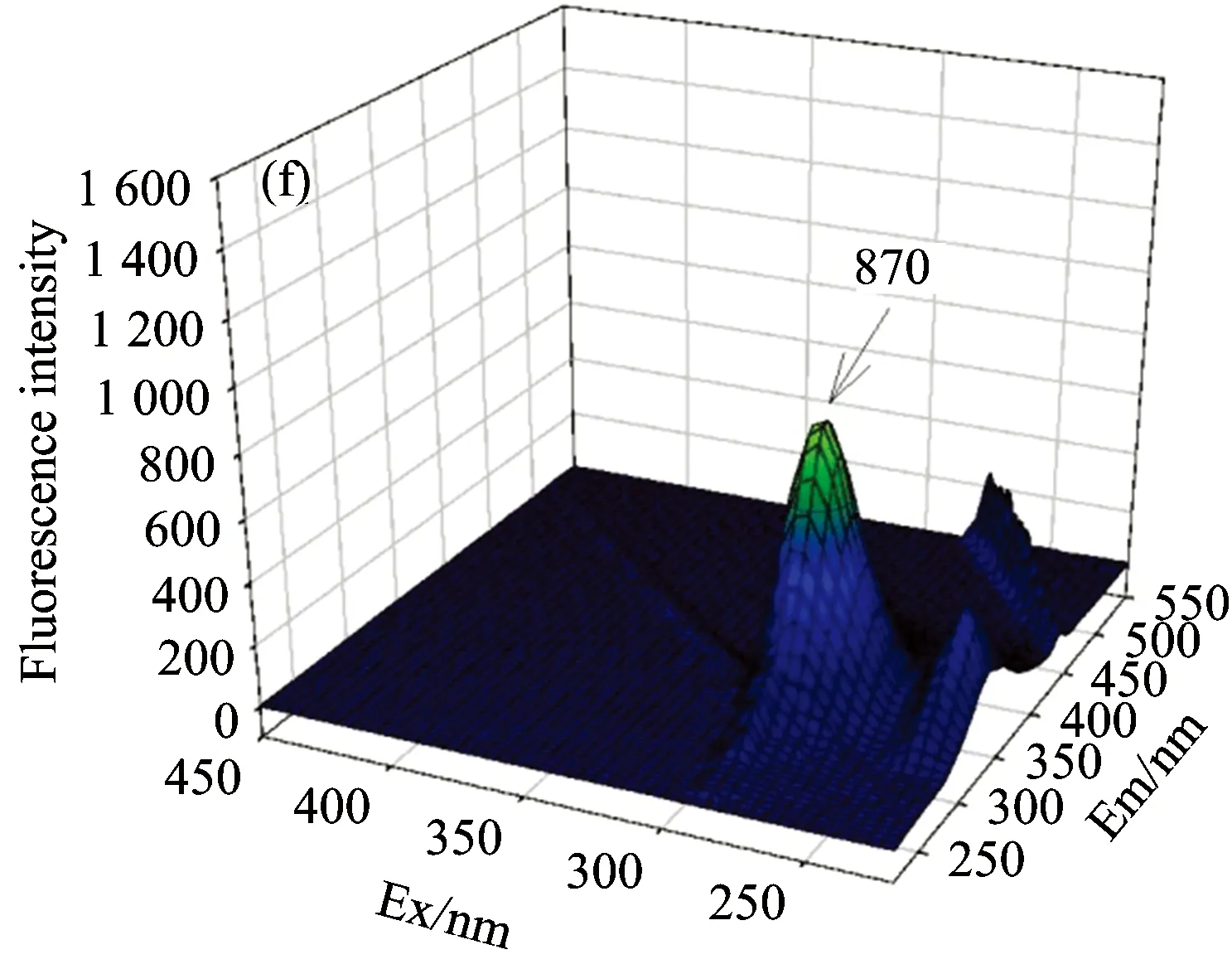

Fig.1 Fluorescence spectra of BSA with different folic acid concentration at 37 ℃
cFA(a): 0.0, (b): 0.2, (c): 0.4, (d): 0.6, (e): 0.8, (f): 1.0, (g): 1.2 μmol·L-1
25,30和37 ℃下BSA的三维荧光强度随叶酸浓度变化的考察结果显示:随着温度的升高,BSA的峰高降低得更加明显(图2),表明温度升高促进了叶酸对BSA的荧光猝灭。

Fig.2 Fluorescence intensity of BSA with different folic acid concentration at different temperature
假设叶酸对BSA的修饰作用是一个荧光动态猝灭过程,则由图2的F0/F结果根据Stern-Volmer方程式F0/F=1+Kqτ0[FA]做BSA荧光猝灭的曲线。实验数据线性拟合得到的直线斜率代表荧光猝灭过程速率常数Kq。随着叶酸浓度的增加,F0/F逐渐增大,且二者呈良好的线性关系。25,30和37 ℃下拟合得到直线斜率分别为:2.455×1010,4.900×1010和6.427×1010L·mol-1·s-1,线性相关系数分别为0.897 8,0.995 9和0.979 1。由数据可知,不同温度下,叶酸和BSA结合反应的Kq都远大于各种猝灭剂对生物大分子的最大扩散常数2.000×1010L·mol-1·s-1,且随着温度的升高,BSA荧光猝灭常数增大,表明叶酸对BSA内源荧光的猝灭过程不是由扩散和碰撞引起的动态猝灭,而是形成复合物的静态猝灭过程。
2.2 BSA与叶酸相互作用停流荧光光谱分析
固定BSA的浓度,改变叶酸的浓度,运用停流光谱分析仪扫描混合溶液的荧光光谱。生理温度下,BSA荧光光谱随叶酸浓度增大而变化的动力学曲线(图3)显示无叶酸加入时,BSA的荧光强度为5.25 a.u.,且随着时间的推移,BSA的荧光强度保持不变;随着叶酸的加入,BSA的荧光强度呈先逐渐下降后平稳趋势,且叶酸浓度越大,下降趋势越明显。当叶酸浓度为12.50 μmol·L-1时,BSA初始荧光强度为4.79 a.u.,反应结束时的荧光强度平稳在3.50左右,当叶酸浓度为37.50 μmol·L-1时,BSA的初始荧光强度为3.96 a.u.,反应结束时的荧光强度平稳在2.98 a.u.左右。说明叶酸分子使BSA的荧光发生了猝灭,且猝灭效应随着叶酸浓度的增大而增强。

Fig.3 Kinetic traces of BSA with different folic acid concentration in 37 ℃
cFAa: 6.25,b: 12.50,c: 18.75,d: 25.00,e: 31.25,f: 37.50 μmol·L-1)

用停流光谱分析仪自带的动力学曲线模拟软件Bio-Kine拟合出表观速率常数,见表1。由表1可见叶酸催化BSA分解的表观速率常数随着叶酸浓度的增加而呈线性增加趋势。
由停流动力学反应速率常数公式kobs=k0+kcat[catalyst]线性拟合得直线的斜率为kcat。不同温度下BSA和叶酸反应的速率常数拟合曲线见图4:温度为25 ℃时, BSA与叶酸反应的速率常数k=2.143×105mol·L-1·s-1,相关系数为0.989 1;温度为30 ℃时,k=2.721×105mol·L-1·s-1,相关系数为0.994 0;温度为37 ℃时,k=3.174×105mol·L-1·s-1,相关系数为0.992 5。结果表明,当温度升高,BSA与叶酸反应的速率加快,且反应速率在30和37 ℃比25 ℃分别加快26.97%和48.11%。由于BSA和叶酸的反应速率常数恒大于100 mol·L-1·s-1,进一步验证叶酸对BSA内源荧光的猝灭过程是形成复合物的静态猝灭过程。

Table 1 kobs of BSA with different folic acid concentration at different temperature

Fig.4 kcat of BSA and folic acid at different temperature
BSA分子由一条单独的氨基酸多肽链构成,其三级结构主要包含3个结构域,即SiteⅠ,SiteⅡ和SiteⅢ,其中SiteⅠ和SiteⅡ两个结构域与许多小分子化合物具有较强结合能力,其结构随溶液pH的改变会发生改变[14]。在生理温度下,测定了不同pH值的磷酸缓冲液下BSA与叶酸反应的动力学曲线,并用Bio-Kine软件拟合出表观速率常数(表2)。由数据可见,pH值会影响叶酸催化BSA分解的表观速率常数;不同pH值下,叶酸催化BSA分解的表观速率常数都随着叶酸浓度的增加呈线性增加,且中性环境下表观速率常数较大。
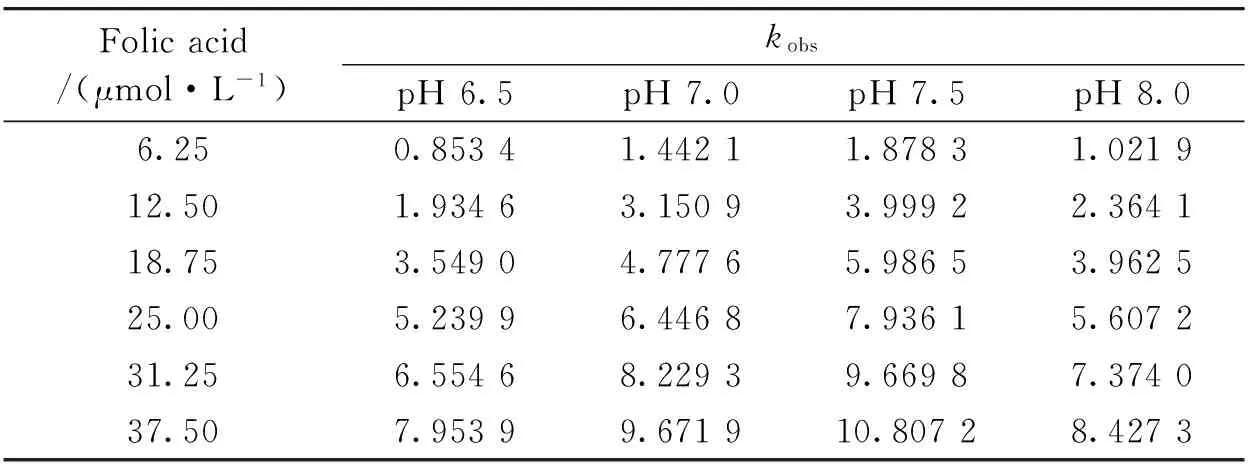
Table 2 kobs of BSA with different folic acid concentration in different pH
将表2数据代入公式kobs=k0+kcat[catalyst]拟合出不同pH值下BSA和叶酸反应的速率常数(图5):pH 6.5时,BSA与叶酸反应的速率常数k=2.201×105mol·L-1·s-1,相关系数为0.990 8;pH 7.0时,k=2.786×105mol·L-1·s-1,相关系数为0.996 1;pH 7.5时,k=2.953×105mol·L-1·s-1,相关系数为0.992 3;pH 8.0时,BSA与叶酸反应的速率常数k=2.391×105mol·L-1·s-1,相关系数为0.992 6。数据表明,生理温度下,磷酸缓冲液为中性时,BSA与叶酸的反应速率最快。BSA的荧光强度在微酸性和微碱性范围内发生改变会影响Trp的量子产率、质子解离作用及氨基酸的疏水性和能量传递等。由于BSA中Trp和Phe残基的非极性基团的疏水性比Tyr残基强,当反应体系偏酸性时Trp微环境的疏水性增强,BSA表面疏水性降低;偏碱性时部分Phe残基微环境的极性增强,将更多疏水性氨基酸残基暴露在水溶剂中。因此,在研究叶酸药物时,需要考虑到人体的pH微环境,以便达到人体对药物最大吸收值。
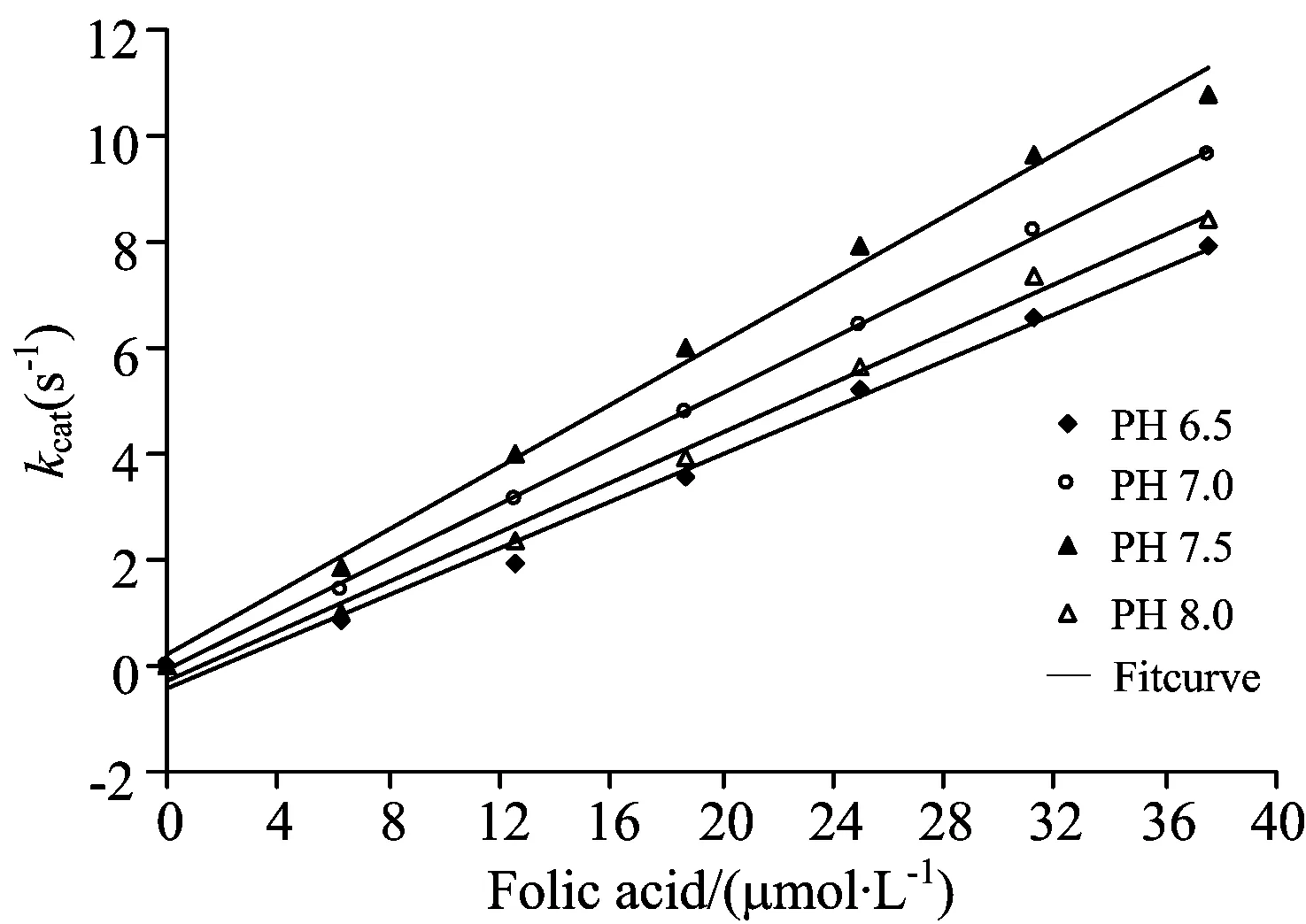
Fig.5 kcat of BSA and folic acid in different pH of PBS
人体血液和细胞液中含有多种盐类共同维持体内酸碱平衡,其中氯化钠溶液和重碳酸盐类是含量较多的两种。实验中分别测定了BSA与叶酸在0.9%氯化钠水溶液和25 mMNaHCO3水溶液反应的动力学曲线,并用Bio-Kine软件拟合出表观速率常数(表3)。结果显示水溶液中反应的表观速率常数相对NaCl和NaHCO3溶液较大。

Table 3 kobs of BSA with different folic acid concentration in different buffer solution
从各缓冲介质下BSA和叶酸反应的速率常数(图6)可以看出:含0.9% NaCl的水溶液,BSA与叶酸反应的速率常数k=2.748 8×105mol·L-1·s-1,相关系数为0.995 2;含25 mmol·L-1NaHCO3的水溶液,k=2.677×105mol·L-1·s-1,相关系数为0.992 8;水溶液,k=2.952×105mol·L-1·s-1,相关系数为0.989 5。生理温度下,BSA与叶酸在水溶液下的反应速率比生理介质NaCl和CO2溶液中的速率大15.7%和9.3%,说明NaCl和NaHCO3两种介质影响叶酸和BSA结合速率。由SiteⅡ更利于结合芳香酸类小分子,可以判断NaCl和NaHCO3两种分子应该是通过SiteⅠ位点与BSA的结合,由于叶酸也是结合在BSA的SiteⅠ位点,因此NaCl和NaHCO3两种分子和叶酸产生了竞争,降低了叶酸催化BSA的荧光猝灭速率。

Fig.6 kcat of BSA and folic acid in different buffer solution
3 结 论
运用荧光光谱技术和停流动力学研究了BSA与叶酸的相互作用。用Stern-Volmer方程处理荧光猝灭实验数据,得到25,30和37 ℃下叶酸对BSA的荧光猝灭常数(Kq值)分别为:2.455×1010,4.900×1010和6.427×1010L·mol-1·s-1;动力学反应速率常数的计算结果表明:不同温度、pH值和缓冲介质下BSA和叶酸反应的速率常数都大于100 mol·L-1·s-1,阐明了BSA与叶酸之间的猝灭机理是通过形成复合物的静态猝灭过程。此外,用积分速率方程对BSA和叶酸反应的停流动力学曲线进行分析,证实了BSA和叶酸的反应属于二级反应,并计算出仿生温度下的药代半衰期t1/2为0.059 s,且25,30和37 ℃下二级反应速率常数分别为2.143×105,2.721×105和3.174×105mol·L-1·s-1。
在研究叶酸药物时应该考虑到温度、pH值和生理介质对BSA与叶酸反应造成的影响。通过仿生药物动力学特征的研究,为确定临床用药方案、预测药物的疗效和毒性以及合理用药有着重要意义。
[1] HE Feng, GU Hai-yong, GONG Ding-xu, et al(何 锋,顾海勇,龚丁旭,等). Molecular Cardiology of China(中国分子心脏病学), 2012, 4: 249.
[2] YANG Jiang-fan, YANG Rong-wei, LI-Wei, et al(杨江帆,杨戎威,李 炜,等). Chinese Journal of Neonatology(中国新生儿科), 2007, 22(03): 129.
[3] FAN Jian, DING Liang-ru(樊 剑,丁良儒). China Foreign Medical Treatment(中外医疗), 2008, 23: 76.
[4] WU Mei-chun, WANG Chi(吴镁春,王 驰). Chinese Journal of New Drugs(中国新药), 2010, 7: 569.
[5] Green R, Jacobsen D W. New York: Marcel Dekker, 1995. 99.
[6] SHI Jian, LI Fen(石 建,李 芬). Chinese General Practice(中国全科医学), 2005, 8(18): 1551.
[7] Mikelsaar A V, Sunter A, Mikelsaar R, et al. Cell Div., 2012, 7(1): 21.
[8] Tracy C, Natasha K, Jeremy L, et al. Biochem. J. 2009, 420: 283.
[9] HU Tao-ying, CHEN Lin, LIU Ying(胡涛英,陈 琳,刘 颖). Spectroscopy and Spectral Analysis(光谱学与光谱分析),2014, 34(5): 1343.
[10] BAI Hai-xin, LIU Xiao-hua, YUAN Chao(白海鑫,刘小花,袁 超). Henan Science(河南科学), 2008, 26(12): 1477.
[11] DANG Yu-li, LIU Xiao-hua, BAI Hai-xin, et al(党玉丽,刘小花,白海鑫,等). Journal of Henan Agricultural University(河南农业大学学报), 2010, 44(05): 538.
[12] FU Cai-xia, GAO Zong-hua, WANG Hai-ying(付彩霞,高宗华,王海英). Chemical Research(化学研究), 2013, 24(01): 71.
[13] Niki S J, Nand K J. Chem. Thermodynamics, 2011, 43: 814.
[14] Christensen U, Holm J, Hansen S I. Biosci. Rep., 2006, 26(4): 291.
*Corresponding author
Study of Reaction Dynamics between Bovine Serum Albumin and Folic Acid by Stopped-Flow/Fluorescence
YE San-xian1, LUO Yun-jing1*, QIAO Shu-liang3, LI Li2, LIU Cai-hong2, SHI Jian-long1, AN Xue-jing1
1. College of Life Science and Bio-engineering, Beijing University of Technology, Beijing 100124, China
2. Chinese Aeademy of Inspection and Quarantine, Beijing 100123, China
3. Baotou Entry-Exit Inspection and Quarantine, Baotou 014010, China
As a kind of coenzyme of one-carbon enzymes in vivo, folic acid belongs to B vitamins, which can interact with other vitamins and has great significance for converting among amino acids, dividing growth of cells and protein synthesis reactions. Half-life, concentration and reaction rate constant of drugs are important parameters in pharmacokinetic study. In this paper, by utilizing fluorescence spectrophotometer and stopped-flow spectrum analyzer, reaction kinetic parameters between bovine serum albumin(BSA) and folic acid in a bionic system have been investigated, which provide references for parameters of drug metabolism related to folic acid. By using Stern-Volmer equation dealing with fluorescence quenching experiments data, we concluded that under 25, 30, and 37 ℃, the static quenching constants of folic acid to intrinsic fluorescence from bovine serum albumin were 2.455×1010, 4.900×1010and 6.427×1010L·mol-1·s-1respectively; The results of kinetic reaction rate have shown that the reaction rate of BSA and folic acid are greater than 100 mol·L-1·s-1at different temperatures, pH and buffering media, illustrating that the quenching mechanism between BSA and folic acid is to form composite static quenching process. Reaction concentration of bovine serum albumin and its initial concentration were equal to the secondary reaction formula, and the correlation coefficient was 0.998 7, while the half-life (t1/2) was 0.059 s at physiological temperature. With the increase of folic acid concentration, the apparent rate constant of this reaction had a linear increasing trend, the BSA fluorescence quenching rate constant catalyzed by folic acid was 3.174×105mol·L-1·s-1. Furthermore, with different buffer, the apparent rate constant and reaction rate constant of BSA interacting with folic acid were detected to explore the influence on the reaction under physiological medium, which is of great significance to determine the clinical regimen, forecast the efficacy and toxicity of drugs and rational drug.
BSA (Bovine Serum Albumin); Folic acid; Fluorescence spectra; Kinetic parameter
Oct. 10, 2014; accepted Jan. 25, 2015)
2014-10-10,
2015-01-25
北京市教育委员会科技计划面上项目(KM201210005032)和北京市自然科学基金项目(2102005)资助
叶三仙, 女,1988年生,北京工业大学生命科学与生物工程学院硕士研究生 e-mail: 450212535@qq.com *通讯联系人 e-mail: luoyj@bjut.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)01-0134-06

