基于共聚焦显微拉曼的真菌菌丝中几丁质的原位检测研究
李晓丽,罗榴彬,周斌雄,胡小倩,孙婵骏,何 勇*
1. 浙江大学生物系统工程与食品科学学院,浙江 杭州 310058 2. 浙江大学农业试验站,浙江 杭州 310058
基于共聚焦显微拉曼的真菌菌丝中几丁质的原位检测研究
李晓丽1,罗榴彬1,周斌雄1,胡小倩2,孙婵骏1,何 勇1*
1. 浙江大学生物系统工程与食品科学学院,浙江 杭州 310058 2. 浙江大学农业试验站,浙江 杭州 310058
几丁质是真菌细胞壁中一种重要的结构多糖,本文首次采用共聚焦显微拉曼技术对山茶刺盘孢菌的气生菌丝进行原位检测研究,首先确定了采集菌丝拉曼光谱的最优实验参数,并获得了菌丝,几丁质标准品和背景三种物质的典型拉曼光谱,对其中的特征峰进行归属分析,发现菌丝光谱中有明显的几丁质特征峰。然后对置于载玻片上菌丝的感兴趣区域进行拉曼光谱面扫描,通过主成分分析法发现面扫描区域中,菌丝和背景两种信号可以明显区分开来,结合主成分的载荷因子图得到了菌丝的两个主要的特征差异峰1 622和1 368 cm-1,1 622 cm-1属于菌丝中几丁质的特征峰,而1 368 cm-1是来源于菌丝中的果胶多糖。最后通过对几丁质在1 622 cm-1特征峰波段附近范围积分,绘制了几丁质在菌丝中二维和三维的化学成像图,直观且无损的再现了几丁质在菌丝中的空间分布。
几丁质;真菌菌丝;共聚焦显微拉曼;主成分分析;化学成像
引 言
植物真菌病害是危害农业生产的主要病害, 发病率高(70%~80%),病害种类最多,造成的损失也最大[1]。真菌感染农作物的过程,事实上是真菌与作物的一个互相影响的过程,了解两者的互作机制对预防真菌病害有重要意义。
对真菌菌丝进行定性识别和定位检测是研究和揭示真菌致病机制的关键。传统真菌检测的方法主要有两种,一种是植物病害制片技术,普通切片可以在光学显微镜下观察,通过对染病组织进行染色,使得被观察的真菌显像清楚[2-3]。超薄切片需要电子显微镜下观察,可以研究真菌更细微的形态特征以及与植物组织细胞更为密切的关系[4-5]。但是制片技术操作繁琐,最重要的是在大量使用各种化学试剂之后,植物细胞和真菌已经丧失了活力。另一种检测技术是荧光蛋白标1记法[6-7],通过在真菌中插入荧光蛋白分子,借助荧光显微镜,可对活细胞进行实时动态的追踪[6],近几年来在微生物与植物之间的相互作用方面有较多的应用。但是对真菌进行荧光蛋白标记操作复杂,且插入的这段蛋白对真菌本身的影响尚不明确。
共聚焦显微拉曼光谱技术是拉曼光谱与显微技术的有机结合,它不仅具有常规拉曼光谱快速无损、样品需求量小,无需预处理等显著特点,辅以高倍光学显微镜,还能对微观物体进行高空间分辨率(<1 μm)的信号采集。随着空间分辨率的不断提高,使得拉曼光谱对单个细胞的研究成为可能,因此近几年在微生物学方面的研究也已有涉足,如白腐菌及其代谢产物的研究[8],酿酒酵母[9]的分类鉴别,微量元素对芽孢杆菌孢子产生内生孢子的影响[10],细胞色素在菌丝中分布[11]等。因此,用共聚焦显微拉曼光谱技术对真菌菌丝进行研究是一种全新且可行的手段。
几丁质作为一类纤维状物质,是自然界中存在的唯一碱性同聚多糖[12],存在于大多数真菌的细胞壁中,能够增加细胞壁的机械强度[13]。几丁质处于丝状真菌细胞壁最内层,靠近质膜层,是真菌菌丝尖端延长部位的主要组分,因此真菌菌丝的生长与几丁质的生成关系密切[12]。1988年,Roberts利用近红外光谱法检测了高羊茅组织中的几丁质,并测定了内生真菌的含量,发现组织中几丁质的含量与内生真菌感染程度相关性较高(校准系数和变异系数分别为0.86和0.84)[14]。由此可见几丁质的信号可以作为真菌存在与否的标记之一,是确定真菌的一种可靠方法。而共聚焦拉曼光谱技术在几丁质方面的研究已有相关报道,如对珊瑚中几丁质的研究[15],几丁质及其乙酰化衍生物的研究[16],以及对真菌细胞壁中几丁质定量分析的研究[17]等。但是对真菌菌丝中的几丁质进行定性分析,以及对几丁质在菌丝中的分布规律的定位研究,还未见报道。而此类对真菌菌丝中的几丁质进行的全面分析,是为后续以几丁质为线索,研究病菌的侵染机制的必要前提。
山茶刺盘孢菌(ColletotrichumcamelliaeMassee)是茶树云纹叶枯病的病原菌,属于半知菌亚门刺盘孢属。是一种有隔的丝状真菌,分生孢子长椭圆形或长卵形[1]。本文以该种菌属为例,首次采用共聚焦显微拉曼光谱原位检测山茶刺盘孢菌菌丝的拉曼响应特性,并着眼于菌丝中几丁质的研究,以期还原几丁质在真菌菌丝中的空间分布,探索菌丝中不同部位几丁质含量的分布规律。并为下一步以几丁质作为真菌的检测信号来研究植物-真菌互作机制打下基础。
1 实验部分
1.1 菌丝的准备
山茶刺盘孢菌由浙江大学农业试验站提供。保存在4℃冰箱里,然后依据王志坤[18]论文中所述方法进行活化处理,培养基为马铃薯葡萄糖琼脂培养基(PDA),光照条件下25 ℃培养约5天后,气生菌丝稀疏,呈灰白色绒状。用灭过菌的镊子挑取部分气生菌丝到一片干净的载玻片上。在拉曼仪配套的Leica显微镜下观察,50倍物镜镜头下的菌丝状态如图1所示。
1.2 几丁质标准品
几丁质(Chitin),别名Poly-(1→4)-β-N-acetyl-D-glucosamine,购于sigma公司,产品编号C9752。来源于虾壳,是高纯度粉末状固体。

Fig.1 Optical microscope images of Colletotrichum camelliae Massee hypha under 50×
1.3 拉曼光谱采集
本研究采用的拉曼仪是英国生产的雷尼绍显微共聚焦拉曼光谱仪(inVia-Reflex 532/XYZ)。配备固体激光器532 nm,最大激光功率为50 mW。将放置有菌丝的载玻片固定在载物台上,激光束通过50X的物镜聚焦到样本的表面。在菌丝上选定一个感兴趣区域进行拉曼光谱的面扫描,如图2所示。面扫描区域一共包括110(11×10)个点,横纵步长都为1.2 μm,每点采集的激光曝光时间为10 s,激光功率是0.5 mW,采集次数为一次,拉曼位移范围为3 200~200 cm-1,整个实验过程都是在恒温(约25 ℃)条件下进行的。图2(a)中的黑色小方框内区域即为面扫描区域,图2(b)是其放大示意图,可以看到扫描区域包括菌丝和背景两部分。图2(c)是所有110个样本点的拉曼光谱图。图2(d)是面扫描区域中第一行的11个样本点处的拉曼光谱图。

Fig.2 (a) Optical microscope images of scanning region(Rectangular box); (b) Cube figure of Raman acquisition; (c) Raman spectra of all sampling points; (d) Raman spectra of first row in the scanning region
1.4 几丁质拉曼光谱的采集
几丁质标准品的拉曼光谱获取采用跟真菌同样的仪器参数,即10秒曝光时间,0.5 mW激光功率,连续采集6个点,取平均值作为几丁质标准品的拉曼光谱。
2 结果与讨论
2.1 菌丝拉曼信号采集的参数优化研究
样本拉曼光谱采集的参数优化是获取高质量谱线的关键。褚立强用拉曼光谱研究木质纤维素类植物的时候,发现在激光的照射下,木质素在1 601 cm-1左右的特征峰强会随着激光照射时间的延长而逐渐减弱。这是由于木质素的光降解引起的[19]。因此在研究真菌菌丝的拉曼信号之前,首先要确定真菌的拉曼信号是否也存在一个光降解的过程。
影响激光光强有两个参数,激光功率和曝光时间。由于真菌是生物样本,此类样本的特点是拉曼信号相对较弱,且样本容易被激光所灼伤。因此在尽量凸显信号又不烧坏样本的前提下,经过反复尝试优化,设定激光功率为0.5 mW。接下来确定曝光时间,由于采集的范围200~3 200 cm-1属于全谱扫描,因此最短的曝光时间是10 s。图3是菌丝上的某一采样点在不同曝光时间下的拉曼光谱图,一共有15条光谱,从下往上激光照射时间逐渐增长。第一条光谱的曝光时间为10 s,第二条为20 s,第三条30 s,以此类推,第十五条为150 s。从图中可以看到,随着激光照射时间的不断增长,光谱的最大拉曼强度值在不断增加,第十五条光谱的最大拉曼强度值是第一条光谱最大拉曼强度值的4倍左右。谱线中位于1 622 cm-1处的峰最为明显,且在15条光谱中一直存在。从图3中也可以看到,1 622 cm-1处的峰的峰强值也是呈一个逐渐上升的趋势。
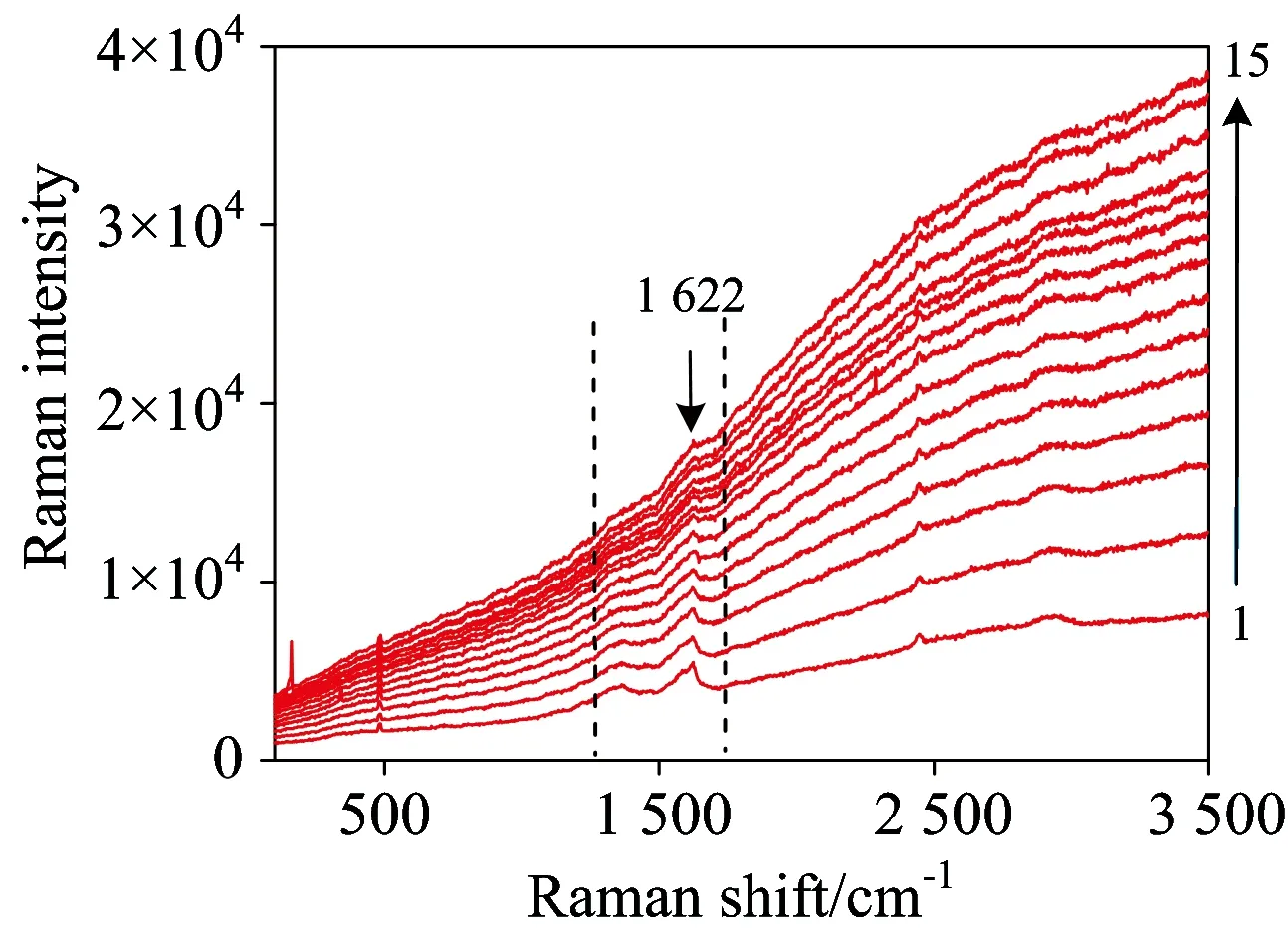
Fig.3 Comparison of Raman spectra of raw Colletotrichum camelliae Massee for various laser exposure time (acquisition time of each spectrum: 10 s)
由于峰的绝对高度值会受到背景,仪器信号的干扰,因此接下来用相对峰值来进行说明。在上述不同曝光时间下,通过1 622 cm-1处的峰值与所有波段200~3 200 cm-1的峰高之和的比值变化来说明菌丝的特征峰是否存在一个光降解过程。结果如图4所示。从图4中可以看到随着激光的照射时间的不断增长,1 622 cm-1处的相对峰强在逐渐减弱。这是因为激光的曝光时间越长,荧光包越大,背景信号的干扰越大,虽然1 622 cm-1处的峰的绝对高度在上升,但是这个峰的升高是由于荧光增强引起的。而且可以看到1 622 cm-1处的相对峰值基本上是呈一个指数下降的趋势,第一点和第二点之间的变化最为明显。说明前20 s之内真菌的拉曼信号会急剧减弱,随后减弱趋势比较缓和。因此在前面设置实验参数的时候曝光时间设定为10 s。

Fig.4 Relationship between exposure time and relative Raman intensity of 1 622 cm-1
2.2 菌丝典型拉曼光谱分析
首先选取面扫描区域内位于菌丝上的一采样点,提取其拉曼光谱信号。由于真菌样本是置于载玻片上,并且处在一个和外界相连的环境下进行测量的,因此会有一系列的背景信号会对真菌的信号产生干扰,包括承载菌丝的载玻片信号,电脑显示器光源信号,以及空气信号等。因此同时也选取位于载玻片上但远离菌丝的一点拉曼光谱作为背景信号用于与真菌信号进行对比。最后还采集了几丁质标准品的拉曼信号。三种物质的拉曼光谱图如图5所示,黑色,红色和蓝色的谱线分别是几丁质,真菌和背景的信号。三条拉曼光谱都是经过WIRE3.3软件中基线校正和归一化功能预处理过的。

当然菌丝中的拉曼信号中除了几丁质,还包括一些多糖、蛋白质和脂肪等,比如在1 444 cm-1的峰也出现在脂肪的拉曼光谱中[22],1 368 cm-1的峰属于果胶多糖[21],而蛋白质中的氨基在1 600 cm-1多也有很多特征峰[22]。
背景的拉曼峰如蓝色线所示,可以看到主要有两个较高的峰对样本有干扰,分别是481和2 447 cm-1。这两个峰在不放置任何样本的时候,也会出现,因此可能是空气[23]或者系统自带的噪声。表1对真菌中出现的属于几丁质的特征峰所对应的振动基团做出了总结。

Fig.5 Raman spectra of chitin, Colletotrichum camelliae Massee and background

Table 1 Raman bands assignment in hyphae
2.3 PCA聚类分析
通过菌丝典型谱线的分析,发现了菌丝中的特征峰,为了对所有菌丝样本的谱线有整体的认识,采用主成分分析法对全部110个样本的拉曼光谱进行了统计分析。由于菌丝的扫描区域包含了真菌和背景两种信号,如图2(b)中所示,显然这两种物质的信号是明显不同的。可以粗略的从图2(d)中看到,两种物质的拉曼强度有高低,拉曼的特征峰位置也不一样。首先根据光学显微镜下面扫描区域图,将这110个点分成两类,一类是位于菌丝上的点,一共有37个点;另一类是位于载玻片上的点,有73个点。然后将这110条拉曼光谱用主成分分析法PCA进行统计分析。结果如图6所示,可以看到样本在主成分空间分布呈现两种状态,一类比较密集的蓝色点是背景的信号,一类比较疏散的红色点是菌丝的信号。由于背景信号主要由玻璃、空气、光线等无机物组成,

Fig.6 PCA scores plot of Raman spectra from all 110 sampling points
在空间的分布比较均匀,因此信号相对稳定,重复性高,所以呈密集分布。而菌丝作为生物组织,存在多样性,因此在空间上的分布是多变的,所以信号比较分散,在得分图中分布稀疏。
由于用前两个主成分能够解释原始光谱中99%以上的信息,而且背景和菌丝的两种样本在主成分1和主成分2空间里分界线清晰,表明前两个主成分分量能够很好的反映两类样本的根本差异。而主成分分量与原始拉曼光谱数据的关系可以通过载荷因子来体现,所以分析主成分分量的载荷因子将有助于揭示两类样本的光谱特征差异,主成分1和主成分2的载荷因子图如图7所示,载荷因子图中权重系数大的峰即是影响该主成分分量的主要因子。从图7中可以看到,拉曼位移在481,1 368,1 622和2 447 cm-1对应峰是影响主成分2的主要因子,而主成分1上明显的峰仅有1 622 cm-1。用载荷因子图分析的出来的这些峰恰恰都是前面对原始光谱分析中真菌和背景最主要的几个信号位置。表明这四个峰是反应菌丝和背景特性的特征峰,其中以1 622 cm-1处的峰最为明显,可以作为ColletotrichumcamelliaeMassee真菌中几丁质的特征峰。

Fig.7 Loading weight plot of the first two principal components
2.4 几丁质的化学成像分析
化学成像是基于分子或化学成分所对应的特征光谱频率实现该分子或化学成分的定性、定量分析,同时结合空间信息还可以实现定位分析。是对样本光谱和空间信息的同时测量来获取其分子或化学成分分布的一种可视化分析,目前化学成像技术已经广泛应用于生物分析和技术领域。基于几丁质在1 622 cm-1波数附近的特征拉曼光谱对气生菌丝中几丁质进行化学成像分析,化学成像过程如图8所示。图8(a)是菌丝在光学显微镜下的图像,也是此次采集拉曼光谱的感兴趣区域。图8(b)是拉曼成像光谱的积分范围,也是成像最关键的一步,我们以1 622 cm-1为中心,对1 620~1 625 cm-1波数范围内的拉曼强度进行积分,然后对气生菌丝上各点在该波数范围的积分进行二维成图分析,得到如图8(c)所示的气生菌丝中几丁质的分布图,可以看到几丁质在空间的分布和显微镜下菌丝的形状基本上吻合,一方面说明化学成像图反应的的确是菌丝的信号,另一方面也说明了几丁质几乎覆盖了整个菌丝,这也恰恰验证了几丁质是真菌细胞壁的一种重要成分。然后根据右边的颜色棒,从黑色到红色到黄色到白色的过程中,拉曼强度值在不断上升,也就是说对应的几丁质含量在增加。图8(c)中,有一根主杆菌丝和两根分支菌丝,可以看到几丁质在主杆菌丝上分布较多,且在分支点处含量最多,而两根分支菌丝上的几丁质含量相对较少。分支菌丝由于是从主杆菌丝上分化而来,生成时间较主杆菌丝短,因此细胞壁中几丁质的积累量没有主杆菌丝上的多。而分支点上高含量的几丁质可能是因为菌丝从这个点分化出去,需要有一定的支撑量,而几丁质作为一种结构多糖,在维持细胞壁的形态,菌丝结构方面有重要作用[13],因此富集在这个分支点,对分支菌丝起到了一定的支撑作用。几丁质在这个菌丝分支区域的含量分布非常类似于Walter在研究细胞色素在菌丝分支区域的分布规律[11],细胞色素同样也是富集于分支点。因此可以猜想菌丝的分支区域是一个能量的富集中心。图8(d)是几丁质在菌丝中分布的三维图像,可以更加直观的看到几丁质在菌丝中的分布。
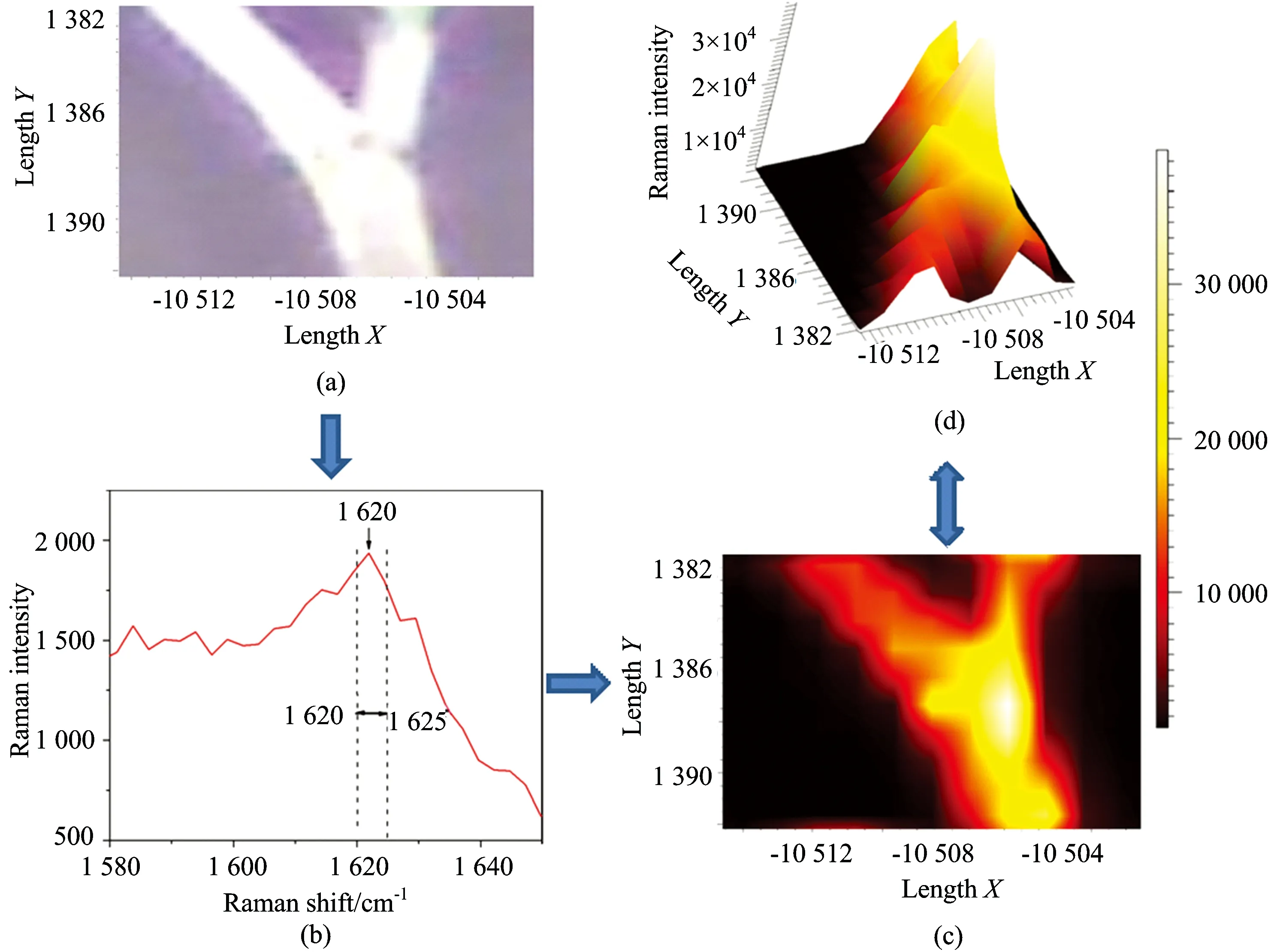
Fig.8 Chemical images of Colletotrichum camelliae Massee on the chitin Raman bands (1 620~1 625 cm-1)
3 结 论
采用共聚焦显微拉曼光谱技术研究了山茶刺盘孢菌菌丝的典型拉曼光谱,分析发现菌丝中存在明显的几丁质特征拉曼指纹谱带,并进一步结合数学方法验证了这些特征谱段具有统计学意义,基于1 622 cm-1处的指纹谱带能够实现山茶刺盘孢菌菌丝的定性分析。同时基于这些特征峰以及菌丝的微观图像信息绘制出了几丁质在菌丝中的化学成像图,分析发现几丁质分布在整个菌丝中,并且在菌丝的分支点处含量最多,分支后的菌丝中的几丁质含量比原先菌丝上几丁质的含量少一些。本研究表明采用共聚焦显微拉曼光谱技术,利用山茶刺盘孢菌中几丁质的特征峰,可以实现真菌的定性定位分析,并获得了几丁质在菌丝中的空间分布图。为后续研究植物-真菌互作机制提供了新的视角。
[1] YE Gong-yin(叶恭银). Plant Protection(植物保护学). Zhejiang: Zhejiang University Press(浙江:浙江大学出版社),2006.
[2] YU Zhong-dong, LI Yan, LI Deng-wu(余仲东, 李 琰, 李登武). Journal of Wuhan Botanical Research(武汉植物学研究), 2005, 23(6): 588.
[3] LU Xiao-hong, ZHU Shu-sheng, LIU Xi-li(卢晓红, 朱书生, 刘西莉). Acta Phytopathologica Sinica(植物病理学报), 2009, 39(4): 435.
[4] QUE You-xiong, SONG Xian-xian, XU Li-ping, et al(阙友雄,宋弦弦,许莉萍, 等). Letters in Biotechnology(生物技术通讯), 2009, 20(2): 282.
[5] LI Ai-zhen(李爱贞). Thesis of Doctor Degree of Agricultural University of Hunan(湖南农业大学博士研究生学位论文), 2000.
[6] PAN Hong, LEI Zhen-zhen, XU Ke-jing, et al(潘 虹, 雷珍珍, 许可静, 等). Guangdong Agricultural Sciences(广东农业科学), 2012, 3: 150.
[7] Czaikowski R, deBoer W J, Velvis H, et al. The American Phytopathological Society, 2010, 100(2): 134.
[8] Yamashita H, Tsubokawa S, Endo A, et al. The Journal of Antibiotics, 1985, 38: 605.
[9] Rodriguez S B, Thornton M A, Thornton R J. Applied and Environmental Microbiology, 2013, 79: 6264.
[10] Stockel S, Meisel S, Bohme R, et al. Journal of Raman Spectroscopy, 2009, 40: 1469.
[11] Walter A, Erdmann S, Bocklitz T, et al. Analyst, 2010, 5: 908.
[12] DAI Yang-yong, CAO Jian, LI Lang, et al(代养勇, 曹 健, 李 浪, 等). Journal of Zhengzhou Institute of Technology(郑州工程学院学报), 2004, 25(3): 88.
[13] ZHOU De-qing(周德庆). Microbiology(微生物学). Beijing: Higher Education Press(北京:高等教育出版社), 2002.
[14] Roberts C A, Barton F E, Moore K J. Agronomy Journal, 1988, 80: 737.
[15] Bo M, Bavestrello G, Kurek D, et al. International Journal of Biological Macromolecules, 2012, 51: 129.
[16] Zhang K, Geissler A, Fischer S, et al. Journal of Physical Chemistry B, 2012, 116: 4584.
[17] Lee C M, Cho E M, Yang S I, et al. Bulletin of the Korean Chemical Society, 2013, 34(3): 943.
[18] WANG Zhi-kun, TAN Wan-zhong, ZHANG Ke-cheng, et al(王志坤, 谭万忠, 张克诚, 等). Henan Agricultural Science(河南农业科学), 2008, 4: 67.
[19] Chu L Q, Masyuko R, Sweedler J V, et al. Bioresource Technology, 2010, 101: 4919.
[20] Szymańska-Chargot M, Cybulska J, Zdunek A. Sensors, 2011, 11(6): 5543.
[21] Himmelsbach D S, Akin D E. Journal of Agricultural and Food Chemistry, 1998, 46(3): 991.
[22] Schulz H, Baranska M. Vibrational Spectroscopy, 2007, 43(1): 13.
[23] LIU Chang-ling, YE Yu-guang, LU Hai-long, et al(刘昌岭, 业渝光, 卢海龙, 等). Geoscience(现代地质), 2008, 22(3): 480.
[24] Gussem K D, Vandenabeele P, Verbeken A, et al. Spectrochimica Acta Part A, 2005, 61: 2896.
[25] Martin R, Hild S, Walther P, et al. The Biological Bulletin, 2007, 213(3): 307.
*Corresponding author
In Vivo Study of Chitin in Fungal Hyphae Based on Confocal Raman Microscopy
LI Xiao-li1,LUO Liu-bin1,ZHOU Bin-xiong1, HU Xiao-qian2,SUN Chan-jun1,HE Yong1*
1. College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China
2. Agricultural Experiment Station, Zhejiang University,Hangzhou 310058,China
Chitin is an important structural polysaccharide of fungal cell wall. In this paper, aerial hyphae ofColletotrichumcamelliaeMassee was first studied by confocal Raman microscopy in vivo. Firstly, the optimal experimental parameters of hyphae for collecting the Raman spectra were determined, and the typical Raman spectra of hyphae, chitin standard and background were acquired. By comparing analysis, characteristic peaks of chitin were found in hyphae. Then, a region of interesting on hyphae was selected for Raman scanning. Through principal component analysis, the Raman signal of hyphae and background in the scanning area can be separated clearly. Combined with loading weight plot, two main characteristic peaks of hyphae were obtained, 1 622 cm-1was belong to chitin and 1 368 cm-1was assigned to pectic polysaccharide. Finally, two and three dimension chemical images of fungal hyphae were realized based on Raman fingerprint spectra of chitin in a nondestructive way.
Chitin; Fungal hyphae; Confocal Raman microscopy; Principal components analysis; Chemical imaging
Aug. 12, 2014; accepted Dec. 10, 2014)
2014-08-12,
2014-12-10
浙江省公益性技术应用研究计划项目(2014C32091),国家自然科学基金项目(61201073, 31471417)资助
李晓丽,女,1982年生,浙江大学生物系统工程与食品科学学院副教授 e-mail: xiaolili@zju.edu.cn *通讯联系人 e-mail: yhe@zju.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)01-0119-06
- 光谱学与光谱分析的其它文章
- Determination of Component Contents of Blend Oil Based on Characteristics Peak Value Integration
- Identification of Haploid Maize Kernel Using NIR Spectroscopy in Reflectance and Transmittance Modes: A Comparative Study
- 基于光谱吸收法和荧光法的甲烷和二氧化硫检测系统的研究
- 基于TDLAS-WMS的痕量甲烷气体检测仪
- 推扫误差对计算光谱成像数据重构的影响分析
- ICP-MS用于云南南部四种特色蜂蜜的植物源鉴别分析

