七种牛肝菌的红外光谱鉴别
马殿旭, 刘 刚, 欧全宏, 于海超, 李会梅, 刘 艳
云南师范大学物理与电子信息学院, 云南 昆明 650500
七种牛肝菌的红外光谱鉴别
马殿旭, 刘 刚*, 欧全宏, 于海超, 李会梅, 刘 艳
云南师范大学物理与电子信息学院, 云南 昆明 650500
运用傅里叶变换红外光谱、 二维相关谱及主成分分析对7种同属牛肝菌进行分析鉴别。 结果显示: 7种牛肝菌的原始光谱总体特征相似, 主要由蛋白质、 多糖等的吸收峰组成, 但在吸收峰强度、 位置仍存在差异。 对样品进行二维相关红外光谱分析, 在二维相关红外光谱1 680~1 300 cm-1范围内, 茶褐牛肝菌和双色牛肝菌出现了6个明显的自动峰; 小美牛肝菌出现了5个明显的自动峰; 灰褐牛肝菌和美柄牛肝菌出现4个明显自动峰; 美味牛肝菌和铜色牛肝菌自动峰相对较少, 只出现了3个明显的自动峰; 而且自动峰和交叉峰的强度、 位置也存在较大差异。 同样在二维相关红外光谱1 150~920 cm-1范围内, 不同牛肝菌的同步谱中自动峰和交叉峰的数量、 强度和位置也不同。 对光谱1 800~800 cm-1范围内的二阶导数进行主成分分析, 所有样品均区分开, 其分类正确率达100%。 结果表明, 傅里叶变换红外光谱结合二维相关红外光谱或者主成分分析可以有效地区分茶褐牛肝菌、 小美牛肝菌、 双色牛肝菌、 灰褐牛肝菌、 美柄牛肝菌、 美味牛肝菌和铜色牛肝菌。 该方法对于分类鉴别蘑菇是一种快速、 准确、 有效的方法。
牛肝菌; 傅里叶变换红外光谱(FTIR); 二维相关红外光谱(2D-IR); 主成分分析(PCA); 鉴别
引 言
牛肝菌(Boletus)是真菌系担子菌亚门(Basidiomycetes)层菌纲(Hymenomycetes)牛肝菌目(Boletales)的重要类群。 牛肝菌目包含有牛肝菌科(Boletaceae)、 小牛肝菌科 (Boletinellaceae)和圆牛肝菌科 (Gyroporaceae)等18个科, 我国牛肝菌科中包含有牛肝菌属(Boletus)、 疣柄牛肝菌属(Leccinum)、 粉孢牛肝菌属(Tylopilus)和绒盖牛肝菌属(Xerocomus)等16个属[1, 2]。 在牛肝菌属中多数牛肝菌肉质肥厚, 是名贵稀有的野生药食用菌, 其子实体内富含多种氨基酸、 维生素、 矿质元素和活性多糖等人体所需的营养成分, 且牛肝菌香味浓郁, 味道鲜美, 深受人们喜爱, 同时牛肝菌中富含的多糖和碱性蛋白提取物具有增强人体免疫力、 抗肿瘤、 抗病毒等功效, 因此具有很高的食用价值和药用价值[3]。 目前, 我国牛肝菌种类多达390种以上, 其中有199种可食用; 云南是我国牛肝菌种类最为丰富的地区之一, 已知牛肝菌种类有224种, 其中可食用的有144种[4]。
牛肝菌种类繁多, 包含较多毒牛肝菌, 新鲜的牛肝菌外观比较相似, 难以通过外观特征来进行区分是否可食, 而且大量可食牛肝菌都是切片干燥后储存, 干片牛肝菌形态特征消失, 更难进行分辨, 因此准确、 快速地鉴别牛肝菌对其开发、 利用等有着重要意义。 目前, 对蘑菇的研究主要侧重蘑菇的多肽类和多糖等成分的提取及其生物活性、 蘑菇的营养价值和药用价值、 蘑菇的加工保存, 以及对蘑菇的生长条件等方面的研究。 如Liu等[5]对鸡腿菇中所提取的多糖结构以及抗肿瘤活性进行了研究, Heleno等[6]对波兰的三种食用蘑菇的营养价值、 生物活性物质和抗氧化性能做了研究, Wrona等[7]用一种新活性包装对蘑菇的保存进行了研究, Ostos等[8]对野生蘑菇的汞含量以及摄入量进行了研究。
对于蘑菇的种类鉴别主要通过应用化学分析、 色谱、 质谱等分析方法进行研究, 如Malheiro等[9]用顶空萃取和气相色谱质谱技术对野生蘑菇的特征挥发物进行研究, 从而对蘑菇种类进行鉴别; 刘芳等[10]用分子标记技术对草原野生食用菌蒙古口蘑进行了鉴别分析; 杨天伟等[4]用紫外光谱结合欧氏距离和主成分分析法对牛肝菌种类进行了鉴别分析; 这些分析方法需对样品进行提取分离, 分析时间长, 分析过程复杂等。
傅里叶变换红外光谱技术具有不破坏真菌样品化学结构, 能反映出真菌的组成物质, 具有用量少, 操作简单等优点[11]。 FTIR光谱技术已广泛应用于不同领域, 如Bombalska等[12]用FTIR和统计分析为危险生物材料的鉴别区分提供了一种新方法; Shen等[13]用FTIR对中国米酒的糖和酸进行了预测; 周在进等[14]用FTIR技术对云南省5个不同产地的58个野生双色牛肝菌和5个不同产地的63个野生小美牛肝菌进行了鉴别分类研究; 时有明等[15]用FTIR技术结合统计分析方法对松茸和姬松茸以及红黄鹅膏菌原亚种和其黄褐变种进行了鉴别分析。
二维相关红外光谱引入了外界微扰, 将光谱信号扩展到第二维上以提高光谱分辨率, 其在中草药分析鉴别、 食物品质检测、 分子结构变化等技术领域获得很好应用[16]: 如Choong等[11]用FTIR技术和二维相关红外光谱对不同产地的硬孔菌进行了鉴别区分; Popescu等[17]用二维相关红外光谱对真菌降解椴木的过程进行了研究; Adib等[18]利用二维相关红外光谱对岗松药材的提取物进行识别分析。
本工作采用傅里叶变换红外光谱、 二维相关红外光谱技术及主成分分析对牛肝菌属的茶褐牛肝菌、 小美牛肝菌、 双色牛肝菌、 灰褐牛肝菌、 美柄牛肝菌、 美味牛肝菌和铜色牛肝菌进行研究。 文献中还未见用二维相关红外光谱分析蘑菇。
1 实验部分
1.1 仪器与测试条件
使用美国Perkin Elmer公司生产的Frontier型傅里叶变换红外光谱仪, 配备DTGS 探测器, 测定范围4 000~400 cm-1, 分辨率为4 cm-1, 扫描16次。 温控附件为EUROTHERM 3216型温控仪, 控温范围50~120 ℃。
1.2 样品制备和光谱数据处理
七种野生牛肝菌均采自云南大理苍山。 将蘑菇样品去除泥土、 草叶等杂物、 清洗、 晒干、 保存, 实验中将同一部位的少量样品放入玛瑙研钵中磨为细粉, 再加入适量的溴化钾搅磨均匀, 压片待测。 实验所得原始光谱通过使用红外光谱处理软件(OMNIC 8.0)进行基线校正、 5点平滑和归一化处理, 利用Origin 8.5和SPSS统计软件进行原始光谱分析和主成分分析。 动态谱是样品在50~120 ℃每间隔10 ℃采集一次光谱所得, 对动态谱进行二维相关红外光谱分析, 并得到二维相关红外光谱, 采用为清华大学分析中心编制的二维相关分析软件。
2 结果与讨论
2.1 七种牛肝菌的红外光谱特征
图1a—g分别为茶褐牛肝菌、 小美牛肝菌、 双色牛肝菌、 灰褐牛肝菌、 美柄牛肝菌、 美味牛肝菌和铜色牛肝菌的红外光谱图, 可以看出, 七种牛肝菌光谱总体相似, 其典型特征吸收峰: 3400 cm-1附近的宽吸收峰, 表征自多糖、 蛋白质的O—H和N—H的伸缩振动[11]; 2 956, 2 928和2 858 cm-1附近的峰分别归属为—CH3不对称伸缩振动、 —CH2不对称伸缩振动和对称伸缩振动[14-16]; 1 650, 1 553和1 240 cm-1附近谱峰分别为蛋白质酰胺Ⅰ带、 酰胺Ⅱ带和酰胺Ⅲ的特征吸收峰[19]; 1 500~1 200 cm-1范围归属为蛋白质、 脂肪酸和多糖的混合振动吸收; 其中1 401和1 317 cm-1附近的吸收峰为C—O—H的弯曲振动和—CH2的变形振动; 在多糖的特征吸收区域1 200~950 cm-1范围内出现了两个强吸收峰1 079和1 044 cm-1, 分别归属为糖类的C—O和C—C的伸缩振动, 小美牛肝菌、 双色牛肝菌、 美味牛肝菌和铜色牛肝菌光谱中1 114 cm-1的吸收峰相对较强, 而其他样品相对弱; 在糖类异构区950~750 cm-1范围内, 890 cm-1附近的峰归属为β-构型多糖的特征峰, 840 cm-1附近的弱吸收峰归属为α-构型多糖的特征峰[18-19]。 所有光谱典型的特征吸收峰表明, 七种牛肝菌的光谱特征很相似, 主要由蛋白质和碳水化合物的吸收峰构成, 但吸收峰强度、 位置存在差异, 说明它们的成分含量不同。
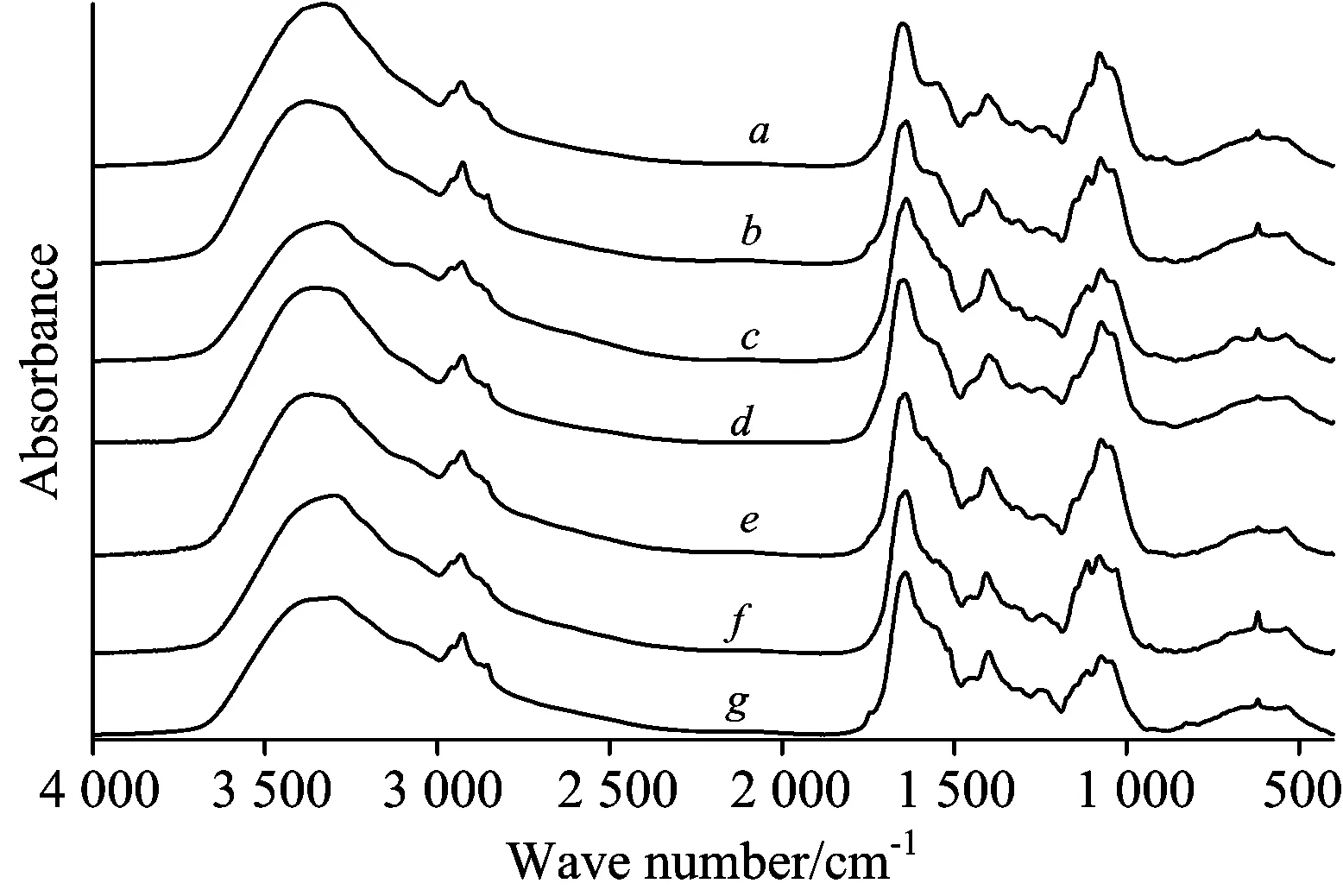
图1 七种不同牛肝菌的FTIR光谱图
2.2 七种牛肝菌的二维相关红外光谱特征
二维相关红外光谱是在不同外界微扰下, 得到一系列的动态振动红外光谱图, 并利用数学相关分析对动态光谱信号进行处理得到二维相关红外光谱图[20]。 二维相关红外光谱由于在第二维上进行了扩展, 将重叠峰甚至原先被掩盖的一些小峰清晰地显示出来, 因而有效的提高了谱图的分辨率[21]。 本文以温度作为外界微扰, 测量不同温度下的牛肝菌红外光谱, 得到牛肝菌的动态红外光谱, 对动态红外光谱进行处理, 得到二维相关同步谱的等高线图、 三维立体鱼网图以及自动峰图谱, 如图2和图3所示。
2.2.1 七种牛肝菌1 300~1 680 cm-1范围的二维相关红外光谱
图2为七种牛肝菌在1 300~1 680 cm-1范围的二维相关红外光谱, 从图中发现各样品的自动峰强度、 数目和形状差异很大。 茶褐牛肝菌和双色牛肝菌均出现了6个明显的自动峰, 其最强分别为1 549和1 579 cm-1, 茶褐牛肝菌出现了其他样品未出现的中等强度自动峰1 619 cm-1, 同样双色牛肝菌出现了其他样品未出现的弱的自动峰1 629 cm-1; 小美牛肝菌出现了5个明显的自动峰, 最强自动峰在1 570cm-1; 灰褐牛肝菌和美柄牛肝菌出现4个明显自动峰, 最强自动峰分别在1 559和1 570 cm-1; 美味牛肝菌和铜色牛肝菌自动峰相对较少, 只出现了3个明显的自动峰, 且最强自动峰都在1 649 cm-1。 七种牛肝菌样品最强自动峰的波数明显不同, 其中茶褐牛肝菌和灰褐牛肝菌最强的自动峰出现在1 549和1 559 cm-1, 移动了10 cm-1; 小美牛肝菌和美柄牛肝菌最强的自动峰均出现在1 570 cm-1, 而双色牛肝菌则出现在1 579 cm-1, 移动了9 cm-1。 双色牛肝菌在1 658 cm-1出现自动峰, 其余6个样品均在1 649 cm-1处出现自动峰, 有9 cm-1的移动, 且在美味牛肝菌和铜色牛肝菌中的自动峰最强, 而双色牛肝菌相对较弱; 茶褐牛肝菌、 小美牛肝菌、 双色牛肝菌、 美柄牛肝菌和铜色牛肝菌在1 549 cm-1出现了强自动峰, 灰褐牛肝菌和美味牛肝菌自动峰出现在1 559 cm-1, 移动了10 cm-1; 因此可以看出样品中蛋白质酰胺Ⅰ带和酰胺Ⅱ带结构和含量存在一定的差异。 小美牛肝菌、 双色牛肝菌和灰褐牛肝菌出现了中等强度的自动峰1 450 cm-1, 茶褐牛肝菌在1 459 cm-1处出现了中等强度的自动峰, 移动了9 cm-1, 其他牛肝菌并没有明显出现此自动峰, 但在1 409 cm-1出现了弱自动峰。
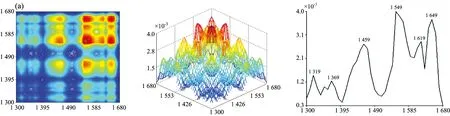
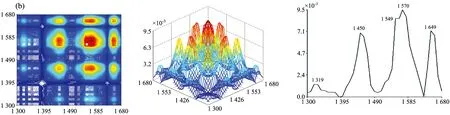
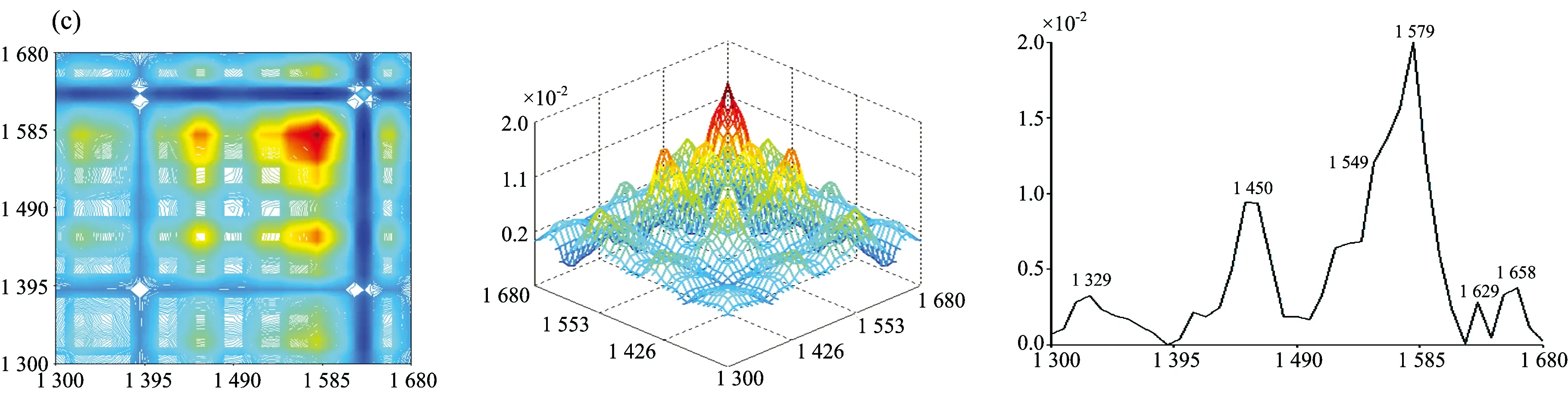

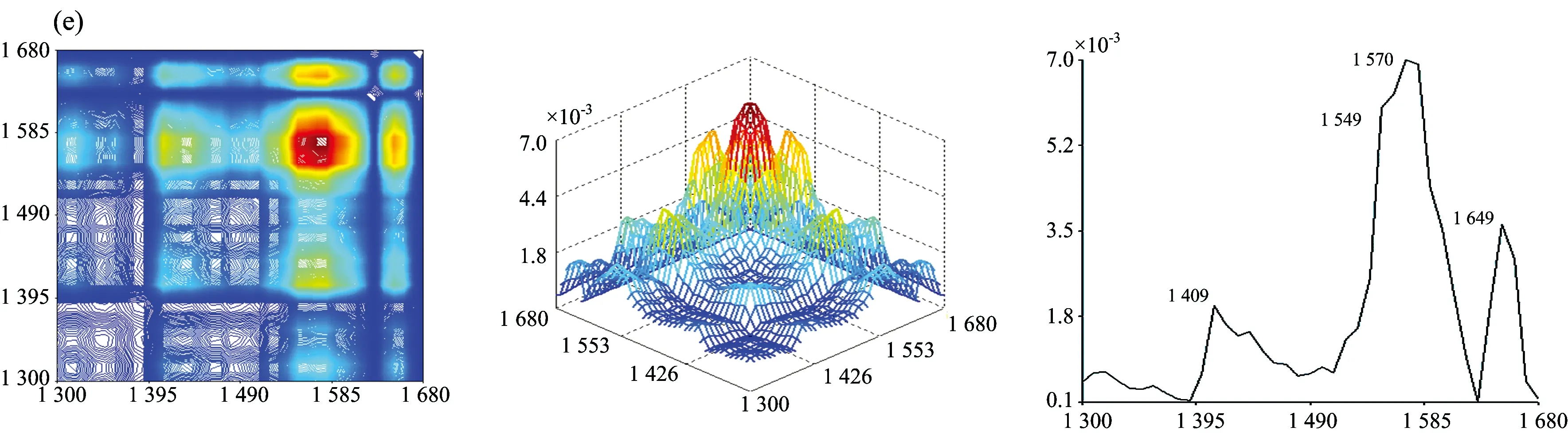
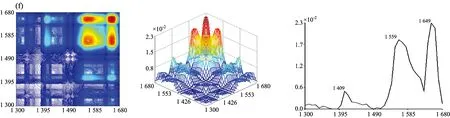
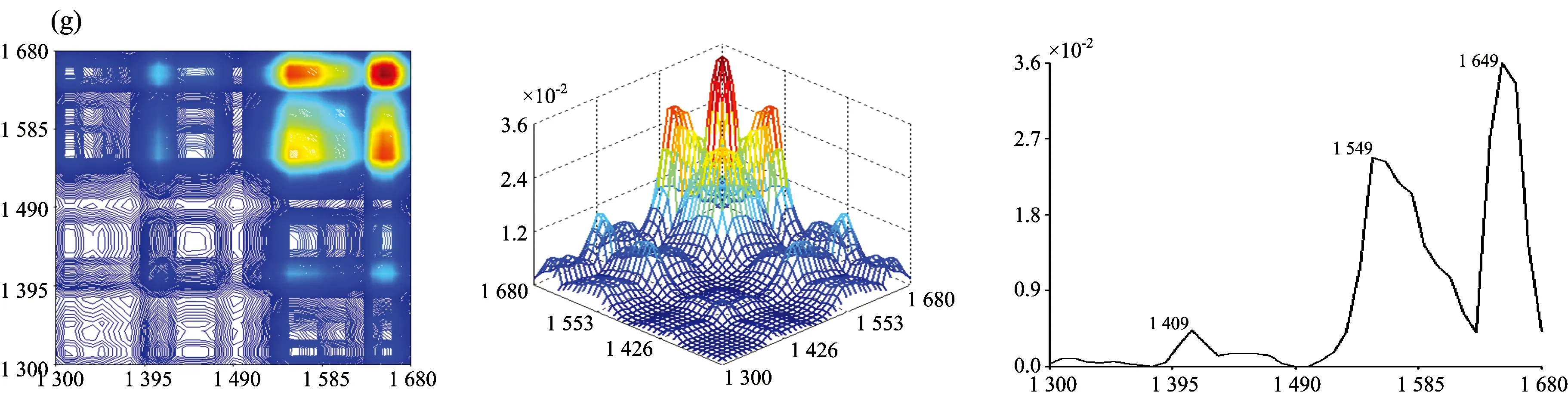
图2 七种不同牛肝菌在1 300~1 680 cm-1的二维相关红外光谱
七种样品自动峰差别很大, 而且每种样品自动峰之间主要形成了不同强度的正交叉峰, 其中茶褐牛肝菌相对较强的交叉峰为(1 619, 1 649 cm-1), (1 549, 1 649 cm-1), (1 459, 1 649 cm-1), (1 619, 1 549 cm-1)和(1 459, 1 549 cm-1); 小美牛肝菌交叉峰(1 450, 1 570 cm-1), (1 450, 1 649 cm-1), (1 570, 1 649 cm-1)和双色牛肝菌交叉峰(1450, 1 579 cm-1)相对较强; 灰褐牛肝菌出现了两个较明显的交叉峰(1 450, 1 559 cm-1), (1 559, 1 649 cm-1); 美柄牛肝菌、 美味牛肝菌和铜色牛肝菌只出现一个较强交叉峰, 分别在(1 570, 1 649 cm-1), (1 559, 1 649 cm-1)和(1 549, 1 649 cm-1)处; 显然样品间的交叉峰强度、 位置和数量均不同。
2.2.2 七种牛肝菌920~1150 cm-1范围的二维相关红外光谱
图3为牛肝菌在920~1 150 cm-1范围的二维相关红外光谱, 其差异可见: 茶褐牛肝菌、 双色牛肝菌和美柄牛肝菌均出现5个明显的自动峰, 其中茶褐牛肝菌的最强自动峰出现在1 019 cm-1, 双色牛肝菌出现在1 089 cm-1, 美柄牛肝菌出现在1 049 cm-1, 茶褐牛肝菌中出现了其他牛肝菌没明显出现的949 cm-1弱自动峰, 双色牛肝菌出现了相对较弱的自动峰1 069 cm-1; 小美牛肝菌、 灰褐牛肝菌、 美味牛肝菌和铜色牛肝菌均出现了4个明显的自动峰, 其中小美牛肝菌和灰褐牛肝菌的最强自动峰均出现在1 089 cm-1处, 美味牛肝菌和铜色牛肝菌的最强自动峰却出现在1 079 cm-1, 移动了10 cm-1, 另外灰褐牛肝菌自动峰中出现了其他样品未出现的弱自动峰969 cm-1, 美味牛肝菌和铜色牛肝菌的自动峰强度和形状都比较接近, 但在自动峰1 039 cm-1, 铜色牛肝菌明显强于美味牛肝菌。 茶褐牛肝菌、 美味牛肝菌、 美柄牛肝菌和铜色牛肝菌均在1 079 cm-1出现强自动峰, 但在小美牛肝菌、 双色牛肝菌和灰褐牛肝菌中自动峰出现在1 089 cm-1处, 不但移动了10 cm-1, 而且都为自身最强自动峰, 说明糖类的C—O振动对温度微扰较敏感[22]。 在1 029 cm-1处茶褐牛肝菌和灰褐牛肝菌均没出现明显的自动峰, 美味牛肝菌和铜色牛肝菌均出现在1 039 cm-1处, 移动了10 cm-1, 另外美柄牛肝菌在1 049 cm-1出现了最强自动峰。 七种牛肝菌样品的自动峰强度、 数目和位置均存在明显的差异, 说明样品中多糖成分对热微扰的影响、 变化存在明显不同, 因此多糖结构存在很大差异。
从图3发现各自动峰之间主要形成了正交叉峰, 其茶褐牛肝菌中最强交叉峰为(1 019, 1 079 cm-1); 小美牛肝菌和双色牛肝菌较强交叉峰均为(1 089, 1 029 cm-1), (1 089, 929 cm-1)和(1 029, 929 cm-1); 灰褐牛肝菌较强交叉峰为(1 089, 1 019 cm-1), (1 089, 929 cm-1)和(1 019, 929 cm-1); 美柄牛肝菌、 美味牛肝菌和铜色牛肝菌较强交叉峰均为自动峰1 109, 1 079和1 039 cm-1相互形成, 且交叉峰强度依然存在差异。 因此在受到热微扰时各样品结构均发生了不同的变化, 导致各较强交叉峰强度、 位置和数量不同。
由以上分析可知, 自动峰和交叉峰的位置、 数目、 相对强度均有很大的差异, 说明七种牛肝菌样品本身所含的蛋白质和糖类化合物存在很大的区别。 所以根据样品自动峰的数目、 位置和交叉峰的差异能够实现这七种同属牛肝菌的鉴别。
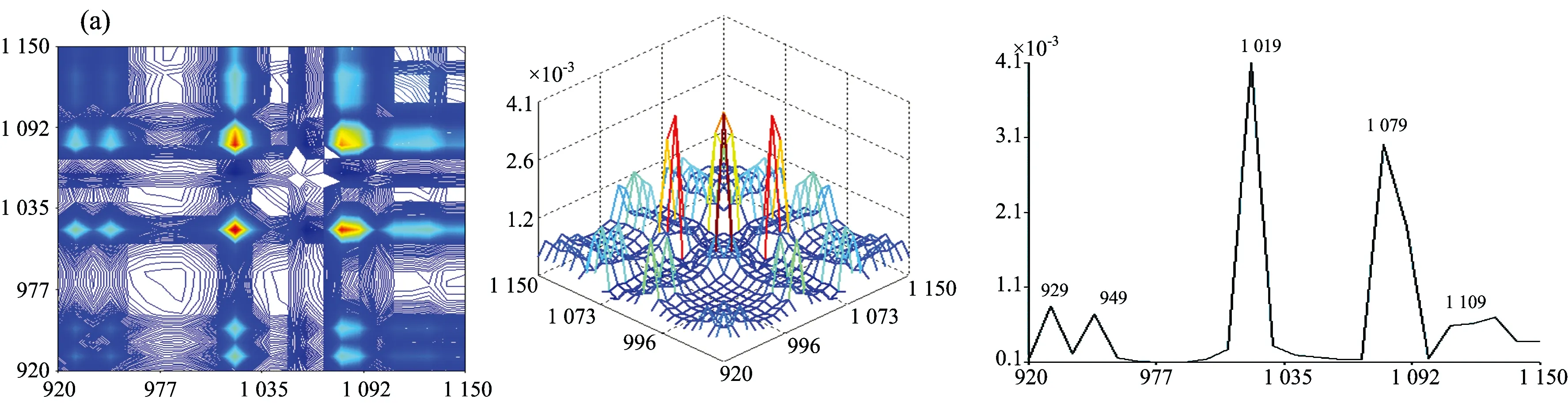

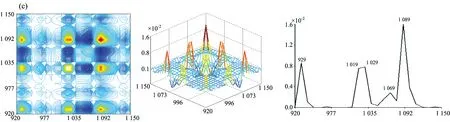
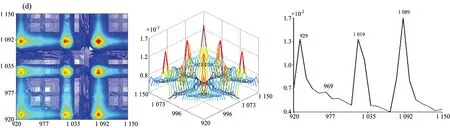

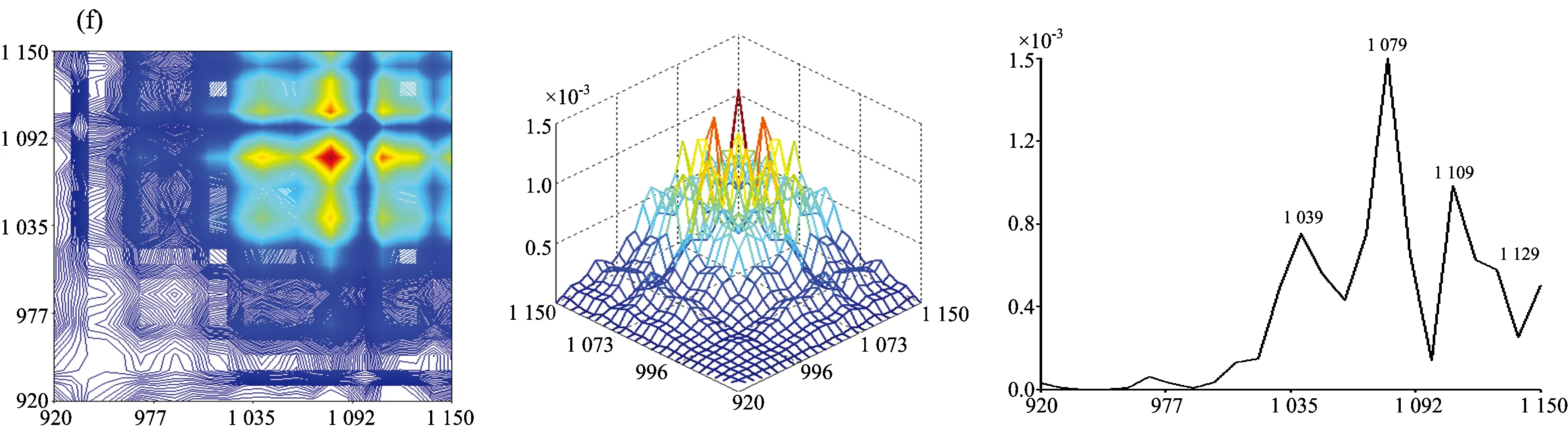

图3 七种不同牛肝菌在920~1 150 cm-1的二维相关红外光谱
2.3 主成分分析
主成分分析(PCA)是在众多原始变量中筛选出几个主要变量, 使变量数目减小, 同时这几个主要变量能准确代表整个原始变量的特征, 这样即减小数据维数, 也能获取主要信息, 从而达到样品的区分[23]。
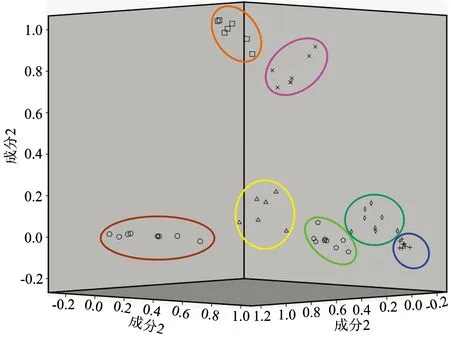
图4 七种牛肝二阶导数的主成分分析得分图
△: Boletus brunneissimus Chiu; □: Boletus speciosus; ◇: Boletus bicolor; ×: Boletus griseus Forst; +: Boletus calopus;: Boletus edulis; ○: Boletus aereus
对七种牛肝菌1 800~800 cm-1范围的二阶导数光谱做主成分分析。 提取前3个主成分, 累积贡献率为85.1%。 得到七种牛肝菌的三维立体主成分得分图, 如图4, 三个坐标分别表示第1, 2, 3主成分得分值。 从图中可以清晰看到52个牛肝菌样本完整的分布在七个区域, 而且七个区域中的每个区域都为同一种样品, 并没有出现误分。 其中双色牛肝菌、 美味牛肝菌和美柄牛肝菌距离较近, 说明他们之间化学成分含量相对接近; 小美牛肝菌和灰褐牛肝菌距离较近, 但和其他样品距离相对较远, 说明它们和其他样品之间的差异较大。 七种蘑菇的分类正确率达到100%。
3 结 论
运用FTIR光谱、 二维相关红外光谱以及主成分分析来对七种同属牛肝菌进行分析鉴别研究, 从FTIR光谱图中可以发现, 七种蘑菇的红外光谱特征整体较相似, 主要为蛋白质和多糖的吸收峰组成。 二维相关红外光谱提高了谱图的分辨率, 在各牛肝菌1 300~1 680和920~1 150 cm-1范围的二维相关红外光谱中, 自动峰和交叉峰的强度、 位置、 数量均有很大的差异, 表明其蛋白质和糖类化合物结构差异明显。 对7个样品在1 800~800 cm-1范围内光谱的二阶导数进行主成分分析, 所有样品正确的划分在7个区域, 主成分分析正确率达100%。 结果表明应用FTIR光谱结合二维相关红外光谱或主成分分析可以很好的对茶褐牛肝菌、 小美牛肝菌、 双色牛肝菌、 灰褐牛肝菌、 美柄牛肝菌、 美味牛肝菌和铜色牛肝菌7个样品进行区分。 此方法具有快捷、 准确等优点。
[1] ZANG Mu(臧 穆). Chinese Fungi(中国真菌志). Beijing: Science Press(北京: 科学出版社), 2006.
[2] LI Tai-hui, SONG Bin(李泰辉, 宋 斌). Ecological Science(生态科学), 2002, 21: 240.
[3] YU Wen-qing, PENG Yan-fang, XU Ying-ying, et al(于文清, 彭艳芳, 许迎迎, 等). Natural Product Research and Development(天然产物研究与开发), 2015, (2): 271.
[4] YANG Tian-wei, LI Tao, ZHANG Ji, et al(杨天伟, 李 涛, 张 霁, 等). Food Science(食品科学), 2014, 35(16): 105.
[5] Liu X, Wang L, Zhang C, et al. Carbohydrate Polymers, 2015, 118: 101.
[6] Heleno S A, Barros L, Martins A, et al. Food Bioscience, 2015, 11: 48.
[7] Wrona M, Bentayeb K, Nerín C. Food Control, 2015, 54: 200.
[8] Ostos C, Pérez-Rodríguez F, Arroyo B M, et al. Journal of Food Composition and Analysis, 2015, 37: 136.
[9] Malheiro R, Pinho P G D, Soares S, et al. Food Research International, 2013, 54(1):186.
[10] LIU Fang, ZHU Bing, YU Jing-li, et al(刘 芳, 朱 兵, 于景丽, 等). Biotechnology Bulletin(生物技术通报), 2010, (6): 124.
[11] Choong Y K, Xu C H, Lan J, et al. Journal of Molecular Structure, 2014, 1069(26): 188.
[12] Bombalska A, Mularczyk-Oliwa M, Kwasny M, et al. Spectrochimica Acta Part A, 2010, 78(4): 1221.
[13] Shen F, Ying Y, Li B, et al. Food Research International, 2011, 44(5): 1521.
[14] ZHOU Zai-jin, LIU Gang, REN Xian-pei(周在进, 刘 刚, 任先培). Laser & Infrared(激光与红外), 2009, 39(11): 1158.
[15] SHI You-ming, LIU Gang, SUN Yan-lin, et al(时有明, 刘 刚, 孙艳琳, 等). The Journal of Light Scattering(光散射学报), 2010, 22(2): 171.
[16] Noda I. Chinese Chemical Letters, 2015, 26: 167.
[17] Popescu C M, Popescu M C, Vasile C. Microchemical Journal, 2010, 95(2): 377.
[18] Adib A M, Jamaludin F, Kiong L S, et al. Journal of Pharmaceutical and Biomedical Analysis, 2014, 96(2):104.
[19] Mecozzi M, Sturchio E. Spectrochimica Acta Part A: Molecular Biomolecular Spectroscopy, 2015, 137: 90.
[20] SUN Su-qin, ZHOU Qun, QIN Zhu(孙素琴, 周 群, 秦 竹). Atlas of Two-Dimensional Correlation Infrared Spectroscopy for Traditional Chinese Medicine Identification(中药二维相关红外光谱鉴定图集). Beijing: Chemical Industry Press(北京: 化学工业出版社), 2003.
[21] Li J R, Sun S Q, Wang X X, et al. Journal of Molecular Structure, 2014, 1069: 229.
[22] Choong Y K, Sun S Q, Zhou Q, et al. Journal of Molecular Structure, 2014, 1069: 60.
[23] Uarrota V G, Moresco R, Coelho B, et al. Food Chemistry, 2014, 161(6): 67.
Discrimination of Seven Species of Boletus with Fourier Transform Infrared Spectroscopy
MA Dian-xu, LIU Gang*, OU Quan-hong, YU Hai-chao, LI Hui-mei, LIU Yan
School of Physics and Electronic Information, Yunnan Normal University, Kunming 650500, China
Fourier transform infrared spectroscopy, two-dimensional correlation infrared spectroscopy and principal component analysis were used to discriminate seven species of boletus belonging to the same genus. The results showed that the absorption bands of original spectra were similar, which were mainly composed of the absorption bands of protein and polysaccharides, but tiny differences were still observed at the position and intensities of peaks. Two-dimensional correlation infrared spectroscopy technology was applied to study the sample. It showed that there are 6 auto-peaks in the Boletus brunneissimus Chiu and Boletus bicolor, 5 auto-peaks in the Boletus speciosus, 4 auto-peaks in the Boletus griseus Forst and Boletus calopus, only 3 in the Boletus edulis and Boletus aereus in the range of 1 680~1 300 cm-1. The significant differences in the position, intensity of auto-peaks and cross peaks were still observed in the range of 1 680~1 300 cm-1. Same significant differences were observed in the range of 1 150~920 cm-1. Principal component analysis was conducted on boletus with second derivative infrared spectra in the range of 1 800~800 cm-1. All the samples were distinguished and the classification accuracy of principal component analysis is up to 100%. It is demonstrated that Fourier transform infrared spectroscopy combined with two-dimensional correlation infrared spectroscopy or principal component analysis is a rapid and effective method for discriminating mushrooms.
Boletus; FTIR; Two-dimensional correlation infrared spectroscopy; Principal component analysis; Discrimination
Jun. 10, 2015; accepted Oct. 26, 2015)
2015-06-10,
2015-10-26
国家自然科学基金项目(30960179) 和云南省高校科技创新团队支持计划项目资助
马殿旭, 1991年生, 云南师范大学物理与电子信息学院硕士研究生 e-mail: 465615292@qq.com *通讯联系人 e-mail: gliu66@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)08-2479-08
*Corresponding author

