处理的牙本质基质对骨髓间充质干细胞成骨分化影响的研究
杨禾丰 胡瑜 孙晶晶 郭维华 田卫东 李松.昆明医科大学口腔医学院,昆明 65003;.口腔再生医学国家地方联合工程实验室(四川大学),成都 6004
处理的牙本质基质对骨髓间充质干细胞成骨分化影响的研究
杨禾丰1,2胡瑜1孙晶晶2郭维华2田卫东2李松1
1.昆明医科大学口腔医学院,昆明 650031;2.口腔再生医学国家地方联合工程实验室(四川大学),成都 610041
[摘要]目的采用体外研究的方法评价处理的牙本质基质(TDM)对骨髓间充质干细胞(BMSCs)增殖及成骨分化的影响。方法将获取的牙本质颗粒进行梯度脱矿处理,制备TDM浸提液。分离培养人BMSCs后,将BMSCs培养于TDM浸提液中,CCK-8法检测细胞的增殖情况,培养7 d后提取细胞总蛋白采用Western blot检测成骨相关蛋白:Ⅰ型胶原蛋白(ColⅠ)、Runt相关转录因子-2(Runx2)的表达情况。结果TDM浸提液培养后,与空白对照组及羟磷灰石/β-磷酸三钙组相比,细胞增殖明显;培养7 d后,TDM组的ColⅠ、Runx2蛋白的表达量明显增高。结论TDM可以促进BMSCs的增殖及成骨向分化,提示其应用于骨组织工程的可行性。
[关键词]骨髓间充质干细胞;增殖;分化;牙本质
Supported by: The National Natural Science Foundation of China (81360163);Doctoral Foundation of Kunming Medical University (2015D03).Correspondence: Li Song, E-mail: lisong59@sohu.com.
骨移植材料被广泛地应用于口腔领域,修复由牙周炎、创伤、肿瘤、先天性疾病等引起的颌骨组织缺损,以满足维持牙槽骨的形态、功能及美学要求[1-2]。同种异体骨、异种骨、合成骨替代材料等是目前应用较为广泛的骨移植材料,但均存在一定的缺点[3]。牙齿,尤其是牙本质具有与骨相似的有机和矿化物构成成分[4],并且获得相对较易,较其他骨移植材料经济,甚至可以获得自体的牙齿组织,从而避免生物安全性问题。因此,牙齿作为一种移植材料受到研究者的关注。本课题组将牙本质基质制备成根形支架,经过系列处理后,用于牙根的再生[5-6]。Ji等[7]的研究发现在种植窝中植入处理的牙本质基质(treated dentin matrix,TDM)后,表面出现骨吸收陷窝,与周围牙槽骨出现骨固连。据此推测,TDM可望成为一种骨移植替代材料。本研究旨在探讨TDM对人骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)增殖及成骨向分化的影响,为进一步的动物实验提供依据。
1 材料和方法
1.1主要试剂和仪器
改良α-DMEM培养基、胎牛血清(fetal bovine serum,FBS)(Hyclone公司,美国),Ⅰ型胶原酶、胰蛋白酶(Gibco公司,美国),乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、油红O、茜素红(Sigma公司,美国),碱性磷酸酶(alkaline phosphatase, ALP)检测试剂盒(江苏凯基生物技术股份有限公司),CCK-8试剂盒(Dojindo公司,日本),anti-Ⅰ型胶原蛋白(collagen type Ⅰ,ColⅠ)抗体、anti-ALP抗体、anti-Runt相关转录因子-2(runt-related transcription factor-2,Runx2)抗体、anti-STRO-1抗体(Abcam公司,美国),anti-磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)抗体(成都正能生物技术有限责任公司),山羊抗小鼠/兔二抗、TRITC标记山羊抗小鼠 IgG(北京中杉金桥生物技术有限公司)。倒置相差显微镜及照相系统(Olympus公司,日本),CO2培养箱(Binder公司,德国),生物安全柜(Thermo公司,美国),高速手机(NSK公司,日本),超声波清洗机(宁波新艺超声设备有限公司),高通量组织研磨仪(北京鼎昊源科技有限公司)。
1.2BMSCs的培养和鉴定
1.2.1BMSCs的培养BMSCs由四川大学华西第二医院妇产科提供,取自孕6月流产胎儿股骨骨髓,产妇及家属对实验知情同意,实验经医院伦理委员会批准。将获赠的冻存BMSCs(P2代)于37 ℃水浴复苏后,1 000 r·min-1离心5 min,去上清,加入含10% FBS的α-DMEM培养基重悬,调整细胞密度后接种,培养4 h换液去除未贴壁细胞后,将细胞置于37 ℃、5%CO2的孵箱内培养,每隔3 d换液。细胞铺满培养瓶底70%~80%时,按1︰3的比例进行传代。
1.2.2BMSCs免疫荧光检测取生长良好的细胞制备细胞爬片,PBS清洗后4%多聚甲醛固定10 min,滴加0.5%TritonX-100处理15 min,1%牛血清白蛋白(bovine serum albumin,BSA)封闭30 min,滴加1%BSA稀释的anti-STRO-1抗体(1︰100),以PBS代替一抗作阴性对照,于37 ℃孵育2 h,加入TRITC标志的荧光二抗,避光37 ℃孵育1 h,5 μg·mL-14’,6-二脒基-2-苯基吲哚[2-(4-amidinophenyl)-6-indolecarbamidine dihydrochloride,DAPI]复染细胞核2 min,置于荧光显微镜下观察并摄片。
1.2.3BMSCs多向分化能力检测将BMSCs制成单细胞悬液,调整细胞密度为每毫升1×105个,接种于6孔板中,待细胞融合至80%时,将培养液更换为成骨诱导液(在含有10%FBS的α-MEM培养基中添加10 mmol·L-1β-磷酸甘油钠、10-8mol·L-1地塞米松、50 μmol·L-1抗坏血酸、0.01 μmol·L-125-二羟维生素D3)、成脂诱导液(在含10%FBS的α-MEM培养基中添加1 μmol·L-1地塞米松、10 μmol·L-1胰岛素、0.5 mmol·L-13-异丁基-1-甲基黄嘌、0.2 mmol·L-1吲哚美辛)诱导BMSCs向成骨和成脂方向分化,每2 d换液,诱导14 d后,4%多聚甲醛固定,并分别用Gomori改良钙钴法、茜素红钙盐染色法、油红O染色法进行染色,检测BMSCs的多向分化能力。
1.3TDM对BMSCs作用的体外研究
1.3.1TDM浸提液的制备临床收集因正畸治疗需要拔除的前磨牙或阻生牙,患者对实验知情同意,实验经医院伦理委员会批准。使用高速手机、金刚砂车针去除牙冠,拔除牙髓组织,沿牙根轮廓磨除牙骨质及部分牙本质,超声振荡清洗20 min重复3次,液氮冷冻2~3 h后,置于真空冷冻干燥机中冷冻干燥8 h(-50 ℃,真空度<20 Pa);使用高通量组织研磨仪进行研磨(1 200 r·min-1,1 min,重复3~5次),将所获得的TDM颗粒进行梯度脱矿:17%、10%、5%EDTA分别脱矿5~10 min,PBS清洗3次。按照ISO 10993要求制备浸提液,以每20 g加入100 mL α-MEM培养基,于37 ℃,5%CO2条件下浸提5 d,0.22 μm滤器过滤后添加10%FBS。
1.3.2TDM浸提液对BMSCs增殖的影响将BMSCs接种至96孔板中,每孔2×103个细胞,待贴壁后吸出原培养基,每孔加入普通培养基、TDM浸提液、羟磷灰石(hydroxyapatite,HA)/β-磷酸三钙(β-tricalcium phosphate,β-TCP)浸提液(由四川大学生物材料国家工程研究中心提供,其中HA︰β-TCP为30︰70,浸提方法与TDM浸提液相同)150 μL培养1~7 d,检测前每孔加入100 μL新鲜的生长培养基和10 μL的CCK-8,在饱和湿度、37 ℃、5%CO2培养箱中避光孵育3 h时,带有450 nm滤光片的酶标仪检测光密度(optical density,OD)值,根据所测OD值,绘出生长曲线。
1.3.3TDM浸提液对BMSCs成骨分化的影响 将生长状态良好的第4代BMSCs,按每毫升1×105个的细胞密度接种于6孔板中,使用普通培养基(空白对照)、TDM浸提液、HA/β-TCP浸提液进行培养,每2 d换液,培养7 d。按全蛋白提取试剂盒操作步骤进行,RIPA(强)裂解液提取BMSCs总蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度,4×十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)蛋白上样缓冲液按1∶3比例加入蛋白,煮沸8 min。取50 μg蛋白进行8%和10%SDS-PAGE,200 mA恒流电转90 min,将蛋白转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂牛奶非特异性封闭1 h;加入一抗︰anti-ColⅠ(1︰1 000)、anti-Runx2 (1︰1 000)以及GAPDH(1︰10 000),4 ℃过夜,加入山羊抗小鼠/兔二抗(1︰3 000稀释)室温孵育1 h,采用Immobilon™ Western Chemiluminescent HRP Substrate进行显影,ImageQuant LAS 4000mini凝胶成像系统凝胶成像系统进行曝光。结果采用ImageJ2X进行目的蛋白灰度的分析,以目的蛋白/GAPDH的灰度比值表示相对目的蛋白水平。
1.4统计学分析
采用SPSS 13.0软件对实验结果进行统计分析,采用单因素方差分析(one-way ANOVA)和t检验对数据进行分析,检测水准为双侧α=0.05。
2 结果
2.1BMSCs形态学观察和免疫荧光抗原检测
BMSCs生长良好,培养5~7 d即可传代,传代培养至第4代后细胞形态基本上趋于一致,胞体大,折光性好,细胞呈长条梭状(图1左)。BMSCs免疫荧光染色显示,STOR-1呈阳性,发出红色荧光,细胞核DAPI复染发出蓝色荧光(图1右),提示培养的细胞为间充质来源并具有干细胞特性。

图1 BMSCs的生长状况Fig 1 Growth condition of BMSCs
2.2BMSCs向成骨细胞及成脂细胞分化
经成骨诱导液诱导14 d后,Gomori改良钙钴法染色可见,胞浆中可见灰黑色至深黑色ALP颗粒(图2A);茜素红钙盐染色显示红色的矿化结节形成,呈散在分布,周边界限不清(图2B)。经成脂诱导剂诱导14 d后,油红O染色显示细胞内出现密集红染的脂肪小滴(图2C)。
2.3TDM浸提液对BMSCs增殖的影响
使用CCK-8试剂盒对BMSCs的增殖能力进行检测,将连续7 d测得的OD值进行数据分析。结果显示,3组细胞在第2天开始进入对数生长期,6~7 d进入平台期。与空白对照组及HA/β-TCP浸提液相比,TDM浸提液促进了BMSCs的增殖。HA/β-TCP组则并未展现出明显的促进增殖的作用(图3)。
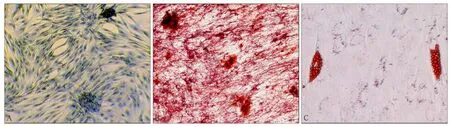
图2 BMSCs向成骨细胞和成脂细胞分化情况 × 100Fig 2 Osteogenic and adipogenic differentiation potentials of human BMSCs × 100
2.4TDM浸提液对BMSCs成骨分化的影响
使用浸提液培养BMSCs 7 d后,采用Western blot检测成骨相关蛋白ColⅠ、Runx2的表达,并以目的蛋白/GAPDH的灰度比值对相对目的蛋白水平进行统计分析。TDM组的ColⅠ、Runx2的表达均明显高于空白对照组及HA/β-TCP组(P<0.05)(图4)。

图3 BMSCs的增殖情况Fig 3 Proliferation of BMSCs
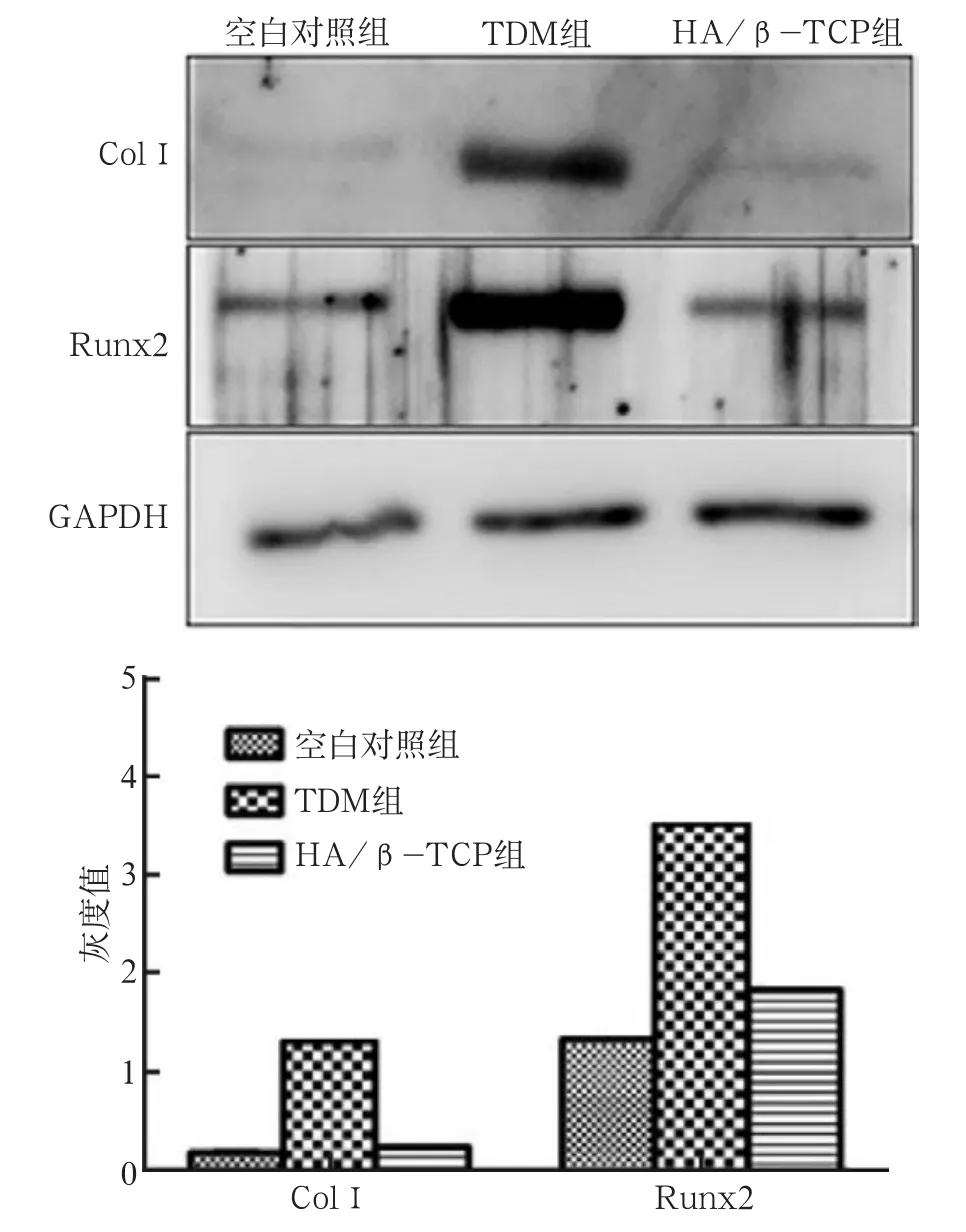
图4 Western blot检测Col-Ⅰ和Runx2的表达Fig 4 Expression of Col-Ⅰand Runx2 by Western blot analysis
3 讨论
骨组织工程的构建涵盖了骨组织替代材料修复骨缺损的3个关键要素:细胞的成骨性、生长因子的骨诱导性以及支架材料的骨传导性。基于骨组织自身的再生能力以及临床使用的便捷性,目前的骨组织工程倾向于无细胞支架材料的研发[8]。其中一个重要的思路是对细胞外基质的模拟,包括天然的脱细胞外基质,如脱矿骨基质以及负载成骨相关因子的合成材料的开发。TDM的物质构成与骨组织相类似[4],同时含有大量的非胶原蛋白及具有生物活性的成骨/成牙相关的生长因子[5,9],在作为支架材料的同时构建了相应的诱导微环境。因此有学者[10-11]将各种形式的TDM应用于骨组织缺损的修复。
Reis-Filho等[12]将10%EDTA脱矿3个月的人TDM植入SD大鼠拔牙窝模型,发现在植入7、14、21 d时拔牙窝中的新骨形成明显增加,植入7和14 d,血管内皮生长因子的表达亦明显增高。随后的研究亦采用相同的脱矿TDM及大鼠模型表明新骨形成增加,在植入10 d时,发现拔牙窝中有骨形态发生蛋白(bone morphogenetic protein,BMP)-2、BMP-4表达的细胞明显增多[13]。然而,目前研究采用的往往是长时间脱矿牙本质或是煅烧牙本质,导致其中蛋白成分不同程度的破化,并且机械强度降低。本课题组采用梯度脱矿的较为温和的方法处理TDM,使表面部分脱矿胶原解离,牙本质小管暴露,有利于成牙/成骨相关因子的释放,并尽可能的保留这些蛋白的活性[5-6],这些研究展现了其应用于骨组织工程领域的良好潜质。
作为骨组织工程的支架材料,诱导细胞生长、分化是其关键的功能之一。BMSCs与机体内的骨形成和损伤后的修复密切相关,也是被广泛应用于骨组织工程的重要种子细胞[14]。因此,本实验以BMSCs为干预对象,初步探讨TDM对其增殖、分化的影响,为进一步的动物实验提供依据。目前BMSCs鉴定的常用方法为标志物的检测、成纤维细胞集落生成单位(colony forming unit-fibroblast,CFU-F)的形成以及多向分化能力的检测。本实验发现培养的细胞表达间充质干细胞的标志物STRO-1,并在体外的诱导条件下具有向成骨及成脂细胞分化的能力与文献报道一致[15]。
本实验采用TDM浸提液对细胞进行培养,并以应用较为广泛的化学合成支架材料HA/β-TCP进行比较。从细胞增殖结果来看,TDM对BMSCs增殖有促进作用,提示与TDM释放的生物活性物质有关。HA/ β-TCP浸提液不抑制BMSCs的增殖,表现出一定的生物相容性,与文献[16]报道相似。ColⅠ是矿化骨组织中唯一的胶原蛋白,构成了骨组织结构的蛋白框架,是成骨细胞表型之一和形成钙结节的基本条件,其表达的高低直接影响成骨细胞矿化的功能[17]。Runx2是成骨早期分化中重要的转录因子,能够调节多种下游的成骨相关基因如ALP、骨钙素(bone gla protein,BGP)等的表达,决定间充质干细胞成骨方向分化[18]。本实验发现相较于其他两组,经过TDM浸提液处理的BMSCs其ColⅠ、Runx2的表达明显增高。结合本课题组前期研究[5]TDM浸提液中含有ColⅠ、转化生长因子β1(transforming growth factor-β1,TGF-β1)、牙本质基质蛋白-1(dentin matrix protein-1,DMP-1)、牙本质涎蛋白(dentin sialoprotein,DSP)等因子,提示其促进BMSCs的增殖及成骨向分化,与TDM释放的生物活性物质有关。其中TGF-β1在前成骨细胞的增殖分化过程中具有重要的促进作用[8],主要是通过促进间充质干细胞的有丝分裂,大量增殖分化为成骨细胞,增加骨钙盐的沉积含量;同时抑制脂肪细胞生成;以及促进骨细胞产生ColⅠ,抑制软骨细胞产生Ⅱ型胶原,从而提高BMSCs的成骨效应。同时,ColⅠ、DSP、DMP-1均是与生物矿化密切相关的蛋白能够在一定程度上促进成骨细胞的矿化作用。HA/β-TCP诱导成骨的机制是通过吸附内源性BMP蛋白实现新骨形成,但在本实验的体外培养条件下ColⅠ、Runx2的表达并未明显增高。
本实验结果表明,TDM促进了BMSCs的增殖以及成骨向分化,提示TDM作为骨移植材料应用于骨组织工程是可行的。但TDM是否是适合的骨移植材料,其降解性、促进新骨形成能力还需要通过动物实验进行验证,而其免疫原性,具体的作用机制还需要更为深入的研究。
[参考文献]
[1]Atieh MA, Alsabeeha NH, Payne AG, et al.Interventions for replacing missing teeth: alveolar ridge preservation techniques for dental implant site development[J].Cochrane Database Syst Rev, 2015, 5:CD010176.
[2]Esposito M, Felice P, Worthington HV.Interventions for replacing missing teeth: augmentation procedures of the maxillary sinus[J].Cochrane Database Syst Rev, 2014, 5: CD008397.
[3]Sarkar SK, Lee BT.Hard tissue regeneration using bone substitutes: an update on innovations in materials[J].Korean J Int Med, 2015, 30(3):279-293.
[4]Kim YK, Lee J, Um IW, et al.Tooth-derived bone graft material[J].J Korean Assoc Oral Maxillofac Surg, 2013, 39 (3):103-111.
[5]Li R, Guo W, Yang B, et al.Human treated dentin matrix as a natural scaffold for complete human dentin tissue regeneration[J].Biomaterials, 2011, 32(20):4525-4538.
[6]Guo W, Gong K, Shi H, et al.Dental follicle cells and treated dentin matrix scaffold for tissue engineering the tooth root [J].Biomaterials, 2012, 33(5):1291-1302.
[7]Ji B, Sheng L, Chen G, et al.The combination use of platelet-rich fibrin and treated dentin matrix for tooth root regeneration by cell homing[J].Tissue Eng Part A, 2015, 21(1/ 2):26-34.
[8]Papadimitropoulos A, Scotti C, Bourgine P, et al.Engineered decellularized matrices to instruct bone regeneration processes[J].Bone, 2015, 70:66-72.
[9]Jiao L, Xie L, Yang B, et al.Cryopreserved dentin matrix as a scaffold material for dentin-pulp tissue regeneration[J].Biomaterials, 2014, 35(18):4929-4939.
[10]Bakhshalian N, Hooshmand S, Campbell SC, et al.Biocompatibility and microstructural analysis of osteopromotive property of allogenic demineralized dentin matrix[J].Int J Oral Maxillofac Implants, 2013, 28(6):1655-1662.
[11]Park M, Mah YJ, Kim DH, et al.Demineralized deciduous tooth as a source of bone graft material: its biological and physicochemical characteristics[J].Oral Surg Oral Med Oral Pathol Oral Radiol, 2015, 120(3):307-314.
[12]Reis-Filho CR, Silva ER, Martins AB, et al.Demineralised human dentine matrix stimulates the expression of VEGF and accelerates the bone repair in tooth sockets of rats[J].Arch Oral Biol, 2012, 57(5):469-476.
[13]de Oliveira GS, Miziara MN, Silva ER, et al.Enhanced bone formation during healing process of tooth sockets filled with demineralized human dentine matrix[J].Aust Dent J, 2013, 58(3):326-332.
[14]Asatrian G, Pham D, Hardy WR, et al.Stem cell technology for bone regeneration: current status and potential applications[J].Stem Cells Cloning, 2015, 8:39-48.
[15]Lee RH, Kim B, Choi I, et al.Characterization and expression analysis of mesenchymal stem cells from human bone marrow and adipose tissue[J].Cell Physiol Biochem, 2004, 14(4/5/6):311-324.
[16]王健, 张海燕, 胡勇, 等.骨髓间充质干细胞复合羟基磷灰石/磷酸三钙植骨材料的体外研究[J].解剖学报, 2008, 39(4):539-542.Wang J, Zhang HY, Hu Y, et al.In vitro studies of bone marrow mesenchymal stem cells on HA/TCP bone graft scaffold[J].Acta Anatomica Sinica, 2008, 39(4):539-542.
[17]Banse X, Sims TJ, Bailey AJ.Mechanical properties of adult vertebral cancellous bone: correlation with collagen intermolecular cross-links[J].J Bone Miner Res, 2002, 17(9):1621-1628.
[18]Lian JB, Stein GS, Javed A, et al.Networks and hubs for the transcriptional control of osteoblastogenesis[J].Rev Endocr Metab Disord, 2006, 7(1/2):1-16.
(本文编辑杜冰)
Treated dentin matrix enhances proliferation and osteogenic differentiation of bone marrow mesenchymal stem cells
Yang Hefeng1,2, Hu Yu1, Sun Jingjing2, Guo Weihua2, Tian Weidong2, Li Song1.(1.The Affiliated Stomatology Hospital of Kunming Medical University, Kunming 650031, China;2.National Engineering Laboratory for Oral Regenerative Medicine, Sichuan University, Chengdu 610041, China)
[Key words]bone marrow mesenchymal stem cells;proliferation;differentiation;dentine
[Abstract]Objective The effect of treated dentin matrix (TDM) to the proliferation and osteogenesis differentiation of bone marrow mesenchymal stem cells (BMSCs) is evaluated in vitro.Methods TDM leaching solution was prepared by dentine particles suffering from gradient demineralization.Human BMSCs were isolated and cultivated, and subsequently cultivated in the TDM leaching solution.The proliferation of BMSCs was detected by CCK-8.The osteogenesis-related proteins, including collagen typeⅠ(ColⅠ) and runt-related transcription factor-2 (Runx2), were extracted and detected by Western blot after a 7-day culture.Results Compared with the control group and hydroxyapatite (HA)/ β-tricalcium phosphate (β–TCP) group, the proliferation of BMSCs cultivated in TDM leaching solution was significantly improved.The expression of ColⅠ and Runx2 obviously increased after the 7-day cultivation in TDM leaching solution.ConclusionTDM can promote the proliferation and osteogenesis differentiation of BMSCs, implying the feasibility of the application in bone tissue engineering.
[中图分类号]Q 254
[文献标志码]A [doi]10.7518/hxkq.2016.03.013
[收稿日期]2015-11-10; [修回日期]2016-01-10
[基金项目]国家自然科学基金(81360163);昆明医科大学博士研究生创新基金(2015D03)
[作者简介]杨禾丰,主治医师,博士,E-mail:yanghefeng2008@163.com
[通信作者]李松,教授,博士,E-mail:lisong59@sohu.com

