聚N-异丙基丙烯酰胺/壳聚糖温敏性敷料
——自剥离伤口敷料的制备及性能研究
李 澄,李 砚
(四川大学a.高分子科学与工程学院;b.分析测试中心,四川 成都 610064)
聚N-异丙基丙烯酰胺/壳聚糖温敏性敷料
——自剥离伤口敷料的制备及性能研究
李澄a,李砚b
(四川大学a.高分子科学与工程学院;b.分析测试中心,四川 成都 610064)
摘要:通过自由基聚合法以单体N-异丙基丙烯酰胺(NIPAAm)和壳聚糖(CS)为原料反应制得聚N-异丙基丙烯酰胺/壳聚糖(PNIPAAm/CS)多孔温敏复合膜。用扫描电子显微镜(SEM)、傅立叶红外光谱(FTIR)、差热分析(DSC)和溶胀率等研究手段对复合膜的理化性能进行表征。研究结果表明:复合膜仍保持其良好的温度敏感性;膜结构随CS含量增加而变得规则,孔径变小,机械性能增强,同时相转变温度略有下降;复合膜内两相间分布比较均匀,未出现相分离;PNIPAAm与CS两相间存在一定的键合作用,主要是CS的羟基和氨基与PNIPAAm中的酰胺基之间形成了氢键结合,这些作用对复合膜的力学性能有一定增强作用。研究还发现,PNIPAAm含量对膜的吸水率和力学性能亦有一定影响。
关键词:温敏性;聚N-异丙基丙烯酰胺;壳聚糖;复合膜
每年因烧伤、冻伤、病变或机械损伤等引起的皮肤损伤患者人数巨大,若皮肤伤口裸露于外界环境中会有干燥、感染细菌、损失水分甚至是更严重的后果[1],因此采用皮肤伤口敷料对创面进行暂时性的生理覆盖,可起到避免机械损伤、防止细菌人侵、控制水分蒸发的作用,并可减轻疼痛、吸湿以及减少创面收缩和疤痕增生[2-3]。目前,临床常用的皮肤伤口敷料主要是合成高分子材料,如硅橡胶、聚氨酯、聚乙烯醇等,但这类材料在应用中存在一明显不足,即新生组织会长入薄膜的微孔中并与之发生粘连,创面愈合后导致其从新生组织表面分离非常困难,往往造成二次损伤,从而延长伤口愈合时间[4-6]。众所周知,暴露于空气中的正常皮肤表面温度基本维持在31℃左右,而在皮肤创口处由于炎症及异物反应,其表面温度往往在38℃以上。因此,若能找到一种能够通过感知创伤皮肤与正常皮肤之间的温度差异,从而在皮肤创面愈合后可自动剥离的皮肤伤口敷料,将具有极其广阔的应用前景,并将为广大患者带来福音。
由于N-异丙基丙烯酰胺(PNIPAAm)的低临界溶解温度(LCST)(32℃)接近人体生理温度(37℃),从而成为最值得研究和开发的水凝胶。化学交联的PNIPAAm水凝胶大分子侧链上同时具有亲水性的酰胺基(-CONH)和疏水性的异丙基[-CH(CH3)2],因而是一种典型的温敏水凝胶。PNIPAAm水凝胶通过共价键、氢键或范德华力等作用相互交联构成三维网状结构,其网络中可容纳本身重量的数倍至数百倍的水,是一种集吸水、保水、缓释于一体的高分子材料。该水凝胶在LCST附近存在可逆的不连续体积相转变,当温度高于32℃时,表现出强烈的疏水性,体积急剧收缩;当温度低于32℃时,表现出明显的亲水性,凝胶重新溶胀。PNIPAAm水凝胶敏锐的温度敏感性使其在化学阀、生物分离、活性酶包埋等方面有着广阔的应用前景[7-10]。
本研究中将选用PNIPAAm水凝胶作为制备伤口敷料的一种原材料,利用其对正常和受伤皮肤温度差异的感知而发生体积相转变,从而在伤口愈合后自动剥离。但因PNIPAAm机械性能很差,在吸水后甚至不能承受自身重量,从而使其应用受到了限制。对此,常将其与其他材料复合,在保留其温敏特性的同时改善其力学强度。壳聚糖(Chitosna,CS,(1-4)-2-氨基-2-脱氧-β-D-葡萄糖)是甲壳素的部分或全部N-脱乙酰基产物,分子链上分布着大量羟基、氨基及酰氨基团,可形成很多分子内和分子间氢键[11-12],从而赋予CS良好的机械性能、生物活性和成膜性,加之CS良好的抗菌性能,使之在生物医学领域有广泛的应用,如用作骨水泥、骨引导再生膜、组织皮肤等[13-15]。因此,本文将NIPAAm与CS复合,优势互补,取长补短,希望制备一种具有一定力学强度和温敏特性的自剥离复合皮肤敷料,并对膜的结构和性能进行分析评价,以探讨其作为自剥离皮肤敷料的可行性。
1材料与方法
1.1试剂
N-异丙基丙烯酰胺(NIPAAm,上海物竟化工科技有限公司),甲苯重结晶(AR);NN′-亚甲基双丙烯酰胺(MBA,成都科龙化工试剂厂),甲醇重结晶(AR);过硫酸钾(APS,成都科龙化工试剂厂); 亚硫酸氢钠(SBS天津市塘沽鹏达化工厂);脱乙酰度95 %的壳聚糖(医用级,济南海得贝化学试剂公司)。
1.2膜的制备
于1 000 mL 单口瓶中依次加入16 g(140.89 mmol) NIPAAm 、0.8 g (5.88 mmol) MBA、0.22 g( 2.14 mmol) SBS和400 mL去离子水, 搅拌至完全溶解, 5℃下通入氮气25 min,然后加入0.58 g (2.14 mmol) KPS 并立即密封单口瓶,5℃下130 r·min-1搅拌反应24 h,即得PNIPAAm 溶液。 取出1/4溶液置于表面皿,在室温下静置4 h得PNIPAAm 水凝胶,用去离子水充分浸泡,冻干,储存备用。剩余PNIPAAm溶液平均分三份,分别加入含有1.71, 2.67 ,4.00 g CS 的醋酸溶液,在 5℃下以130 r·min-1继续搅拌,反应4 h后分别于表面皿中冻干,用0.1 mol·L-1氢氧化钾溶液脱模即得PNIPAAm/CS 复合膜,用去离子水充分浸泡,冻干储存备用。
1.3测试
采用Nicolet Perkin Elmer Co傅立叶变换红外光谱仪(FTIR)分析膜的组分变化;用日本 JEM-100CX型扫描电子显微镜(Scanning electron microscope,SEM)观察其表面形貌;用美国 METTLER TOLEDO的差热分析仪(DSC)测试复合膜的LCST;通过观察复合膜在LCST前后表面形貌的变化,分析复合膜的温度响应性,并测试复合膜在水中的溶胀率。溶胀率按下式计算:
溶胀率 (%) = [(Wt-Wd)/Wd] ×100%,
式中,Wt为复合膜在时间t时质量,Wd为干燥复合膜质量。
2结果与讨论
2.1复合膜的红外光谱分析
CS、PNIPAAm和复合膜的红外光谱图如图1。图1a中,3 435.94 cm-1处的宽峰为-OH伸缩振动吸收峰与-NH伸缩振动吸收峰重叠而增宽的多重吸收峰;2 923.18 cm-1和2 849.47 cm-1处为C-H的两个伸缩振动吸收峰;1 627.85 cm-1处为伯胺-NH2的对称弯曲振动吸收峰;而在1 080 cm-1处的吸收峰则是壳聚糖的-CH2-OH中C-O的伸缩振动吸收峰[16]。图1b中,3 437.66 cm-1处宽峰是仲酰胺-NH-的伸缩振动峰,而PNIPAAm典型的酰胺羰基的C=O伸缩振动峰(酰胺I峰)和仲酰胺N-H弯曲和C-N伸缩联合振动峰(酰胺II峰)的双吸收峰分别出现在1 648.51 cm-1和1 545.27 cm-1;2 974 cm-1、2 934.62 cm-1和2876.66 cm-1处为甲基、亚甲基及次甲基的C-H伸缩振动峰。1 460.60 cm-1处为甲基及亚甲基C-H不对称弯曲振动峰,1 391.32 cm-1处为甲基及亚甲基的C-H对称弯曲振动峰;1 173.18 cm-1处为-CH(CH3)2中C-C骨架的伸缩振动峰。
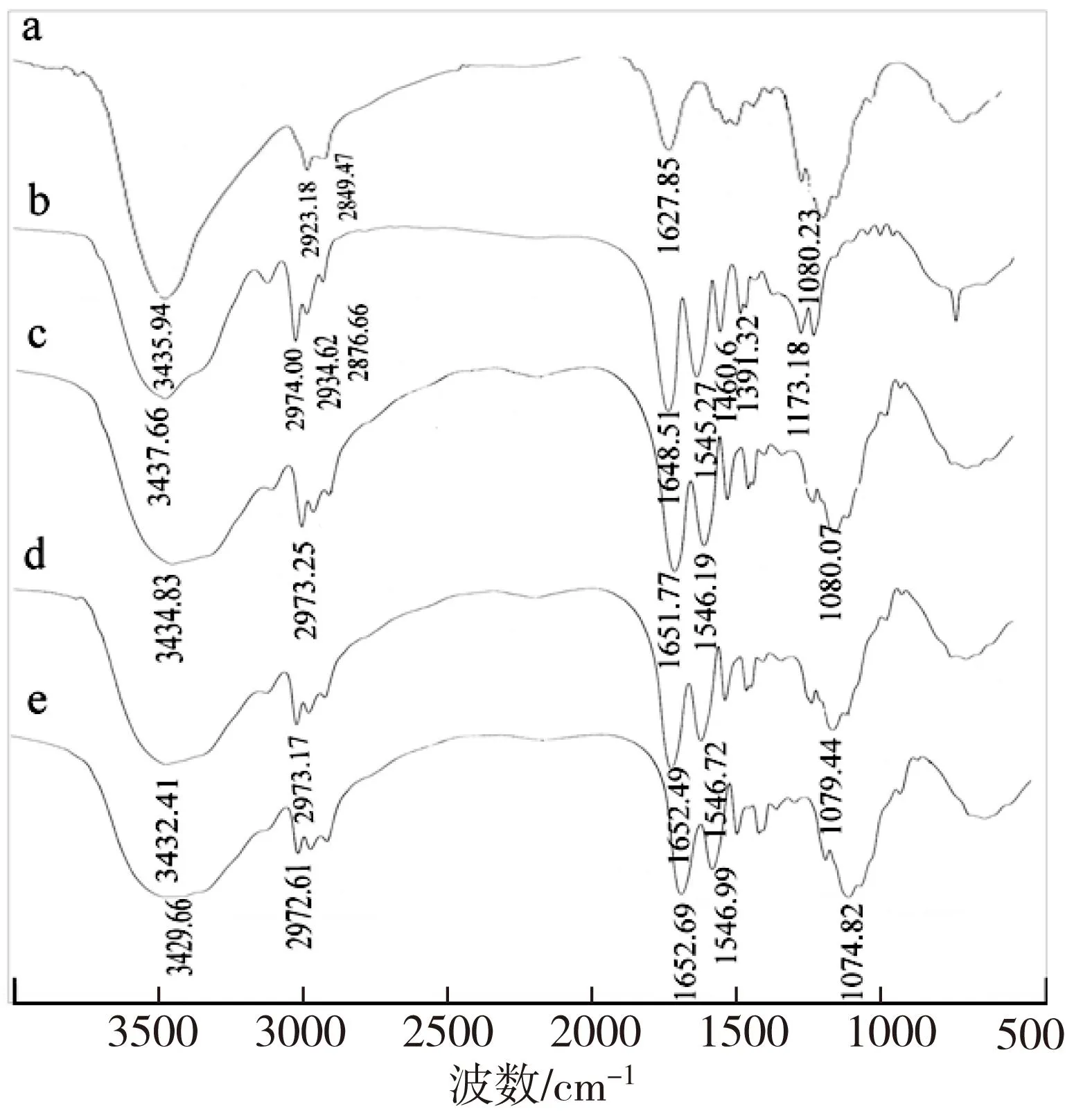
图1 CS(a)、PNIPAAm(b)和复合膜70/30(c)、
图1c-e是PNIPAAm/CS复合膜的红外光谱。CS的-OH伸缩振动吸收峰与-NH-伸缩振动吸收峰重叠而增宽的多重吸收宽峰和PNIPAAm的仲酰胺-NH-的伸缩振动宽峰在3433 cm-1左右重叠变宽,此外,复合膜中3433 cm-1左右重叠宽峰随着CS含量增加而略向低波数方向移动,且峰宽进一步变大,这可能是二者之间氢键作用及氢键数目随CS含量上升而增加引起的。从图1c-e可以看出,PNIPAAm的主要功能基团即亲水的酰胺基-CONH-和疏水的异丙基-CH(CH3)2在复合膜中均有出现,这两种基团在复合膜的溶胀-退胀过程中起着关键的作用。红外分析结果表明,在聚合、复合过程中PNIPAAm的酰胺基没有发生水解,复合膜保留了PNIPAAm的主要功能基团。CS的主要特征峰亦在复合膜的红外谱图中出现,说明两组分在复合前后性能均无显著变化。
2.2复合膜的扫描电镜图片分析
CS、PNIPAAm和复合膜在 50和2000倍数下的SEM图片如图2,其中右上角插入的小图为低倍下的SEM图片。从图2a中可以看出,CS膜表面相对平整光滑,无孔隙出现。而PNIPAAm表面却呈现疏松、类似管状无规则结构的三维多孔形貌(如图2b),这是PNIPAAm水凝胶在干燥过程中失去其所含的大量水分,从而出现大量孔隙,同时由于失水引起结构塌陷而使孔结构不甚规则。

图2 CS(a)、PNIPAAm(b)和复合膜70/30(c)、
不同组分比例的复合膜SEM形貌图如图2c-e,可以看出这三类复合膜均为三维多孔结构,且随着CS含量增加孔径显著变小,孔结构呈现更加规则的近圆形管状结构。一方面,随着壳聚糖含量上升复合膜的含水量逐渐降低,水所占据的空间位置减少,故在干燥失水后孔隙率降低;另一方面,CS含量上升使复合膜的力学强度提高,在失水后复合膜仍维持较高的骨架强度而不塌陷,改善了单纯PNIPAAm水凝胶失水塌陷的状况,从而使复合膜的孔结构变得均匀而规则。
2.3复合膜的溶胀性能分析
CS、PNIPAAm和复合膜的溶胀曲线如图3。可以看出,所有测试样品的溶胀率随时间延长而上升,其中单纯CS膜的吸水率最低(如图3e),溶胀平衡时其吸水率仅106 %, 而纯PNIPAAm膜(如图3a)溶胀平衡后的吸水率为1 525 %。从图3b-d中可发现,三种不同组分比例的复合膜达到溶胀平衡时的吸水率介于纯CS膜和纯PNIPAAm膜之间,而且复合膜的溶胀平衡吸水率随CS含量增加而降低,分别为422 %、357 %、305 %。通常,溶胀过程是水分子向膜的内部渗透,引起高分子链伸展,一部分水分子吸附于复合膜内,一部分与高分子链上亲水基团形成氢键而结合。随着CS含量增加复合膜中PNIPAAm含量相对降低,亲水基团-CONH-数目减少;而且CS的-OH和-NH2基团与PNIPAAm的亲水基团-CONH-间形成分子间氢键,使得亲水基团-CONH-和水分子结合机会减少;此外,CS在32℃以下的亲水性要低于PNIPAAm,三种情况的共同作用使得复合膜的溶胀平衡吸水率降低,并与复合膜中CS的含量成反比。这与SEM图片中观察到的结果一致,即干燥后复合膜的孔隙率与其中CS的含量成反比。
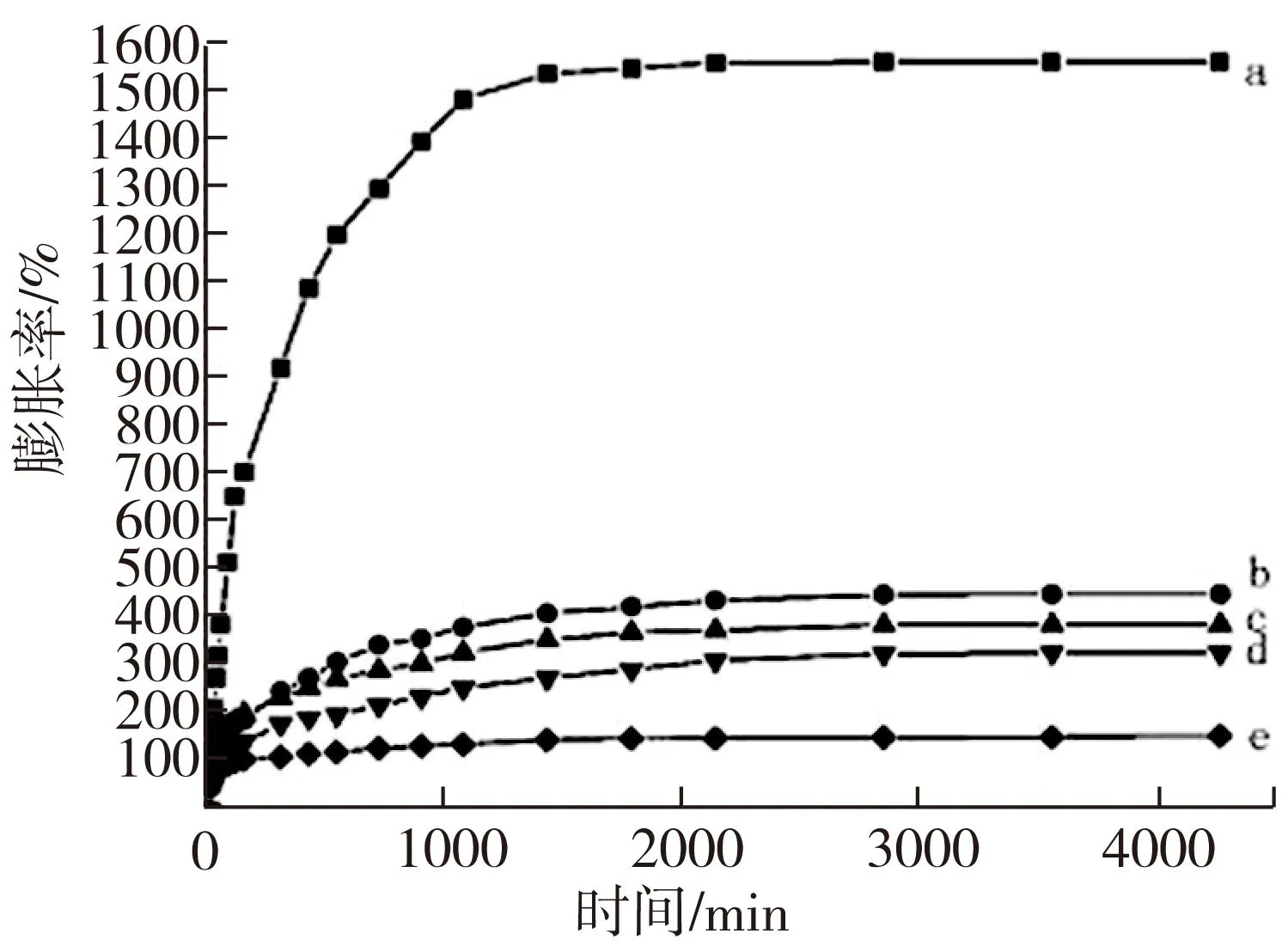
图3 PNIPAAm(a)和复合膜70/30(b)、60/40(c)、
2.4复合膜LCST的测定
CS、PNIPAAm和复合膜在水中达到溶胀平衡后的差热分析(DSC)曲线如图4。可以看出,CS(如图4a)在20 ℃至45 ℃温度范围内未发生相转变,而PNIPAAm(如图4b)和复合膜(如图4c-e)在此温度范围内均有一明显的吸热峰,起始相转变的温度分别为32.5 ℃ 、32.3 ℃、32 ℃和31.8 ℃,即随着CS含量的增加,相转变的起始温度略有下降。这说明CS的加入并未显著改变PNIPAAm固有的温敏特性,但CS和PNIPAAm之间的相互作用使大分子发生了重排,从而导致复合膜的相转变温度比纯PNIPAAm的LCST略有降低。
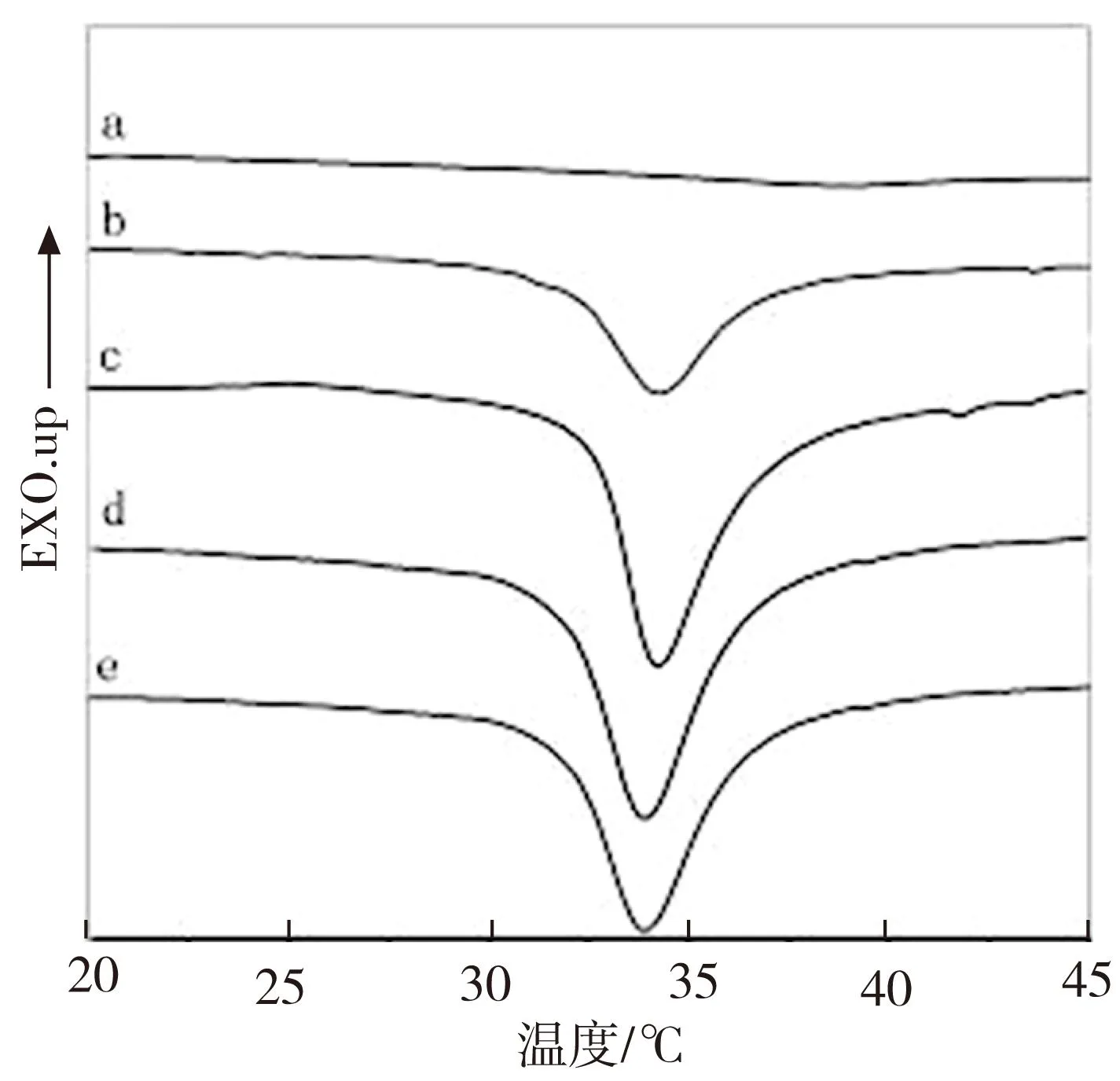
图4 CS(a)、PNIPAAm(b)和复合膜70/30(c)、60/40(d)、
2.5复合膜在相转变温度前后的表观变化
PNIPAAm/CS(60/40)复合膜在水中达到溶胀平衡后分别在25℃和37℃的照片如图5。

图5 PNIPAAm/CS(60/40)复合膜在不同温度下
很显然,在相转变温度前后复合膜的形状和颜色均有明显变化。当温度低于PNIPAAm水凝胶的相转变温度(32 ℃),为25 ℃时,复合膜中高分子的亲水基团通过氢键和环境中的水分子结合,使得水分子被束缚形成稳定的水合结构,复合膜处于有序化程度较高的吸水膨大状态,高分子链舒展,透明度增加,处于溶胀舒展状态;当温度高于相转变温度,为37 ℃时,复合膜脱水皱缩,颜色变白,处于致密收缩状态。即温度的改变使得复合膜中高分子由疏松的线团结构变为紧密的胶粒状结构,发生了无规线团状(coil)-蜷曲球状(Globule)转变。复合膜的温度敏感性依然由PNIPAAm的亲水基团-CONH-和疏水基团-CH(CH3)2交互控制,温度高于PNIPAAm的LCST时,复合膜中疏水的异丙基-CH(CH3)2作用占主导地位,使复合膜脱水塌陷而发生皱缩。正是由于复合膜在LCST前后的相转变行为使其具有作为智能伤口敷料的潜力,因皮肤创口处由于炎症及异物反应,其表面温度往往在38℃以上,高于复合膜的LCST,此时多孔致密的复合膜可紧密贴覆于伤口表面,减轻疼痛,保护伤口,保持伤口处湿度;当创口愈合,温度降至正常的体表温度31 ℃左右,低于复合膜的LCST,这时复合膜会结合环境中的水而发生体积相转变,舒展膨大,无法支持自重,从伤口表面脱落,从而实现敷料的智能自剥离。
3结论
研究表明,PNIPAAm/CS复合膜依然具备较敏锐的温敏性,但其相转变温度有略微降低,在31.8 ℃左右,非常接近于人的体表温度。随CS含量增加,PNIPAAm/CS复合膜中两相间分布更为均匀,分子间形成更强的相互作用,复合膜呈现规则的三维多孔结构,改善了单一组分PNIPAAm水凝胶失水塌陷的缺点,提高了复合膜的力学强度。而复合膜的溶胀平衡吸水率也随CS含量的增加从422 %降至305 %左右。因人体表温度为32 ℃左右,而两相质量比在7:3~5:5的PNIPAAm/CS复合膜相转变温度与此最为接近,故此类复合膜有望作为一种应用前景广阔的自剥离皮肤伤口敷料。
参考文献:
[1] SHEVCHENKO R V, JAMES S E, et al. A review of tissue-engineered skin bioconstructs available for skin reconstruction [J]. J R Soc Interface, 2010,7:229-258.
[2] MI F L, WU Y B. Control of wound infections using a bilayer chitosan wound dressing with sustainable antibiotic delivery [J]. J Biomed Mater Res 2002, 59: 438-449.
[3] GUO R, XU S J. The healing of full-thickness burns treated by using plasmid DNA encoding VEGF-165 activated collagen-chitosan dermal equivalents [J]. Biomaterials. 2011,32:1019-1031.
[4] 黄爱宾,郭瑞,徐少骏,等.胶原-磺化羧甲基壳聚糖/硅橡胶皮肤再生材料的制备及其对小型猪烫伤创面全层皮肤缺损的修复研究[J]. 高分子学报,2009(2):111-117.
[5] 何谷,陈煜.聚乙烯醇/壳聚糖互穿聚合物网络海绵的制备及应用探索[J]. 高分子材料科学与工程,2011,27(1):150-153.
[6] 李学川,乔亮. 吸水性聚氨酯泡沫敷料促进皮肤移植供皮区愈合的疗效观察[J]. 上海交通大学学报(医学版),2013,33(5):663-666.
[7] HENDERSON E, LEE B H. In vivo evaluation of injectable thermosensitive polymer with time-dependent LCST [J]. J Biomed Mater Res, 2009, 90A: 1186-1197.
[8] LIN F H, TSAI J C. Fabrication and evaluation of auto-stripped tri-layer wound dressing for extensive burn injury [J]. Mater Chem Phys, 2007, 102: 152-158.
[9] CHEN K S, KU Y A. Immobilization of chitosan gel with cross-linking reagent on PNIPAAm gel/PP nonwoven composites surface [J]. Mater Sci Eng, 2005, 25:472-478.
[10] 秦爱香,吕满庚. 快速响应的温敏性聚(N-异丙基丙烯酰胺)水凝胶的合成及表征[J]. 应用化学,2006, 23(6):581-585.
[11] MI F L, WU Y B. Asymmetric chitosan membranes prepared by dry/wet phase separation: a new type of wound dressing for controlled antibacterial release [J]. J Membrane Sci, 2003, 212:237-254.
[12] ONG S Y, WU J. Development of a chitosan-based wound dressing with improved hemostatic and antimicrobial properties [J]. Biomaterials, 2008, 29: 4323-4332.
[13] ISHIHARA M, NAKANISHI K. Photocrosslinkable chitosan as a dressing for wound occlusion and accelerator in healing process [J]. Biomaterials, 2002, 23: 833-840.
[14] MA L, GAO C Y. Collagen/chitosan porous scaffolds with improved biostability for skin tissue engineering [J]. Biomaterials, 2003, 24: 4833-4841.
[15] WANG X H, LI D P. Covalent immobilization of chitosan and heparin on PLGA surface [J]. Int J Biol Macromol, 2003, 33: 95-100.
[16] ADEKOGBE I ,GHANEM A. Fabrication and characterization of DTBP-crosslinked chitosan scaffolds for skin tissue engineering [J]. Biomaterials, 2005, 26: 7241-7250.
(责任编辑邹永红)
Poly (N-isopropyl Acrylamide)/Chitosan Composite Membrane withSmart Thermo-responsive Performance——Study on Fabrication and Properties of Self-peeling Wound Dressing
LI Chenga, LI Yanb
(a.College of Polymer Science and Engineering;b.Analytical & Testing Center,Sichuan University, Chengdu Sichuan 610064,China)
Abstract:In this study, poly (N-isopropylacrylamide) / chitosan (PNIPAAm / CS) composite membranes were fabricated, in which PNIPAAm was directly synthesized using NIPAAm monomers by means of free radical polymerization. Fourier transform infrared (FT-IR) spectroscopy was employed to characterize the membranes and the interactions. The lower critical solution temperature (LCST) of the swollen membrane was determined by differential scanning calorimetry (DSC). The morphologies of the obtained membranes were observed using scanning electron microscopy (SEM). The results showed that the composite membrane had good thermo-responsive performance. The construction of membrane became more regular with the increasing of CS. The hydrogen bondings have been formed between the two compositions of CS and PNIPAAm. Obvious phase conversion and shape change of the composite membrane have occurred below and above the LCST, which enhanced the mechanical properties of the composite menbrance. The results also showed that water absorption and mechanical properties of the menbrane were also affected by the PNIPAAm content.
Key words:thermo-responsive; PNIPAAm; chitosan; composite membrane
收稿日期:2016-01-12;最后修回日期:2016-03-15
作者简介:李澄(1993-),男,辽宁大连人,主要从事高分子材料研究。
文章编号:2096-1383(2016)03-0237-05
中图分类号:O633.22
文献标志码:A

