miR-92a在结直肠癌中的表达及其对肿瘤血管生成的作用*
王秀 杜冀晖 黄虞 龚慧 王磊 李一凡
miR-92a在结直肠癌中的表达及其对肿瘤血管生成的作用*
王秀杜冀晖黄虞龚慧王磊李一凡
摘要目的:探讨miR-92a在结直肠癌中的表达及其对肿瘤血管新生功能的影响和作用机制。方法:采用qRT-PCR方法检测广东医学院附属深圳南山医院2014年6月至2015年12月经手术切除的25例结直肠癌组织和对应癌旁组织及4种结直肠癌细胞(HCT116、SW620、SW480、HT29)中miR-92a的表达;免疫组织化学法检测结直肠癌和癌旁组织中CD31阳性表达的微血管密度(microvessel density,MVD),Pearson相关性分析探讨miR-92a表达与肿瘤血管新生MVD的相关性。通过转染miR-92a-mimic、inhibitor上调或抑制结直肠癌细胞HCT116、SW620中miR-92a的表达水平,采用小管形成实验检测miR-92a不同表达对HUVEC小管形成的影响,免疫印迹法检测对其下游潜在靶点PTEN的蛋白表达的影响。结果:结直肠癌组织miR-92a的表达水平显著高于对应癌旁组织(P<0.01);4种人结肠癌细胞系miR-92a的表达水平均显著高于正常肠上皮组织(P<0.05);结直肠癌组织CD31阳性微血管密度显著高于癌旁组织(P<0.01),miR-92a表达水平与结直肠癌血管新生MVD呈显著正相关(r=0.580,P=0.01);上调miR-92a表达的HCT116细胞培养上清液可以显著促进HUVEC小管形成(P<0.05);上调miR-92a表达可以显著抑制HCT116细胞中PTEN蛋白表达水平(P<0.01)。结论:miR-92a在结直肠癌细胞和组织中高表达,与肿瘤血管新生增加密切相关;miR-92a可能通过抑制PTEN的表达发挥促进结直肠癌血管新生的生物学功能。
关键词miR-92a结直肠癌血管新生PTEN
作者单位:广东医学院附属深圳南山医院中心实验室(广东省深圳市518052)
*本文课题受深圳市科技计划项目(编号:JCYJ20140411092959841)和深圳市南山区技术研发和创意设计项目分项资金教育(卫生)科技项目(编号:南科研卫2013002)资助
结直肠癌(colorectal cancer,CRC)是人类常见的消化系统恶性肿瘤,发病率居恶性肿瘤的第3位,起病隐匿,预后较差[1]。近年研究发现,microRNAs (miRNAs)是一类独特的非编码小RNA,在肿瘤细胞中高表达或低表达起到癌基因或抑癌基因的作用,使细胞增殖和分化失去控制,导致肿瘤的发生发展[2]。研究证实,miR-92a在结直肠癌等多种肿瘤组织中异常高表达[3],并与结肠癌的淋巴结转移和预后相关[4],因此,miR-92a被认为是一种癌基因,可能在CRC发生发展中起着关键调控作用[5]。具有非可控的血管新生能力是恶性肿瘤的基本生物学特征之一,肿瘤的生长、侵袭和转移均与血管新生密切相关。研究发现,miR-92a与血管内皮细胞形成、肿瘤血管新生有关[6-7]。然而,目前有关miR-92a对结直肠癌血管新生功能的影响及其调控机制尚不清楚。本研究检测miR-92a在结直肠癌组织中的表达水平,分析其与肿瘤血管新生的相关性;通过转染miR-92amimic、inhibitor上调或抑制结直肠癌细胞HCT116、SW620中miR-92a的表达水平,观察miR-92a对HUVEC血管内皮细胞新生功能的影响及对其下游潜在靶点PTEN表达的调控作用,探讨miR-92a影响结直肠癌血管新生的作用及机制,为结直肠癌的分子靶向治疗提供实验依据。
1 材料与方法
1.1材料
1.1.1组织标本收集广东医学院附属深圳南山医院2014年6月至2015年12月经手术切除的结直肠癌及对应癌旁组织(距肿瘤边缘>4 cm)标本25例。其中男性12例,女性13例;年龄32~84岁,平均年龄(59.2±13.1)岁。入选患者均知情同意并且经过本院伦理审查委员会审查批准,术前未经放化疗治疗,切除标本分别于液氮或中性甲醛中保存。
1.1.2细胞株人结直肠癌细胞HCT116、SW620、HT29、SW480由香港中文大学赠与,人脐静脉内皮细胞HUVEC由中山大学赠与。
1.1.3主要试剂TRIzol Reagent、Lipofectamine®2000、RNA逆转录及扩增试剂盒均购自美国Life Technologies公司;逆转录引物、miR-92a上游引物和下游引物、miR-92a-3p mimic和miR-92a-3p inhibitor及相应阴性对照均由广州市锐博生物科技有限公司合成;高糖DMEM培养基购自美国HyClone公司,人脐静脉内皮细胞Human Endothelial SFM培养基及添加因子购自美国Life Technologies公司,Matrigel基质胶购自美国BD公司;兔抗人PTEN单克隆抗体(ab154814,克隆号:EPR7495)购自英国Abcam公司;羊抗兔二抗(111-035-003)购自美国Jackson公司;兔抗人GAPDH单抗(10494-1-AP)购自美国Proteintech公司;鼠抗人CD31单抗(ZM-0044,克隆号:1A10)购自北京中杉金桥生物技术有限公司;ABC免疫组织化学试剂盒(PK-6102)购自美国Vector公司。
1.2方法
1.2.1细胞培养结直肠癌细胞HCT116、SW620、HT29和SW480培养于高糖DMEM完全培养基,人脐静脉内皮细胞HUVEC采用Endothelial SFM基础培养基添加生长因子构成的完全培养基培养,37℃、5% CO2培养、稳定传代2~3代,取对数生长期细胞进行后续实验。
1.2.2qRT-PCR方法检测miR-92a表达按TRIzol试剂说明书提取结直肠癌组织和细胞中总RNA,按照RNA逆转录试剂盒说明书设置反转录条件。每个样本取1 μg总RNA进行逆转录反应,反应条件为42℃60 min,70℃10 min。取1 μL cDNA进行PCR扩增,反应条件为50℃2 min,95℃10 min,95℃变性15 s,60℃退火延伸1 min,40个循环。组织中miR-92a表达采用绝对定量方法,根据标准品建立标准曲线和回归方程,计算miR-92a的浓度。miRNAs定量进行标准化,结果以总RNA/μg中的miRNAs含量表示(fmol/μg总RNA)。细胞中提取的RNA以U6作为内参,采用2-△△Ct的方法计算各组miR-92a的相对表达量,实验重复3次,计算平均值。
1.2.3免疫组织化学法检测结直肠癌组织血管新生情况组织标本常规脱水、石蜡包埋,制作4 μm切片。采用柠檬酸盐缓冲液进行高压热修复,一抗为鼠抗人CD31单抗(1:100),以PBS代替一抗作为阴性对照,以已知阳性片作为阳性对照,按照ABC法检测内皮细胞CD31表达。血管新生情况以微血管密度(microvessel density,MVD)表示,以CD31阳性表达的棕黄色血管内皮细胞或细胞簇代表1条单独的微血管,先在低倍镜(×100)下选择血管高密度区,再于高倍镜(×400)下随机选取5个视野,计算其微血管数目平均值。
1.2.4细胞转染取对数生长期人结直肠癌细胞HCT116和SW620细胞进行瞬时转染。细胞接种于6孔板中,培养细胞至融合度达60%左右。实验组分别加入50 nM miR-92a mimic和100 nM的miR-92a inhibitor及5 μL转染试剂;对照组分别加入相应阴性对照(negative control,NC)。1×Opti-MEM培养基调整终体积至2 mL培养6 h,更换培养基继续培养。细胞转染48 h后收集各组细胞用于提取RNA,转染72 h后收集细胞蛋白和无血清培养上清液(条件培养基)用于后续实验。
1.2.5小管形成实验96孔板每孔铺50 μL Matrigel基质胶、接种1×104个HUVEC,培养24 h,实验组、对照组分别加入对应已收集的转染miR-92a mimic、inhibitor的HCT116和SW620细胞条件培养基100 μL,37℃、5%CO2环境中培养,6 h后于显微镜下观察,HUVEC生长形成闭合环状小管样结构的作为1个新生小管进行计数。每组设3个复孔,每孔取3个视野计算平均值。
1.2.6免疫印迹法检测PTEN表达制备10%SDSPAGE凝胶,每孔加入30 μg蛋白样品,经SDS电泳1 h分离蛋白,湿法电转PVDF膜3 h,5%脱脂牛奶封闭1 h,加入兔抗人PTEN一抗(1:2 000),于4℃孵育过夜,TBST漂洗3次,10 min/次。加入羊抗兔二抗(1:4 000),常温孵育1 h,TBST漂洗6次,5 min/次。滴加ECL显影液,采用化学发光成像仪成像,测定目的条带灰度值、分析蛋白表达,以GAPDH为内参计算PTEN蛋白相对表达量。
1.3统计学方法
采用SPSS 19.0软件进行统计学分析,计量资料结果用x±s表示,采用Kolmogorov-Smirnov检验法进行数据正态性检验,对于符合正态分布数据,两组间均值差异比较采用t检验,结直肠癌组织miR-92a表达与血管新生MVD的相关性采用Pearson相关性分析,以P<0.05为差异具有统计学意义。
2 结果
2.1miR-92a在结直肠癌组织及细胞中的表达
结直肠癌患者的癌组织(T)及与其相对应的癌旁组织(TAT)miR-92a的表达水平(图1A)所示。25例CRC组织的miR-92a表达水平为(1.102±0.735)(fmol/μg总RNA),显著高于癌旁组织的(0.037±0.031)(fmol/μg总RNA),差异具有统计学意义(t=7.405,P<0.01)。以正常结直肠上皮黏膜组织(normal tissue,NT)为对照,4种CRC细胞系中miR-92a的表达水平均显著高于正常对照,差异均具有统计学意义(P<0.05)。其中HCT116细胞miR-92a表达最低,SW620细胞miR-92a表达最高(图1B)。
2.2miR-92a表达与结直肠癌血管新生MVD的相关性
免疫组织化学法染色检测25例结直肠癌组织和对应癌旁组织血管新生情况(图2)。结果显示,CRC癌组织CD31阳性表达的MVD为(27.400±7.560),显著高于对应癌旁组织MVD数量(10.760±3.140),差异具有统计学意义(t=9.829,P<0.01)。Pearson相关性分析显示,结直肠癌组织中miR-92a的表达与CD31阳性的微血管密度呈显著正相关(r=0.580,P=0.01)。
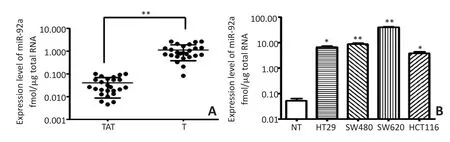
图1 miR-92a在结肠癌组织及细胞中的表达水平Figure 1 Expression of miR-92a in CRC tissue and cell

图2 结直肠癌组织miR-92a表达与肿瘤血管新生的相关性Figure 2 Correlation between miR-92a expression and tumor angiogenesis in CRC
2.3miR-92a高表达和抑制表达的细胞模型建立
分别选择miR-92a表达相对最低、最高的HCT116、SW620细胞,通过瞬时转染miR-92a-mimic、inhibitor上调或抑制其miR-92a的表达水平,结果所示(图3)与阴性对照组比较,HCT116细胞转染miR-92a mimic 48 h后,其miR-92a的水平显著升高(t=7.439,P<0.05),SW620细胞转染miR-92a inhibitor 48 h后,其miR-92a的水平显著降低(t=-45.916,P<0.01)。
2.4结直肠癌细胞miR-92a高表达或抑制表达对HUVEC小管形成能力的影响
小管形成实验结果显示,应用转染miR-92a mimic上调HCT116细胞miR-92a表达的条件培养基作用6 h,HUVEC形成完整闭合小管的数量明显高于对照组(t=5.563,P<0.05);相反,应用转染miR-92a inhibitor抑制SW620细胞miR-92a表达的条件培养基作用6 h,HUVEC形成闭合小管的数量明显低于对照组(t=-6.107,P<0.05,图4)。
2.5miR-92a高表达或抑制表达对结直肠癌细胞PTEN蛋白表达的影响
经Targetscan软件对miR-92a的靶向基因进行预测,结果显示miR-92a的种子序列与PTEN基因3'UTR之间存在靶向结合位点(图5A),提示PTEN可能是miR-92a的调控靶基因。转染miR-92a mimic使HCT116细胞miR-92a显著升高,其PTEN蛋白条带灰度值下降26.40% (t=-15.176,P<0.01);转染miR-92a inhibitor使SW620细胞中miR-92a表达水平显著降低,其PTEN蛋白条带灰度值升高21.98%(t=10.911,P<0.01,图5B,5C,5D)。结果提示miR-92a的表达水平与PTEN蛋白表达呈负相关。
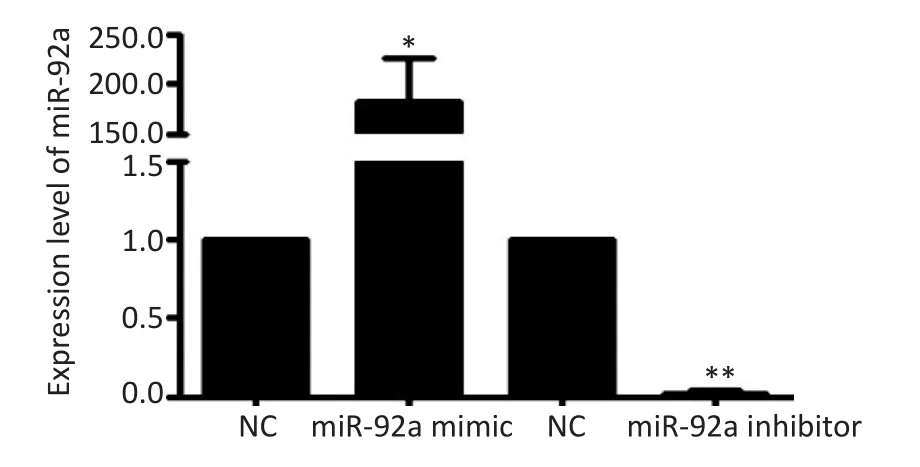
图3 转染miR-92a mimic、inhibitor上调或抑制结直肠癌细胞miR-92a表达水平Figure 3 Expression of miRNA-92a in HCT116 and SW620 cells transfected with miR-92a mimic or inhibitor
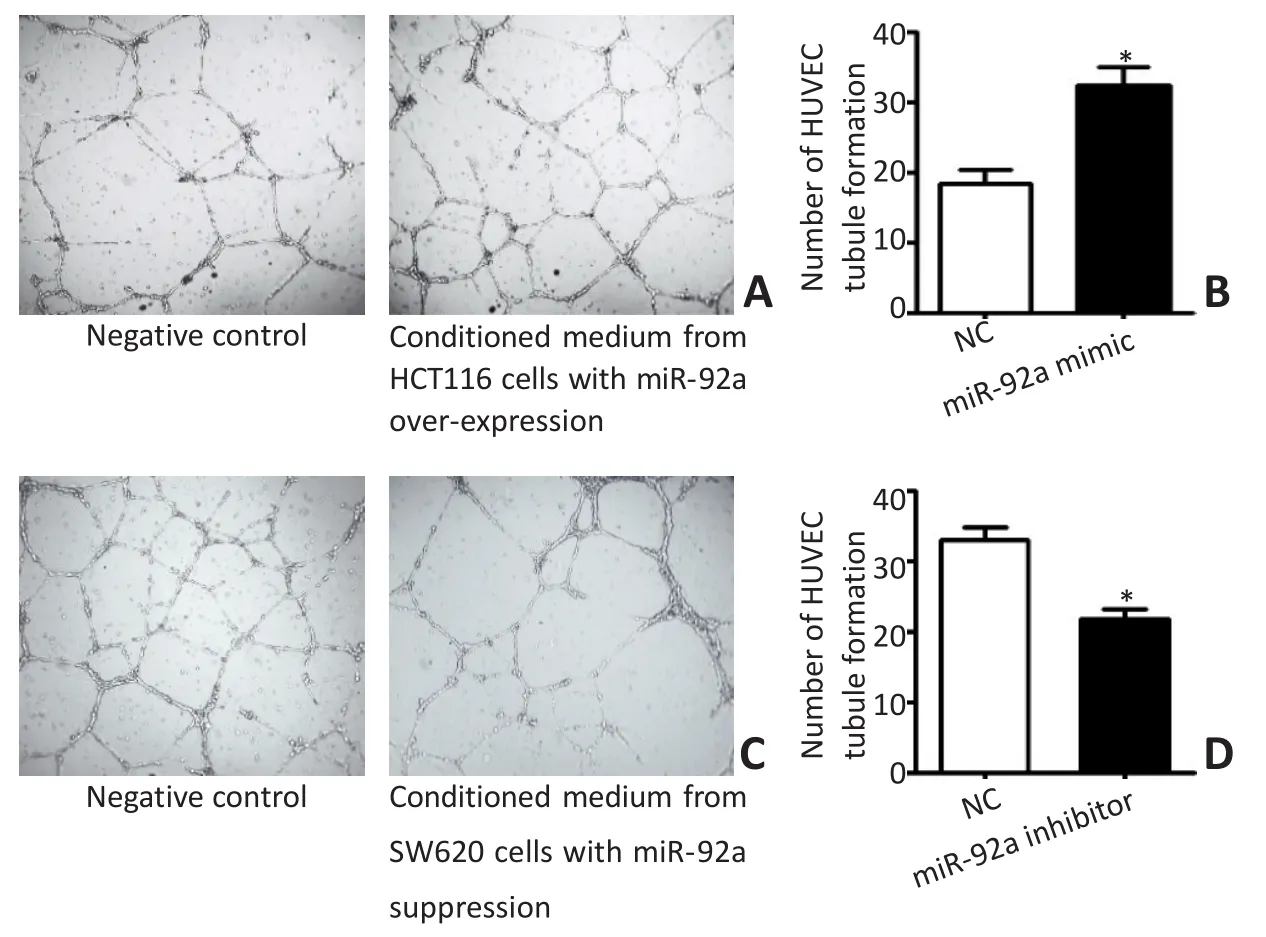
图4 结直肠癌细胞miR-92a高表达或抑制表达对HUVEC小管形成能力的影响Figure 4 Effect of miR-92a overexpression or suppression in CRC cells on the formation of HUVEC tubules
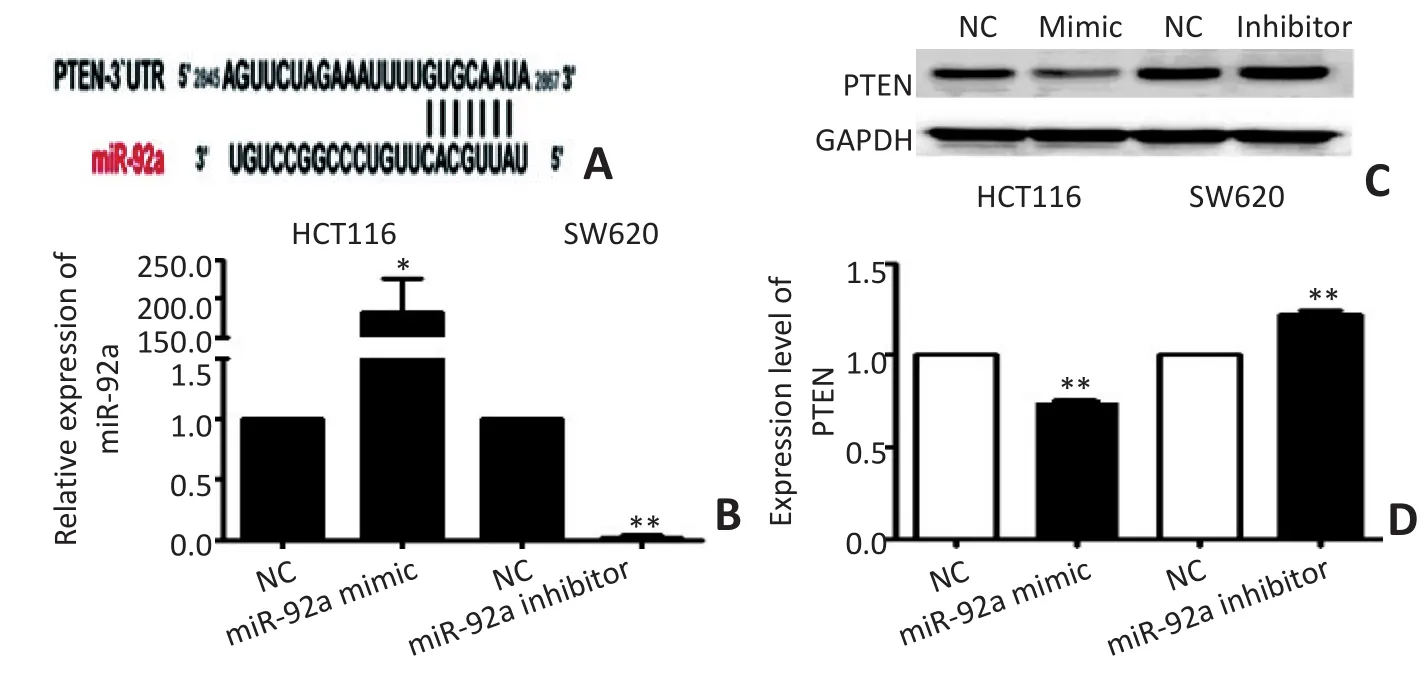
图5 miR-92a高表达或抑制表达对结直肠癌细胞PTEN蛋白表达的影响Figure 5 Effect of miR-92a overexpression or suppression on the PTEN protein expression in CRC cells
3 讨论
近年研究发现,结直肠癌中存在多种miRNA的异常表达,其靶基因参与调控结直肠细胞的恶性转化、增殖、转移等进程[8]。miR-92a是miR-17-92基因簇家族的一员,Ng等[9]研究发现miR-17-3p、miR-92在结直肠癌组织和患者血浆中升高。本课题组前期研究发现miR-92a在结直肠癌患者血清中异常高表达,有望作为新型的CRC诊断标志物[10]。本研究进一步证实结直肠癌组织中miR-92a的表达水平显著高于对应癌旁组织;4种人结肠癌细胞中miR-92a的表达水平均显著高于正常肠上皮对照,与其他报道一致[3-4,9],提示miR-92a在结直肠癌中可能发挥促癌基因的作用。
研究表明,miRNA能通过靶向作用于血管生成因子和蛋白激酶,调控血管生成的信号,从而促进或抑制肿瘤的血管生成[11]。Dews等[7]研究发现在k-RAS转化的肠道细胞中过表达miR-17-92基因簇,能够促进肿瘤血管的生长。本研究显示,miR-92a高表达的癌组织CD31阳性MVD显著高于miR-92a低表达的癌旁组织,miR-92a表达水平与结直肠癌微血管密度呈显著正相关。通过在结直肠癌细胞HCT116和SW620中分别转染miR-92a mimic及inhibitor上调和下调miR-92a的表达,结果表明高表达miR-92a的细胞培养上清液能显著促进HUVEC的小管形成,而miR-92a低表达的细胞培养上清液作用于HUVEC的小管形成明显减少,提示结直肠癌miR-92a高表达具有促进血管新生的生物学功能。有研究报道,结直肠癌细胞能通过分泌包含miR-92a的微泡(microvesicles,MVs)作用于血管内皮细胞,下调靶基因Dkk-3表达促进内皮细胞增殖、迁移,建立适合肿瘤血管生成的微环境,促进肿瘤生长[12]。
本研究进一步通过生物信息分析预测发现PTEN可能是miR-92a的下游调控靶基因。已知PTEN是PI3K/ AKT信号通路上重要的抑制分子,可以通过介导VEGF的表达参与血管新生的调节过程[13],PTEN的缺失或者表达下调能促进肿瘤的血管生成[14]。Zhang等[15]研究显示miR-92a通过抑制PTEN的表达,诱导结直肠癌细胞EMT转化,促进癌细胞的侵袭和转移。本研究结直肠癌细胞miR-92a的表达水平与PTEN蛋白表达呈负相关,提示miR-92a可能通过抑制PTEN的表达发挥调控作用,促进结直肠癌的血管新生。
综上所述,miR-92a在结直肠癌组织中高表达,与癌组织血管新生增加密切相关。miR-92a可能通过抑制PTEN的表达发挥促进结直肠癌血管新生的生物学功能。因此,miR-92a可能成为结直肠癌新的分子标志物及治疗靶点。由于一个miRNA可以调控多个基因的表达,有关miR-92a靶向调控肿瘤血管新生的分子机制及其在结直肠癌发生发展中的作用仍有待进一步深入探究。
参考文献
[1]Stiegelbauer V,Perakis S,Deutsch A,et al.MicroRNAs as novel predictive biomarkers and therapeutic targets in colorectal cancer[J].World J Gastroenterol,2014,20(33):11727-11735.
[2]Vishnubalaji R,Hamam R,Abdulla MH,et al.Genome-wide mRNA and miRNA expression profiling reveal multiple regulatory networks in colorectal cancer[J].Cell Death Dis,2015,22(6):e1614.
[3]Volinia S,Calin GA,Liu CG,et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proc Natl Acad Sci U S A,2006,103(7):2257-2261.
[4]Zhou T,Zhang G,Liu Z,et al.Overexpression of miR-92a correlates with tumor metastasis andpoor prognosis inpatients withcolorectal cancer [J].Int J Colorectal Dis,2013,28(1):19-24.
[5]Tsuchida A,Ohno S,Wu W,et al.miR-92 is a key oncogenic component of the miR-17-92 cluster in colon cancer[J].Cancer Sci,2011,102(12): 2264-2271.
[6]Murata K,Ito H,Yoshitomi H,et al.Inhibition of miR-92a enhances fracture healing via promoting angiogenesis in a model of stabilized fracture in young mice[J].J Bone Miner Res,2014,29(2):316-326.
[7]Dews M,Homayouni A,Yu D,et al.Augmentation of tumor angiogenesis by a Myc-activated microRNA cluster[J].Nat Genet,2006,38 (9):1060-1065.
[8]Schetter AJ,Okayama H,Harris CC.The role of microRNAs in colorectal cancer[J].Cancer J,2012,18(3):244-252.
[9]Ng EK,Chong WW,Jin H,et al.Differential expression of microRNAs in plasma of colorectal cancer patients: a potential marker for colorectal cancer screening[J].Gut,2009,58(10):1375-1381.
[10]Xu XY,Du JH,Gong H,et al.The expression of microRNAs in serum of patients with colorectal cancer and its clinical significance[J].Chinese Journal of Laboratory Medicine,2014,37(9):691-695.[许欣宜,杜冀晖,龚慧,等.microRNAs在结直肠癌患者血清中的表达及其诊断价值[J].中华检验医学,2014,37(9):691-695.]
[11]Wang W,Zhang E,Lin C.MicroRNAs in tumor angiogenesis[J].Life Sci,2015,136:28-35.
[12]Yamada N,Nakagawa Y,Tsujimura N,et al.Role of Intracellular and Extracellular MicroRNA-92a in Colorectal Cancer[J].Transl Oncol,2013,6(4):482-492.
[13]Okumura N,Yoshida H,Kitagishi Y,et al.PI3K/AKT/PTEN Signaling as a Molecular Target in Leukemia Angiogenesis[J].Adv Hematol,2012,2012:843085.
[14]Tian T,Nan KJ,Wang SH,et al.PTEN regulates angiogenesis and VEGF expression through phosphatase-dependent and-independent mechanisms in HepG2 cells[J].Carcinogenesis,2010,31(7):1211-1219.
[15]Zhang G,Zhou H,Xiao H,et al.MicroRNA-92a functions as an oncogene in colorectal cancer by targeting PTEN[J].Dig Dis Sci,2014,59 (1):98-107.
(2016-01-11收稿)(2016-03-02修回)
(编辑:邢颖校对:张抿)
王秀专业方向为miR-92a与结直肠癌血管新生研究。
E-mail:xiuxiuwang66@163.com

·临床研究与应用·
Expression of miR-92a in colorectal cancer and its effect on tumor angiogenesis
Xiu WANG,Jihui DU,Yu HUANG,Hui GONG,Lei WANG,Yifan LI
Correspondence to: Jihui DU;E-mail: jihuidu@163.com
Central Laboratory,Affiliated Nan Shan Hospital,Guangdong Medical College,Shenzhen 518052,China
This work was supported by the Shenzhen Science and Technology Project(No.JCYJ20140411092959841)and the Fund for Education and Public Hygiene of the Technological Invention and Creative Design Project of the Shenzhen Nanshan District(No.2013002)
AbstractObjective: To investigate the expression of miR-92a in colorectal cancer(CRC)and its effect on the regulation mechanisms of tumor angiogenesis.Methods: The miRNA-92a expression in 25 CRC tissues and HT29,SW620,SW480,and HCT116 CRC cells was detected using quantitative real-time polymerase chain reaction.The CD31 positive expression of blood microvessels in CRC tissues was measured by immunohistochemistry.Pearson correlation analysis was used to analyze the relationship between miR-92a and tumor angiogenesis.The miR-92a mimic or inhibitor was transfected into HCT116 and SW620 cells in vitro to upregulate or downregulate the miR-92a expression.The effect of miR-92a overexpression or suppression on the formation of human umbilical vein endothelial cell(HUVEC)tubules was detected by tube formation assay.Changes in phosphatase and tensin homolog(PTEN)protein expression were measured by Western blot.Results: The expression level of miR-92a in CRC tissues was significantly higher than that in matched adjacent tissues(P<0.01).The expression levels of miR-92a in HT29,SW480,SW620,and HCT116 colon cancer cell lines were significantly higher than that of the normal colorectal epithelium control(P<0.05).The number of CD31 positive expression of microvessel density(MVD)in CRC tissues was significantly higher than that in adjacent tissues(P<0.01),and the miR-92a expression level was positively correlated with the MVD in CRC tissues(r=0.580,P=0.01).The cell culture supernatant of HCT116 with miR-92a overexpression could significantly promote the formation of HUVEC tubules(P<0.05).The upregulation of miR-92a expression could significantly inhibit the expression of PTEN protein in CRC cells(P<0.01).Conclusion: The miR-92a was highly expressed in CRC cells and tissues,which was closely related to the formation of tumor angiogenesis in CRC.The miR-92a could promote tumor angiogenesis in CRC by inhibiting PTEN expression.
Keywords:miR-92a,colorectal cancer,angiogenesis,PTEN
doi:10.3969/j.issn.1000-8179.2016.06.012
通信作者:杜冀晖jihuidu@163.com
作者简介

