PI3K/AKT信号通路在三阴性乳腺癌细胞MDA-MB-468中的作用及三氧化二砷对其的干预作用
郭发爽,李庆华,淮宗让,李席如
(1.解放军159医院乳腺外科,河南驻马店 463000;2.解放军301医院乳腺外科,北京 100000)
PI3K/AKT信号通路在三阴性乳腺癌细胞MDA-MB-468中的作用及三氧化二砷对其的干预作用
郭发爽1,李庆华1,淮宗让1,李席如2
(1.解放军159医院乳腺外科,河南驻马店 463000;2.解放军301医院乳腺外科,北京 100000)
[摘要]目的探讨三氧化二砷通过磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信号通路对三阴性乳腺癌细胞MDA-MB-468凋亡的影响。方法实验分为空白对照组,三氧化二砷组(2、4、8 μmol/L),LY294002组(25 μmol/L),三氧化二砷(4 μmol/L)联合LY294002(25 μmol/L)组(联合组);MTT法检测各组细胞活力;流式细胞术检测各组细胞周期;Western blot分析各组PI3K/AKT通路的激活状况及其下游靶分子细胞周期蛋白A1(Cyclin A1),Cyclin D1,Bax,Bcl-2的表达。结果2、4、8 μmol/L三氧化二砷,LY294002都可显著抑制细胞活力(P<0.05),并且在48 h抑制程度最高;与对照组比较,4 μmol/L三氧化二砷及LY294002都可使细胞周期阻滞在G1期(P<0.05),并降低AKT磷酸化水平(P<0.05),进而下调Cyclin A1,Cyclin D1,Bcl-2的表达(P<0.05),上调Bax的表达(P<0.05);三氧化二砷联合LY294002处理MDA-MB-468细胞较药物单独作用效果增强(P<0.05)。结论三氧化二砷及LY294002可通过阻断PI3K/AKT信号通路来诱导三阴性乳腺癌细胞MDA-MB-468凋亡,二者具有协同作用。
[关键词]三氧化二砷;三阴性乳腺癌细胞MDA-MB-468;凋亡;PI3K/AKT信号通路
乳腺癌是女性最常见的恶性肿瘤之一,发病率逐年上升。三阴性乳腺癌是指雌激素、孕激素及原癌基因人类表皮生长因子受体-2均为阴性的乳腺癌,约占全部乳腺癌的三分之一,是预后最差的乳腺癌[1]。乳腺癌发病机制复杂,受多种信号通路调控。其中磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)与多种人类肿瘤的发生发展密切相关。PI3K/AKT可参与乳腺癌癌细胞的代谢、生长、凋亡,其活性异常可刺激下游信号分子细胞周期蛋白A1(Cyclin A1)、Cyclin D1、Bax及Bcl-2的持续表达,导致乳腺癌细胞的不可控制生长增殖[2]。
三氧化二砷是传统中药砒霜的主要成分,已成为急性早幼粒细胞白血病临床治疗药物,患者复发率低,不良反应轻,与其他化疗药物无交叉耐药。不仅如此,三氧化二砷还可抑制多种实体肿瘤生长,如消化系统肿瘤、呼吸系统肿瘤、妇科肿瘤等,其抑制肿瘤的重要机制就是诱导肿瘤细胞凋亡[3]。Guilbert等[4]研究进一步表明二氧化二砷可抑制MDA-MB-468乳腺癌细胞移植瘤的生长,并与雷帕霉素联合使用下调AKT磷酸化水平有关。因此笔者在此基础上,通过体外培养三阴性乳腺癌细胞MDA-MB-468,利用三氧化二砷及LY294002联合或单独处理乳腺癌细胞MDA-MB-468,来探讨三氧化二砷是否通过PI3K/AKT信号通路诱导MDA-MB-468细胞凋亡。
1材料与方法
1.1材料三阴性乳腺癌细胞MDA-MB-468购于中国科学院上海细胞库,目录号TCHu136,培养于含10%胎牛血清的DMEM培养基中。三氧化二砷粉剂购于北京双鹭药业股份有限公司,批号20101224。细胞周期试剂盒、β-actin、LY294002购自碧云天生物技术研究所;兔抗AKT、p-AKT、Cyclin A1、Cyclin D1、Bax和Bcl-2单克隆抗体购自美国Cell Signaling Techonology;胎牛血清、DMEM培养基、四甲基偶氮唑盐(MTT)购自美国Gibco公司。

表1 三氧化二砷及LY294002对MDA-MB-468细胞活力抑制率的影响,%)
aa:P<0.01,与对照组比较;b:P<0.05,与4 μmol/L三氧化二砷组比较;c:P<0.05,与LY294002组比较。

表2 三氧化二砷及LY294002对MDA-MB-468细胞周期的影响,%)
a:P<0.05,与对照组比较,aa:P<0.01;b:P<0.05,与4 μmol/L三氧化二砷组比较;c:P<0.05,与LY294002组比较。
1.2MTT法将处于对数生长期的MDA-MB-468细胞消化,调整细胞浓度接种于37 ℃5% CO2培养箱中培养24 h。加入含5% 胎牛血清的DMEM、三氧化二砷(终浓度2,4,8 μmol/L)及LY294002(25 μmol/L),继续培养24、48、72 h,加入MTT(5 mg/mL)20 μL,4 h后弃上清液,在每孔加入DMSO 150 μL,10 min后,酶标仪570 nm处测定光密度(OD)值。并计算细胞增殖抑制率。
1.3细胞周期检测将处于对数生长期的MDA-MB-468细胞消化,浓度调整为8×103/mL,接种于37 ℃ 5% CO2培养箱中培养24 h。加入含5% 胎牛血清的DMEM培养基、三氧化二砷(终浓度4 μmol/L)或与LY294002(25 μmol/L),继续培养48 h,收集细胞。按细胞周期检测试剂盒说明书进行检测。
1.4Western blot按1.3方法接种细胞,培养48 h后,收集细胞,裂解收获蛋白样品。BCA试剂盒检测蛋白浓度、上样,进行SDS凝胶电泳,转膜,封闭,加入一抗4 ℃孵育过夜。次日加二抗孵育后曝光。并用“Quantity one”软件对蛋白灰度值进行统计分析。
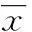
2结果
2.1三氧化二砷对MDA-MB-468细胞活力的影响如表1所示,随着作用浓度的增加,三氧化二砷对MDA-MB-468细胞活力抑制作用逐渐增强,在8 μmol/L时,抑制程度最大,差异有统计学意义(P<0.01);在同一浓度,随着作用时间增加,三氧化二砷对MDA-MB-468细胞活力抑制作用也逐渐增强,在72 h作用强度最大,但48 h与72 h作用程度较为一致;与对照组比较,随着作用时间增加,LY294002组及联合组对MDA-MB-468细胞活力抑制作用也逐渐增强,48 h与72 h作用程度较为一致,因此笔者选取48 h作为后续实验时间。同时发现与4 μmol/L 三氧化二砷组及LY294002组比较,联合组作用效果更强。
2.2三氧化二砷及LY294002对MDA-MB-468细胞周期的影响如表2所示,与对照组比较,LY294002组、4 μmol/L三氧化二砷组及联合组G1期的细胞明显增加,分别为(55.68±4.29)%、(69.51±4.32)%、(68.13±3.67)%、(73.45±6.04)%,差异具有统计学意义(P<0.01);与LY294002组及4 μmol/L三氧化二砷组比较,联合组G1期的细胞也明显增加,差异具有统计学意义(P<0.05)。
2.3三氧化二砷及LY294002对MDA-MB-468细胞中磷酸化AKT表达量的影响如图1所示,与对照组相比,4 μmol/L三氧化二砷组及LY294002组中磷酸化AKT水平下降,差异具有统计学意义(P<0.05);与三氧化二砷组及LY294002组比较,联合组中磷酸化AKT水平下降,差异具有统计学意义(P<0.05)。

aa:P<0.01,与对照组比较;b:P<0.05,与4 μmol/L三氧化二砷组比较;c:P<0.05,与LY294002组比较。
图1三氧化二砷及LY294002对MDA-MB-468细胞中磷酸化AKT表达量的影响
2.4三氧化二砷及LY294002对MDA-MB-468细胞中Cyclin A1和Cyclin D1蛋白水平的影响如图2所示,与对照组相比,4 μmol/L三氧化二砷组及LY294002组中Cyclin A1和Cyclin D1表达量下降,差异具有统计学意义(P<0.01);与4 μmol/L三氧化二砷组及LY294002组比较,联合组中Cyclin A1和Cyclin D1表达量下降,差异均具有统计学意义(P<0.05)。

a:P<0.05,aa:P<0.01,与对照组比;bb:P<0.01,与4 μmol/L三氧化二砷组比较;c:P<0.05,与LY294002组比较。
图2三氧化二砷及LY294002对MDA-MB-468细胞中Cyclin A1和Cyclin D1蛋白含量的影响
2.5三氧化二砷及LY294002对MDA-MB-468细胞中Bax,Bcl-2蛋白含量的影响如图3所示,与对照组相比,4 μmol/L三氧化二砷组及LY294002组Bcl-2表达量下降,Bax表达量上升,差异具有统计学意义(P<0.01);与4 μmol/L三氧化二砷组及LY294002组比较,联合组中Bcl-2表达量下降,Bax表达量上升,差异具有统计学意义(P<0.05)。

aa:P<0.01,与对照组比;b:P<0.05,bb:P<0.01,与三氧化二砷组比较;c:P<0.05,cc:P<0.01,与LY294002组比较。
图3三氧化二砷及LY294002对MDA-MB-468细胞中Bax,Bcl-2蛋白含量的影响
3讨论
近年来研究表明,三氧化二砷除了能治疗血液系统疾病,对多种恶性实体瘤也有强大的抗癌作用。如Kasukabe等[5]的研究结果表明三氧化二砷能抑制乳腺癌细胞MCF-7及MDA-MB--231生长。Xia等[5]的研究结果表明三氧化二砷可通过下调Bcl-2表达来抑制乳腺癌细胞生长。Guilbert等[4]研究进一步表明三氧化二砷可抑制MDA-MB-468乳腺癌细胞移植瘤的生长,并与雷帕霉素联合使用下调磷酸化AKT水平有关。因此本研究在此基础上,通过MTT实验发现三氧化二砷可显著抑制MDA-MB-468细胞活力,其作用浓度范围及时间与文献报道较为一致[4-6]。
细胞凋亡障碍导致肿瘤的不可控制增殖,是恶性肿瘤发生发展的一个重要因素。所以,通过某种诱导肿瘤细胞凋亡,则有可能抑制恶性肿瘤的发生和发展。PI3K/AKT通路是细胞内重要的存活信号通路,它可以通过直接或间接调控细胞增殖、分化、凋亡。AKT一旦活化即移动到细胞质和细胞核并调节许多下游靶点,如Cyclin A1,Cyclin D1,Bax,Bcl-2等蛋白的表达,从而调节多种生物学功能[2]。在人乳腺癌组织中磷酸化AKT蛋白表达明显增高,且磷酸化AKT蛋白阳性表达与乳腺癌恶性程度呈正相关[7]。本实验结果也证实了此观点,MDA-MB-468细胞中AKT磷酸化程度显著。LY294002是广泛应用的一种PI3K小分子特异性抑制剂,能大部分抑制PI3K的活性,降低AKT的活化,从而抑制下游事件的发生,导致细胞的增殖减少,并促进其凋亡。LY294002对乳腺癌细胞MDA-MB-468具有生长抑制、凋亡诱导的效应,是通过抑制PI3K和AKT活性实现的[8]。三氧化二砷可通过PI3K/AKT信号通路抑制人胃癌细胞SGC-7901[9]及人肾癌细胞786-O[10]增殖。本实验结果也证实三氧化二砷及LY294002都可降低AKT磷酸化水平,且联合给药优于单独给药。Szegezdi等[11]研究发现在三氧化二砷作用于细胞时,抑制PI3K可以增强三氧化二砷诱导的凋亡,从而进一步说明三氧化二砷与LY294002具有协同作用。
细胞癌变与细胞周期密切相关。多种抗肿瘤药物对细胞周期有特异的阻断作用,导致肿瘤细胞停滞在G1/M期而发挥治疗作用。其中Cyclin D1是与细胞周期G1期紧密相关的细胞周期蛋白,Cyclin D1过表达可缩短细胞周期G1期,促进细胞进入S期,导致细胞过度增殖而发生肿瘤。已报道MDA-MB-468细胞通过PI3K/AKT途径上调Cyclin D1表达,Cyclin D1使细胞由G1期进入S期,促进细胞增殖[12]。Roszak等[13]研究表明三氧化二砷通过抑制磷酸化AKT水平而下调Jurkat白血病T细胞系中Cyclin D1表达。Wang等[14]的研究显示三氧化二砷使MCF-7细胞阻滞在G1期而发挥其凋亡诱导作用。本实验也证实了三氧化二砷可通过抑制AKT磷酸化,下调Cyclin D1,并使细胞阻滞在G1期。Cyclin A是细胞进入S期的关键细胞周期蛋白,其被抑制表达后,会使进入S期的细胞数目明显减少。Yedjou等[15]研究显示三氧化二砷可抑制人白血病细胞HL-60增殖与下调Cyclin A1表达有关。本实验也证实了三氧化二砷可下调Cyclin A1表达。
分子生物学的手段发现越来越多的癌基因,抑癌基因多与多种肿瘤发生发展密切相关,Bax、Bcl-2是目前公认的参与细胞凋亡调控作用的主要基因。Bcl-2是第一个在淋巴细胞中被发现的能阻断细胞死亡的蛋白。Bax是促凋亡蛋白。研究发现三阴性乳腺癌组织中高表达Bcl-2蛋白[16]。Bax在包括乳腺癌组织等多种肿瘤中表达下降[17]。本研究也证实MDA-MB-468细胞低表达Bax,高表达Bcl-2。三氧化二砷可通过调节Bax及Bcl-2的表达来诱导诱导骨髓增生异常综合征(MDS)SKM-1细胞的凋亡[18]。因此本实验通过三氧化二砷及LY294002作用MDA-MB-468细胞后,发现可显著下调Bcl-2表达,上调Bax的表达,从而诱导MDA-MB-468细胞凋亡,且联合给药优于单独给药。
综上所述,三氧化二砷与LY294002可通过阻断PI3K/AKT信号通路,下调Cyclin A1,Cyclin D1,Bcl-2表达,上调Bax表达,从而诱导MDA-MB-468细胞凋亡,且二者具有协同作用。
参考文献
[1]Tomao F,Papa A,Zaccarelli E,et al.Triple-negative breast cancer:new perspectives for targeted therapies[J].Onco Targets Ther,2015(8):177-193.
[2]Bao GQ,Shen BY,Pan CP,et al.Andrographolide causes apoptosis via inactivation of STAT3 and Akt and potentiates antitumor activity of gemcitabine in pancreatic cancer[J].Toxicol Lett,2013,222(1):23-35.
[3]刘欢,那仁满都拉.三氧化二砷治疗癌症机制研究进展[J].中国现代应用药学,2013,30(3):338-342.
[4]Guilbert C,Annis MG,Dong Z,et al.Arsenic trioxide overcomes rapamycin-induced feedback activation of AKT and ERK signaling to enhance the anti-tumor effects in breast cancer[J].PLoS One,2013,8(12):e85995.
[5]Xia J,Li Y,Yang Q,et al.Arsenic trioxide inhibits cell growth and induces apoptosis through inactivation of notch signaling pathway in breast cancer[J].Int J Mol Sci,2012,13(8):9627-9641.
[6]Kasukabe T,Okabe-Kado J,Kato N,et al.Cotylenin a and Arsenic trioxide cooperatively suppress cell proliferation and cell invasion activity in human breast cancer cells[J].Int J Oncol,2015,46(2):841-848.
[7]张刚,李中,林晓萌,等.乳腺癌组织中 PTEN、p-AKT 蛋白表达变化及相关性分析[J].山东医药,2014,54(19):48-49.
[8]Badinloo M,Esmaeili-Mahani S.Phosphatidylinositol 3-kinases inhibitor LY294002 potentiates the cytotoxic effects of doxorubicin,vincristine,and etoposide in a panel of cancer cell lines[J].Fundam Clin Pharmacol,2014,28(4):414-422.
[9]Gao YH,Zhang HP,Yang SM,et al.Inactivation of Akt by Arsenic trioxide induces cell death via mitochondrial-mediated apoptotic signaling in SGC-7901 human gastric cancer cells[J].Oncol Rep,2014,31(4):1645-1652.
[10]朱峰,张艳,何岩,等.三氧化二砷对人肾癌细胞786-O增殖及其PI3K-Akt转导途径的影响[J].重庆医学,2013,42(26):3145-3148.
[11]Szegezdi E,Cahill S,Meyer M,et al.TRAIL sensitisation by Arsenic trioxide is caspase-8 dependent and involves modulation of death receptor components and Akt[J].Br J Cancer,2006,94(3):398-406.
[12]Rajput S,Kumar BN,Dey KK,et al.Molecular targeting of Akt by thymoquinone promotes G(1) arrest through translation inhibition of cyclin D1 and induces apoptosis in breast cancer cells[J].Life Sci,2013,93(21):783-790.
[13]Roszak J,Smok-Pieninzek A,Nocuń M,et al.Characterization of Arsenic trioxide resistant clones derived from Jurkat leukemia T cell line:focus on PI3K/Akt signaling pathway[J].Chem Biol Interact,2013,205(3):198-211.
[14]Wang X,Gao P,Long M,et al.Essential role of cell cycle regulatory genes p21 and p27 expression in inhibition of breast cancer cells by Arsenic trioxide[J].Med Oncol,2011,28(4):1225-1254.
[15]Yedjou CG,Tchounwou PB.Modulation of p53,c-fos,RARE,cyclin A,and cyclin D1 expression in human leukemia (HL-60) cells exposed to Arsenic trioxide[J].Mol Cell Biochem,2009,331(1/2):207-214.
[16]王敏,李惠平,赵红梅,等.Bcl-2、cyclinA2和PI3K在激素受体阴性乳腺癌中的表达及意义[J].中国微创外科杂志,2013,13(8):713-716,723.
[17]杨桦,马洪波,王子兵,等.乳腺癌中14-3-3σ的表达及其与Bcl-2和Bax的相关性研究[J].中国肿瘤临床与康复,2012,19(3):224-227.
[18]华海应,高华强,孙爱宁,等.三氧化二砷诱导骨髓增生异常综合征SKM-1细胞凋亡机制的研究[J].重庆医学,2014,43(29):3897-3900.
doi:·经验交流·10.3969/j.issn.1671-8348.2016.08.030
作者简介:郭发爽(1982-),学士,主治医师,主要从事乳腺相关疾病的研究。
[中图分类号]R737.9
[文献标识码]B
[文章编号]1671-8348(2016)08-1091-04
(收稿日期:2015-09-16修回日期:2015-11-04)

