小鼠滑膜成纤维细胞的原代培养
赵进军,胡子有,欧阳晴晴,毋 静,陈玉姣,杨 敏△
(南方医科大学附属南方医院:1.风湿免疫科;2.实验中心,广州 510515)
小鼠滑膜成纤维细胞的原代培养
赵进军1,胡子有2,欧阳晴晴1,毋静1,陈玉姣1,杨敏1△
(南方医科大学附属南方医院:1.风湿免疫科;2.实验中心,广州 510515)
[摘要]目的利用C57BL/6小鼠探索出一种改良的小鼠滑膜成纤维细胞(SF)的原代培养方法,以方便类风湿关节炎(RA)关于滑膜炎的研究。方法收集小鼠髋关节周围滑膜,去除内含的“蛋黄样”物,将滑膜移入含0.5% Ⅳ型胶原酶的EP管中,剪碎;置入37 ℃摇箱中振荡消化60 min,然后在涡轮振荡仪上振荡1.5 min,常规培养。结果细胞培养1周左右。进行第一次传代;大约在培养10 d后滑膜巨噬细胞的数量达到最高峰,然后逐渐减少;在第3次传代(15~20 d)后,滑膜巨噬细胞基本消失。用Vimentin标记的细胞免疫荧光化学染色显示SF细胞纯度超过95%;用Vimentin和CD90.2标记的流式细胞术显示其纯度达到95%,用CD54标记其纯度大约为80%。结论利用C57BL/6小鼠探索出一种改良的小鼠SF的原代培养方法是一种简便易行的小鼠SF的原代培养方法。
[关键词]关节炎,类风湿;成纤维细胞;滑膜;细胞培养技术;小鼠,近交C57BL
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性侵蚀性关节炎为特征的全身性自身免疫性疾病。RA的病变特点为滑膜炎,以及由此造成的关节软骨和骨质破坏,最终导致关节畸形。如果不经过正规治疗,约45%的患者在10年内出现残废[1]。RA广泛分布于世界各地,其发病具有一定的种族差异,在不同人群中的患病率为0.18%~1.07%[2-3]。RA在各年龄中皆可发病,高峰年龄在30~50岁,一般女性发病多于男性[4]。
RA的发病机制复杂,至少有8种细胞类型参与,包括:肥大细胞[5]、成纤维细胞[6]、巨噬细胞[7]、T细胞、B细胞、树突状细胞[8]、软骨细胞和破骨细胞[9]等,这些细胞通过表面的受体、分泌的细胞因子、趋化因子、组织蛋白酶、基质金属蛋白酶等相互作用,形成一个复杂的网络。RA的主要病理改变为滑膜炎,表现为滑膜增生和炎性细胞浸润。血管翳形成是RA滑膜炎的重要病理特征,在RA软骨和骨破坏过程中发挥重要作用[10]。滑膜成纤维细胞(SF)和滑膜巨噬细胞是滑膜组织内两种主要细胞类型。在非病变组织内,SF的生理功能是给关节腔和临近软骨提供营养性的浆蛋白和润滑分子。SF也通过产生基质成分如胶原和透明质酸及一系列基质降解酶参与不断的基质重塑[11]。但在RA中,SF激活形成类风湿关节炎滑膜成纤维细胞(RASF),通过产生炎性细胞因子和基质降解分子破坏关节。
如何在体外快速获得大量的SF是RA基础研究中的一个难点,目前在大鼠、兔子等大型啮齿类动物中由于其滑膜组织相对较多,体外培养SF容易。但小鼠由于关节内滑膜体积小,难以获得大量纯化的细胞。目前小鼠SF的原代培养体系还没有完全建立[12],不易成功,细胞生存时间短,传代次数少,增加了对其进行实验研究的难度,制约了关节疾病研究的顺利进展。本实验摸索出一种改良的SF培养法,培养时间短,且细胞纯度较大。
1材料和方法
1.1动物、器材及试剂5~10周龄C57BL/6小鼠1只。显微外科手术剪刀和镊子、1.5 mL EP管、0.2 μm滤器、60 mm培养皿、3 mL一次性吸管、75 cm2培养瓶、细胞培养箱、无菌操作台、体视镜、离心机、涡轮机、恒温摇箱、流式细胞仪、光学显微镜。75%乙醇、青霉素/链霉素、Ⅳ型胶原酶、DMEM(高糖)培养基、胎牛血清、磷酸盐缓冲液(PBS)、吐温-20、Triton X-100;大鼠抗小鼠CD106单克隆抗体(BD Biosciences Cat.#553330),大鼠IgG2aκ同型对照抗体(BD Biosciences Cat.#553927),FITC荧光标记山羊抗大鼠二抗(BD Biosciences Cat.#554016),PE荧光标记仓鼠抗小鼠CD54抗体(BD Biosciences Cat.#553253),PE荧光标记仓鼠IgG1κ同型对照抗体(BD Biosciences Cat.#553972),生物素标记大鼠抗小鼠CD90.2抗体(BD Biosciences Cat.#553011),生物素标记大鼠IgG2b κ同型对照抗体(BD Biosciences Cat.#553987),PE荧光标记Streptavidin链霉亲和素(BD Biosciences Cat.#554061),兔抗小鼠波形蛋白抗体(Cell Signaling Cat.#9854)。
1.2试剂的配制含血清DMEM(高糖)培养基:加入青霉素、链霉素和15%胎牛血清。1% Ⅳ型胶原酶:100 mg Ⅳ型胶原酶用10 mL TBS配置,0.22 μm滤器过滤除菌后分装成1 mL,-20 ℃保存。PBST:100 μL的Tween-20用100 mL PBS 稀释,室温保存,2个月内使用完毕。
1.3滑膜组织的获取小鼠断颈处死,置于75%乙醇中消毒2 min,剪开双后肢皮肤,用显微外科手术剪刀和镊子在髋关节的周围剪下滑膜组织(为白色海绵状,图1A所示),需注意将其中“蛋黄样”黄色椭圆物去除(图1B中小图所示)。转移入含2 mL DMEM培养基的60 mm平皿中。在该实验中,主要是采用髋关节周围的滑膜组织,但如欲获得更多的滑膜组织,也可进行以下操作:取下双后肢(不含足踝,应保留所有的肌肉组织),置于含2 mL DMEM培养基的60 mm平皿中。在体视镜下,用显微外科手术剪刀和镊子剪开小鼠腘窝内肌肉,剪下滑膜组织(图1C中箭头2所示),也需注意将其中“蛋黄样”黄色椭圆物去除(图1B所示),转移入另一个含2 mL DMEM培养基的60 mm平皿中。为获取关节内滑膜组织,可在体视镜下沿髌骨两侧打开膝关节腔(图1C中箭头3所示),翻转暴露关节腔,小心剥离关节内滑膜组织(图1D所示)。
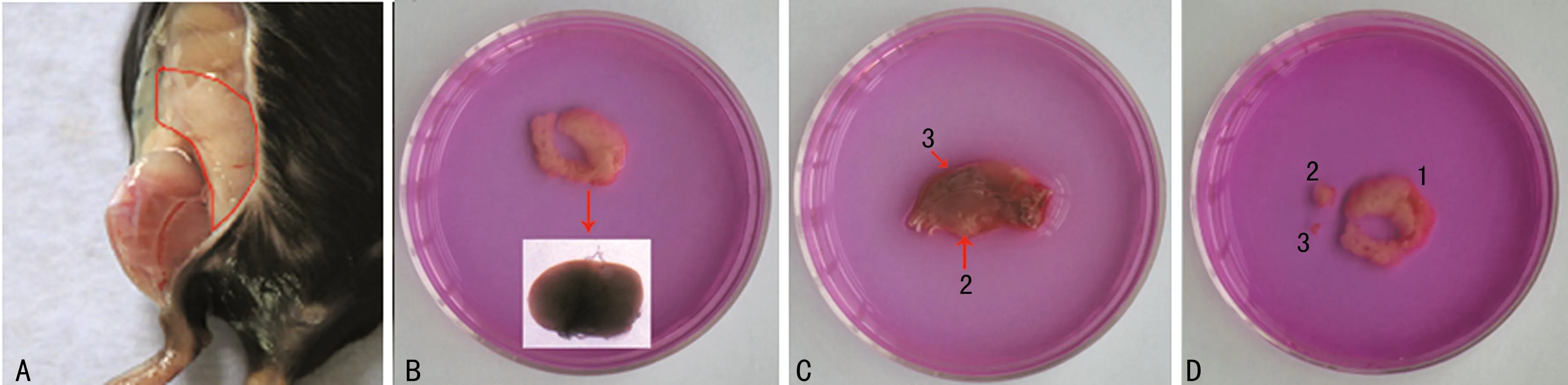
A:髋关节周围滑膜组织,在体视镜下滑膜组织显示为白色泡沫状,但在大体解剖时,由于与腹膜相临近,呈现出浅红色;B:分离下来的髋关节周围滑膜组织,在图中转弯部位隐藏着一个类似“蛋黄样”的圆形物,如小图所示,由于体视镜下拍照导致颜色失真,实际应为黄色;C:为分离下来的后肢,数字2标识的滑膜组织隐藏在腘窝深处,需剪开肌肉才可暴露,该处获得的滑膜组织中也存在类似髋关节周围滑膜组织中隐含的“蛋黄样”物;数字3标识的为膝关节内滑膜组织,需沿髌骨两侧打开膝关节腔后暴露;D:为分离下来的滑膜组织,数字1标识的为髋关节周围滑膜组织,数字2标识的为腘窝内滑膜组织,数字3标识的为膝关节内滑膜组织。
图1不同部位的滑膜组织
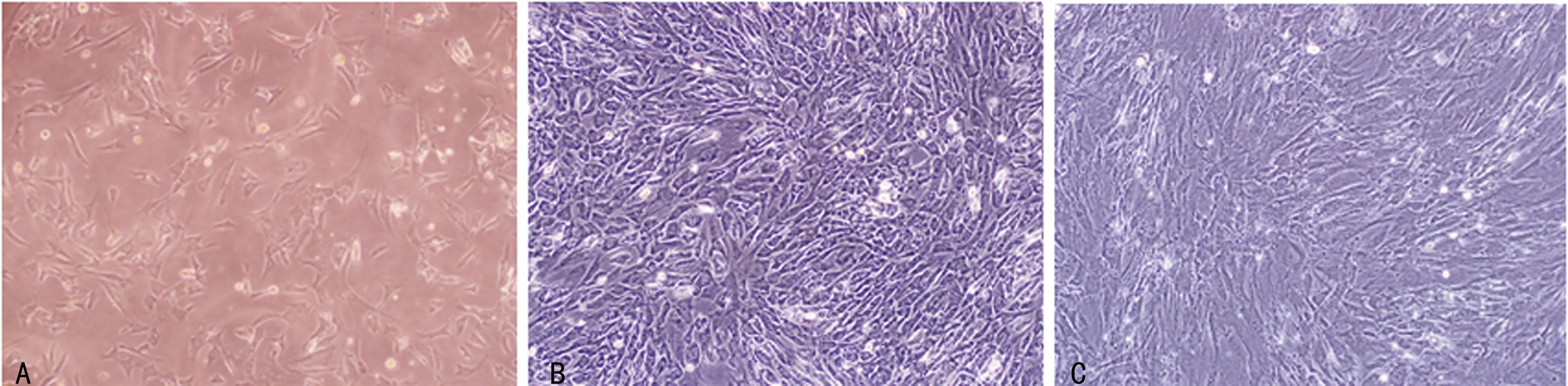
A:原代培养3 d(×10),SF贴壁生长良好,也可见到部分滑膜巨噬细胞;B:第1代,培养9 d(×10),由于SF生长密集,滑膜巨噬细胞的数量不多;但如此时进行消化传代,即可发现有较多的滑膜巨噬细胞贴壁生长;C:第2代,培养16 d(×10),滑膜巨噬细胞的数量明显减少,而SF的纯度明显提高。
图2不同时间点的SF生长状况
1.4滑膜组织的消化及SF的培养将修剪后的滑膜组织转移至含0.5 mL DMEM和0.5 mL Ⅳ型胶原酶的EP管中,剪碎成1 mm3的碎块。将EP管平放置于37 ℃摇箱中(200次/min),振荡消化60 min;消化后,置于涡轮机上高速振荡1.5 min以保证细胞分离;300×g离心5 min,吸弃上清,在超净台上加入含血清的DMEM培养基常规培养,选用75 cm2培养瓶。
1.5SF的免疫荧光细胞化学染色用Vimentin对第3次传代后的SF进行细胞免疫荧光化学染色。传代细胞消化后按1×105/mL加入12孔板培养24 h,吸去培养基,PBS轻轻漂洗2次,4%多聚甲醛固定10 min;用0.2% Triton X-100处理5 min,PBST冲洗3 min×3次;每孔加200~300 μL山羊血清封闭液,室温下孵育20~30 min;直接加入1 μL带荧光标记的一抗,4 ℃避光过夜;吸去一抗,PBST冲洗3 min×3次;加上200 μL PBS,荧光显微镜下绿光激发。
1.6SF的流式细胞仪分析用Vimentin、CD90.2、CD54和CD106 4种细胞表面标志物对SF的纯度进行分析,遵照各种抗体的说明书进行。
2结果
滑膜成纤维细胞在第2天即可见贴壁,3 d后可进行第1次换液(图2A),以后每3~4天换液1次,约在1周时即可进行第1次传代。10 d时滑膜巨噬细胞数量最多(图2B),此后随传代次数增多而减少,至第3次传代(第15~20天)时滑膜巨噬细胞基本消失(图2C)。
用细胞免疫荧光化学染色方法除可以确定细胞的性质外,也可初步判断出细胞纯度。如图3B中所示,用Vimentin可以很好地进行SF的免疫荧光细胞化学染色,显示其细胞纯度大于95%,也证实本方法简便可行,能够获得大量的SF。流式细胞分析的结果显示,Vimentin和CD90.2标识的细胞纯度超过95%,而CD54标识的细胞纯度约为80%,但CD106标识的细胞纯度仅为23%,见图4。

A:第3代,培养20 d(×10)。图上显示培养第3代时细胞生长不如图2C所示的第2代培养,实际上为进行Vimentin细胞免疫荧光化学染色;B:在荧光显微镜下Vimentin免疫荧光细胞化学染色(×10)显示SF生长良好。
图3细胞免疫荧光化学染色检测SF细胞纯度
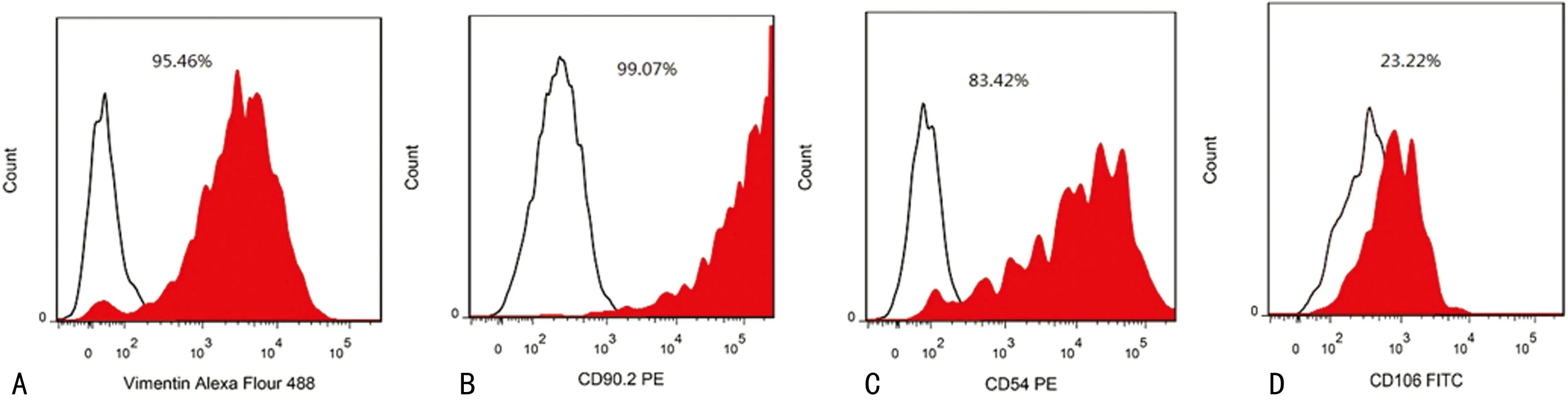
A:Vimentin标示的细胞纯度约为95%;B:CD90.2 标示细胞纯度约99%;C:CD54标示细胞纯度约为83%;C:CD106标示细胞纯度约为23%。
图4流式细胞术检测SF细胞纯度
3讨论
既往小鼠滑膜细胞培养法有组织块培养法、胰酶和胶原酶消化法等,但这些方法均存在明显的缺点。组织块贴壁法相对简单易行,但由于组织块小,不易均匀分布,导致细胞数量差异较大,组织块周围容易见到大量细胞生长。另外还有包括组织块种植困难不易成活、原代生长周期长、细胞数量少等缺点[13]。胰酶法的缺点是不能有效消化分离纤维组织,使滑膜细胞不易游离,且过筛网时堵塞网孔,故细胞数量很少[14]。
小鼠SF的原代培养中作者初期按文献报道用Ⅱ型胶原酶联合胰酶消化法进行培养,但该方法效果差,获得的原代细胞数量少,纯度低,需培养15~20 d后才可以进行第1次传代。Ⅳ型胶原酶能有效地消化分离纤维组织及细胞间质,充分游离细胞,纤维组织被胶原酶消化成絮丝状纤维。使用一种酶,同时减少过滤程序,简化了实验操作的过程,减少了细胞的丢失[12]。本研究使用Ⅳ型胶原酶的浓度从最初的0.1%逐渐提高,发现0.5%的效果最好。也可能更高的浓度可获得更好的效果,因0.5%的Ⅳ型胶原酶浓度已可以获得较好效果,因此没有再进一步加大浓度进行观察。Ⅳ型胶原酶消化后,在涡轮机上振荡也非常重要,该步骤主要目的是使SF分散开,振荡时间少于1.0 min效果差,而振荡1.5 min与3.0 min效果相似,因此推荐使用1.5 min。
本研究曾用关节间滑膜组织进行培养,但获得细胞纯度低。不仅因为关节间滑膜组织少,且关节间有软骨存在,易造成软骨细胞的混杂,两种细胞混杂后,目前并没有太好的纯化方法,导致细胞纯度降低。与选取关节间滑膜组织相比,髋关节周围滑膜组织量多,尤其是髋关节处游离的滑膜组织最多,且在体视镜下易于修剪掉附带的结缔组织。用该方法在培养第3天即可见到大量的滑膜类成纤维细胞生长,在6~8 d后即可进行第一次传代,此时,可观察到的滑膜类巨噬细胞的数量也最多。由于滑膜类巨噬细胞粘贴牢固,用0.25%胰酶消化后不易脱落,因此,在传代的过程中即进行了纯化。基本上在3次传代后即可除去巨噬细胞和淋巴细胞。
参考文献
[1]Emery P,Breedveld FC,Dougados M,et al.Early referral recommendation for newly diagnosed rheumatoid arthritis:evidence based development of aclinical guide[J].Ann Rheum Dis,2002,61(4):290-297.
[2]Humphreys JH,Verstappen SM,Hyrich KL,et al.The incidence of rheumatoid arthritis in the UK:comparisons using the 2010 ACR/EULAR classification criteria and the 1987 ACR classification criteria.Results from the Norfolk ArthritisRegister[J].Ann Rheum Dis,2013,72(8):1315-1320.
[3]Otsa K,Tammaru M,Vorobjov S,et al.The prevalence of rheumatoid arthritis in Estonia:an estimate based on rheumatology patients′ database[J].Rheumatol Int,2013,33(4):955-958.[4]Helmick CG,Felson DT,Lawrence RC,et al.National Arthritis Data Workgroup.Estimates of the prevalence of arthritis and other rheumatic conditions in the United States.Part I[J].Arthritis Rheum,2008,58(1):15-25.
[5]Kritas SK,Saggini A,Varvara G,et al.Mast cell involvement in rheumatoid arthritis[J].J Biol Regul Homeost Agents,2013,27(3):655-660.
[6]Sekine C,Nanki T,Yagita H.Macrophage-derived delta-like protein 1 enhances interleukin-6 and matrix metalloproteinase 3 production by fibroblast-like synoviocytes in mice with collagen-induced arthritis[J].Arthritis Rheumatol,2014,66(10):2751-2761.
[7]Donlin LT,Jayatilleke A,Giannopoulou EG,et al.Modulation of TNF-induced macrophage polarization by synovial fibroblasts[J].J Immunol,2014,193(5):2373-2383.
[8]E XQ,Meng HX,Cao Y,et al.Distribution of regulatory T cells and interaction with dendritic cells in the synovium ofrheumatoid arthritis[J].Scand J Rheumatol,2012,41(6):413-420.
[9]Kikuta J,Ishii M.Osteoclast migration,differentiation and function:novel therapeutic targets for rheumatic diseases[J].Rheumatology,2013,52(2):226-234.
[10]McInnes IB,Schett G.Cytokines in the pathogenesis of rheumatoid arthritis[J].Nat Rev Immunol,2007,7(6):429-442.
[11]Karouzakis E,Gay RE,Gay S,et al.Epigenetic control in rheumatoid arthritis synovial fibroblasts[J].Nat Rev Rheumatol,2009,5(5):266-272.
[12]Armaka M,Kontoyiannis D,Gkretsi V,et al.A standardized protocol for the isolation and culture of normal and arthritogenic murine synovial fibroblasts[J].Protocol Exchange,2009,9:102.
[13]Nikitopoulou I,Oikonomou N,Karouzakis E,et al.Autotaxin expression from synovial fibroblasts is essential for the pathogenesis of modeled arthritis[J].J Exp Med,2012,209(5):925-933.
[14]Zimmermann T,Kunisch E,Pfeiffer R,et al.Isolation and characterization of rheumatoid arthritis synovial fibroblasts from primary culture--primary culture cells markedly differ from fourth-passage cells[J].Arthritis Res,2001,3(1):72-76.
Primary culture for synovial fibroblasts in mice*
ZhaoJinjun1,HuZiyou2,OuyangQingqing1,WuJing1,ChenYujiao1,YangMin1△
(1.DepartmentofRheumatology;2.ExperimentalCenter,SouthernHospitalAffiliatedtoSouthernMedicalUniversity,Guangzhou,Guangdong510515,China)
[Abstract]ObjectiveThe primary culture of synovial fibroblasts is a convenient tool to study the pathology and physiology of synovial tissues.An improved method was constructed in this study by C57BL/6 mice to study the mechanism of rheumatoid arthritis(RA).MethodsThe synovium around the hip joints were collected.Attention should be paid to eliminate the "egg-yolk" like yellow oval substance in the middle of the synovium.The synovium was transferred into a 1.5 mL Eppendorf tube containing 0.5% type Ⅳ collagenase and cut into 1 mm3 blocks or so.The Eppendorf tube was placed in 37 ℃ Constant temperature orbital shaker incubator for 60 min.After digestion,the tube was placed on the Vortex for a high-speed oscillation for 1.5 minutes to guarantee the separation of cells.ResultsWithin about 1 week,the first passage was performed by the trypsin digestion method.On day 10,the number of synovial macrophages reached the maximum and then decreased gradually.After the third generation (day 15 to 20),the synovial macrophages generally disappeared.Vimentin was suitable for the immunofluorescence cytochemical staining for the synovial fibroblasts.The cell purity was indicated as >95%.The cytometric analysis indicated that purity of Vimentin and CD90.2-labelled cells was over 95%;the purity of CD54-labelled cells was 80% approximately.ConclusionIt is a simple and effective method for primary culture of synovial fibroblasts in mice.
[Key words]arthritis,rheumatoid;fibroblasts;synovial membrane;cell culture techniques;mice,inbred C57BL
doi:·技术与方法·10.3969/j.issn.1671-8348.2016.02.026
基金项目:国家自然科学基金资助项目(30972747;81172875)。
作者简介:赵进军(1978-),主治医师,博士,主要从事风湿免疫研究。 △通讯作者,E-mail:minyanggz@yahoo.com。
[中图分类号]R684.3
[文献标识码]A
[文章编号]1671-8348(2016)02-0228-04
(收稿日期:2015-09-18修回日期:2015-10-03)

