阿奇霉素对气管导管内流感嗜血杆菌生物被膜的影响
王 瑛,王 东,郭 治,石书梅△
(1.中国人民解放军济南军区总医院呼吸科,济南 250033;2.中国人民解放军空军总医院呼吸科,北京 100083)
论著·基础研究
阿奇霉素对气管导管内流感嗜血杆菌生物被膜的影响
王瑛1,王东2,郭治1,石书梅1△
(1.中国人民解放军济南军区总医院呼吸科,济南 250033;2.中国人民解放军空军总医院呼吸科,北京 100083)
[摘要]目的观察流感嗜血杆菌是否可在气管导管内形成生物被膜并评价阿奇霉素对气管导管内流感嗜血杆菌形成生物被膜的影响。方法选取Wistar大鼠120只,分为空白对照组、感染组及给药组;流感嗜血杆菌制备成琼脂小珠,接种于气管插管大鼠,扫描电镜观察气管导管生物被膜形成情况,并通过细菌计数评价疗效。结果接种细菌后第1天扫描电镜可见导管壁表面凹凸不平,外被黏液样物质,并可见细长的菌体被覆其中,给予阿奇霉素治疗后,感染组和给药组均可在气管插管形成生物被膜,但给药组细菌数明显降低。结论流感嗜血杆菌可在气管插管形成生物被膜,阿奇霉素对流感嗜血杆菌气道内导管早期生物被膜有一定抑制作用。
[关键词]插管法,气管内;生物被膜;阿奇霉素
机械通气作为呼吸支持技术在治疗呼吸衰竭中被广泛应用,并取得明显效果。通过对气管插管机械通气患者的调查发现,根据基础疾病的不同发生呼吸机相关肺炎(ventilator associated pneumonia,VAP)的概率为9%~27%,在重症监护病房内几乎90%的医院获得性肺炎都发生于机械通气,同时VAP也是导致死亡的主要原因[1]。生物被膜(biofilm)是指微生物(如细菌)被包裹在其自身分泌的多聚物中形成的一种特殊细胞群体结构。生物被膜一旦形成,就对抗菌药物及机体免疫力有着天然的抵抗能力,用抗菌药物难以彻底清除导致感染的反复发作[2]。有研究证实气管导管生物被膜感染是导致VAP发生不可忽视的因素[3]。本实验通过对大鼠气管插管,流感嗜血杆菌气道滴入,建立气管插管生物被膜模型,观察气管内导管生物被膜的形成情况,并通过阿奇霉素灌胃治疗气管插管大鼠流感嗜血杆菌感染,观察阿奇霉素对气管导管流感嗜血杆菌生物被膜的影响。
1材料与方法
1.1材料雄性二级Wistar大鼠120只,鼠龄8周,体质量(180+20)g(济南军区总医院动物中心提供)。流感嗜血杆菌1709由济南军区总医院呼吸科临床分离菌株,并经系统鉴定。
1.2方法
1.2.1流感嗜血杆菌琼脂小珠制作[4]从新鲜脑心浸液琼脂平板挑取5个流感嗜血杆菌菌落,接种于10 mL肉汤培养基中,于37 ℃悬摇状态180 r/min下培养24 h,比浊仪调细菌水平至1×109/mL,细菌混悬液2 mL加热至50 ℃,与50 ℃溶化的4%W/V纯化琼脂等量混合,50 ℃水浴中彻底混匀。5 mL注射器(预热至50 ℃吸取混合物),通过23号针头将3 mL混悬液快速注入27 mL 4 ℃快速搅拌着的肉汤培养基中,形成由琼脂包裹细菌的流感嗜血杆菌琼脂珠悬液。取100 μL细菌悬浮液倍比稀释,接种于改良巧克力培养基,测得悬浮液包含细菌数为1×108/mL,取200 μL于皮试用1 mL注射器中备用。
1.2.2实验分组Wistar大鼠到动物室后在新环境中适应3 d,普通敞式大鼠笼,中颗粒饲料喂养,饮用蒸馏水,称体质量后分为3组,每组40只。每时间点处理大鼠4只。每只大鼠均气管内置入一长约1 cm(静脉留置针管)硅胶管。空白对照组,大鼠插管组;感染组,大鼠气管插管感染组;给药组,大鼠气管插管感染给药组。
1.2.3动物的处理空白对照组:大鼠以45 mg/kg 3%戊巴比妥腹腔麻醉后,仰卧位固定,颈部、胸部脱毛,作颈部正中切口,约2~3 cm,分离颈前肌,暴露并固定气管,在环甲软骨处剪一V型切口,以静脉留置针管(1 cm)替代气管导管行气管插管,并向大鼠气管内缓慢注入注入无菌琼脂小珠100 μL,完毕后将大鼠直立旋转10~20 s,使琼脂均匀分布于肺部。感染组:插管感染组将大鼠以45 m/kg 3%戊巴比妥腹腔麻醉后,仰卧位固定,颈部、胸部脱毛,消毒,铺无菌洞巾,作颈部正中切口,暴露并固定气管,在环甲软骨处剪一V型切口,以静脉留置针管(1 cm)替代气管导管行气管插管,并向大鼠气管内缓慢注入流感嗜血杆菌琼脂小珠100 μL,完毕后将大鼠直立旋转10~20 s,使菌液均匀分布于肺部。给药组:大鼠以45 m/kg 3%戊巴比妥腹腔麻醉后,以静脉留置针管(1 cm)替代气管导管行气管插管,并向大鼠气管内缓慢注入流感嗜血杆菌琼脂小珠100 μL,完毕后将大鼠直立旋转10~20 s,使菌液均匀分布于肺部。第1~3天,按52.5 mg/kg给予大鼠阿奇霉素溶液灌胃,连续3 d。
1.2.4标本采集(1)扫描电镜标本制作[4]。将大鼠以3%戊巴比妥腹腔麻醉后,常规消毒,行腹主动脉放血处死小鼠,在无菌条件下开胸完整取出肺脏,沿气管将留置导管推出气管,灭菌生理盐水冲洗3遍,将导管纵向剖开,剪成0.5 cm2小块,戊二醛固定,扫描电镜观察。(2)气管导管生物被膜的活菌计数[5]。将大鼠在无菌条件下开胸完整取出肺脏,沿气管将气管内导管推出,超声震荡15 min,使生物被膜完全脱落,漩涡震荡1 min,打匀菌落,再以灭菌生理盐水做10倍系列稀释,分别取各稀释度标本10 μL接种于血琼脂平板上,37 ℃过夜培养后,次日以最低可数的稀释倍数计算菌落数,然后换算每1 cm导管中有多少个细菌集落形成单位(CFU)。每1 cm导管CFU数=菌落数×稀释倍数。

2结果
2.1扫描电镜观察大鼠气管导管生物被膜生长情况接种细菌后第4天扫描电镜低倍可见感染组导管壁上有大片膜样物质黏附,高倍可见菌体聚集,外被黏液样物质,并可见细长的菌体被覆其中;给药组可见导管散点样分布小片样物质,高倍镜可见菌体聚集成团,密度稀疏。见图1。

A:给药组(×1 000);B:感染组(×1 000);C:给药组(×5 000);D:感染组(×5 000)。
图1扫描电镜观察大鼠气管导管生物被膜生长情况
2.2气管导管菌落计数整个实验过程空白对照组导管内未培养检出细菌。其他两组大鼠菌落计数见图1及表1,感染组菌落计数趋势可见细菌数在接种第1天后有上升趋势,但2周至1个月,细菌维持在1 000 CFU/cm2左右。给药组细菌计数可见给药后细菌数前第1周无明显变化,但与感染组相比数值上有所降低,特别是在第4天开始差异有统计学意义(P<0.05),至1周时,相差较大,到1个月细菌数有所上升,维持在1×103/mL左右,与感染组相近。
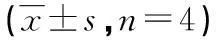
表1 阿奇霉素对气管导管内生物被膜
3讨论
VAP是机械通气过程中常见,同时又是导致病死率上升的重要原因之一,并在很大程度上增加了治疗难度和医疗费用[6]。有研究显示概械通气患者出现气管内导管生物被膜的概率要比其他患者高得多[7-8],因为机械通气患者病情危重,大剂量抗菌药物、激素的使用会导致机体系统免疫力下降,当气管切开或气管插管等人工气道建立时,上气道分泌物不仅易经气管导管进入下呼吸道导致VAP,而且易黏附在气管内导管,细菌一旦黏附在附着物上,在12 min内,就会上调产生胞外多糖和黏蛋白基因的高表达,使细菌牢牢黏附在导管上,形成生物被膜[9],当吸痰或气流动力学原因,生物被膜内的微菌落会脱落至下呼吸道,引起VAP。所以早期VAP致病菌中多以上气道定植菌为主,其中包括流感嗜血杆菌。而随着机械通气时间延长,反复侵入性操作如吸痰、呼吸机管路污染等增加了感染率,使VAP致病菌发生改变。阿奇霉素为大环内酯类抗菌药物,有研究显示可抑制导尿管铜绿假单胞菌生物被膜的形成[10]。本实验通过扫描电镜、菌落计数,观察对气管导管流感嗜血杆菌生物被膜的影响,结果显示,感染组、给药组在气管插管感染后第1天导管上均有生物被膜形成,细菌数均在100 CFU左右,感染组细菌数逐渐上升,但在2周至1个月其间维持在1×103/mL左右;给药组在1周时菌落数明显减低,在1个月时与感染组比无明显差异。在对机械通气患者气管导管内生物被膜形成情况的研究表明机械通气后第2天导管内壁就可见点片状生物被膜形成[11],在感染组1周后细菌数持续在1×103~1×104/mL,分析1周时导管内生物被膜已进入成熟期,膜内细菌呈稳定状态,故菌落数差别不大。而给药组,菌落计数3 d至1周时有时下降,与阿奇霉素对流感嗜血杆菌生物被膜内活菌的抑制有关,2周后至1个月时细菌数与感染组相比较无明显差异,分析与1周后随阿奇霉素的代谢,在体内水平降低,对生物被膜内细菌的抑制作用减小,使生物被膜恢复乃至趋于成熟所致。给药组导管生物被膜内细菌数在2周内均比感染组低(P<0.05),提示阿奇霉素对生物被膜的作用在早期较为明显。
气管内导管生物被膜是导致VAP难治性和高病死率的原因之一,特别是对危重病等患有慢性基础性
疾病的患者,及时控制VAP对疾病的预后和转归有重要意义。本实验通过对大鼠气管插管,给予流感嗜血杆菌气道滴入,观察气管内导管生物被膜的形成情况,并通过阿奇霉素灌胃治疗气管插管流感嗜血杆菌感染大鼠,观察阿奇霉素对气管内导管生物被膜内流感嗜血杆菌的影响。提示流感嗜血杆菌可在气道导管内形成生物被膜,阿奇霉素对流感嗜血杆菌气道内导管早期生物被膜有一定抑制作用,为临床治疗VAP提供有力依据。
参考文献
[1]Brum G,Melo R,Monteiro F,et al.Ventilator-associated pneumonia (VAP)[J].Eur Respir J,2004,24:5475.
[2]Kuehn M,Hausner M,Bungartz HJ,et al.Automated confocal laser scanning microscopy and semiautomated miage processing for analysis of biofilms[J].Appl Environ Microbiol,64(11):4115-4127.
[3]Tarquinio KM,Kothurkar NK,Goswami DY.Bactericidal effects of silver plus titanium dioxide-coated endotracheal tubes on pseudomonas aeruginosa and staphylococcus aureus[J].Int J Nanomedicine,2010,5:177-183.
[4]蔡少华,张进川,钱桂生.气管导管生物被膜与复发性铜绿假单胞菌呼吸机相关肺炎的相关性[J].中华结核和呼吸杂志,2001,6(24):339-341.
[5]李影林.临床微生物学及检验[M].北京:人民卫生出版社,1995:673.
[6]Brilli RJ,Sparling KW,Lake MR.The business case for preventing ventilator-associated pneumonia in pediatric intensive care unit patients[J].Jt Comm J Qual Patient Saf,2008,34(11):629-638.
[7]Pneumatikos IA,Dragoumanis CK,Bouros DE.Ventilator-associated pneumonia or endotracheal tubeassociated pneumonia:an approach to the pathogenesis and preventive strategies emphasizing the importance of endotracheal tube[J].Anesthesiology,2009,110(3):673-680.
[8]De Souza PR,De Andrade D,Cabral DB,et al.Endotracheal tube biofilm and entilator-associated pneumonia with mechanical ventilation[J].Microsc Res Tech,2014,77(4):305-312.
[9]Vandecasteele SJ,Peetermans WE,Merckx R,et al.Expression of biofillm associalted genes in Straphylococcus epidermidis during in vitro and in vivo foreign bodyi nfections[J].Infect Dis,2003,188(5):730-737.
[10]Bala A,Kumar R,Harjai K.Inhibition of quorum sensing in Pseudomonas aeruginosa by azithromycin and its effectiveness in urinary tract infections[J].J Med Microbiol,2011,60(Pt3):300-306.
[11]阎锡新,李帅,齐天杰,等.机械通气患者气管导管内生物被膜生成及病原分析[J].中华结核和呼吸杂志,2008,7(31):501-504.
Effects of azithromycin on the formation of nontypeable haemophilus influenzae biofilm on endotracheal tubes
WangYing1,WangDong2,GuoZhi1,ShiShumei1△
(1.DepartmentofPneumology,GeneralHospitalofJinanMilitaryRegion,Jinan,Shandong250033,China;2.DepartmentofPneumology,GeneralHospitalofAirForce,Beijing100142,China)
[Abstract]ObjectiveTo observe the formation of biofilms on endotracheal tubes,and to determine the effect of azithromycin on Haemophilus influenzae in biofilms.MethodsOne hundred and twenty Wistar rats were intubated with a silicone tube,80 of them(40 rats were model group and 40 were medicine group) were infected by bacteria to establish the animal models of endotracheal tube infections the others were ues as control gruop.Formation of biofilms was detected by scanning electron microscope.Viable cells counting was carried out to evaluate the effect of azithromycin orally on biofilms on endotracheal tubes.ResultsUneven biofilms were formed on the surface of endotracheal tubes,and slim bodied of bacteria enclosed by a lot of extracellular matrix.Viable cells counting was reduced in medicine group compared with model group.ConclusionHaemophilus influenzae can form biofilms on endotracheal tubes.Azithromycin can exert inhibitory effect on haemophilus influenzae biofilms formed on endotracheal tubes.
[Key words]intubation,ilntratracheal;biofilms;azithromycin
作者简介:王瑛(1971-),博士,副主任医师,主要从事临床感染研究。△通讯作者,E-mail:shumei_shi131@163.com。
doi:10.3969/j.issn.1671-8348.2016.01.014
[中图分类号]R96
[文献标识码]A
[文章编号]1671-8348(2016)01-0040-02
(收稿日期:2015-06-10修回日期:2015-09-28)

