一株异养硝化菌的筛选及生长特性研究
郝明辉于鲁冀,李廷梅刘攀龙
(1. 郑州大学水利与环境学院,郑州 450001;2. 郑州大学环境政策规划与评估研究中心,郑州 450002)
一株异养硝化菌的筛选及生长特性研究
郝明辉1于鲁冀1,2李廷梅2刘攀龙2
(1. 郑州大学水利与环境学院,郑州 450001;2. 郑州大学环境政策规划与评估研究中心,郑州 450002)
从郑州市纳污河流贾鲁河中筛选出一株能高效去除氨氮的细菌,并对其生长特性进行研究。采用传统的微生物分离纯化的方法对所采集的样品进行筛选,用分子生物学的方法对菌株进行鉴定,并通过单因素实验对所选菌株的培养条件进行初步优化。结果显示,所筛选菌株为假黄单胞菌属(Pseudoxanthomonas sp.),命名为C2。该菌株能在有机物存在的条件下进行异养硝化作用,并快速繁殖,当接种量为10%时,培养4 h后即进入对数生长期。该菌株异养硝化的最佳接种量为3%,最适碳源为丁二酸钠,最适pH为 6-9,适宜的温度范围为25-30℃,摇床转速对氨氮的去除效果影响不大。菌株C2对氨氮的去除效果较好,对于河水中氨氮的去除具有一定的应用价值。
异养硝化;筛选;氨氮;去除率
氨氮的浓度过高是造成水体富营养化的主要原因之一,水体中氮的去除对于维持水体清洁及防止水体的富营养化意义重大[1,2]。贾鲁河流经河南省东南部,属于淮河二级支流,主要接纳多个地市的污水,可生化性能较差,氨氮含量一直较高[3]。生物脱氮技术是目前水处理领域研究的热点内容之一,而自20世纪80年代开始的异养硝化作用及其菌种的研究,是对传统硝化理论的丰富与发展[4,5]。与自养型硝化细菌相比,异养型硝化细菌的生长速率更快,细胞产量更高,需要的溶解氧浓度更低,耐酸性也更强[6,7]。目前报道较多的异养硝化菌主要有:副球菌属(Paracoccus sp.)[8]、产碱杆菌属(Alcaligenes)[9]、假单胞菌属(Pseudomonas)[10]、不动杆菌属(Acinetobacter)[11,12]、芽孢杆菌(Bacillus sp.)[13]等,并且部分异养硝化菌同时具有好氧反硝化的作用[14],因此筛选异养硝化菌对河流中氨氮的彻底去除具有重要意义。
本研究在贾鲁河郑州段沿程选取10个采样点采样,并从中分离、筛选出能在有机碳存在的条件下进行硝化作用的细菌,挑选出氨氮去除效果最好的一株,对其进行分子生物学鉴定,然后测定其生长曲线,并分析该菌株的氨氮去除特性,以及菌株去除氨氮时的影响因素,旨在为菌株的进一步应用提供理论支持。
1 材料与方法
1.1 材料
1.1.1 样品的采集及预处理 微生物样品取自郑州市纳污河流贾鲁河沿程的10个采样点,各采样点均采集水样、泥样一份,带回实验室后冷藏保存备用。水样在富集前要取约250 mL通过孔径为0.22 μm的滤膜过滤,水中细菌截留在滤膜上,然后将滤膜放在液体培养基中直接培养,如果水中的悬浮物含量较高,则沉淀后再取水样的上清液进行过滤。由于底泥中的微生物含量较多,无需经过富集处理,直接对底泥进行分离纯化。微生物在分离纯化前,称取湿重为5 g的底泥样品,加入到带玻璃珠且盛有50 mL无菌水的三角瓶中,震荡30 min,使底泥样品均匀分布于水中。
1.1.2 培养基 异养硝化培养基:(NH4)2SO40.5g,丁二酸钠5.1 g,维氏盐溶液50 mL,加水溶解,并补加蒸馏水至1 L,调节培养基pH为7.0-7.2,若培养基为固体需另加入2%的琼脂粉。维氏盐溶液:K2HPO45.0 g,MgSO4·7H2O 2.5 g,NaCl 2.5 g,FeSO4·7H2O 0.05 g,MnSO4·4H2O 0.05 g,溶解后加水定容至1 L。
1.2 方法
1.2.1 菌种的富集、分离和纯化 取10 mL处理后的样品加入盛有100 mL灭菌后的异养硝化培养基的250 mL锥形瓶中,在30℃、150 r/min的条件下振荡培养4 d左右,用萘氏试剂检测氨氮的转化情况,若用萘氏试剂显色较浅,即氨氮的含量变少,则移取1 mL培养液转接入新鲜的富集培养基中继续富集[15],重复操作2-3次。
经2-3次富集之后,筛选出去除氨氮效果较好的富集样,采用梯度稀释涂布琼脂平板和平板划线分离的方法,对富集后的菌液进行分离纯化:制备样品梯度稀释液(用梯度稀释法制备10-1、10-2、10-3、10-4、10-5和10-6的稀释液),分别取0.2 mL的10-2、10-4和10-6的稀释液涂布于相应的固体培养基上,倒置于30℃的恒温培养箱中培养至菌落出现[16]。挑取典型的菌落采用分区划线的方法进行纯化2-3次。
1.2.2 菌株的筛选 将纯化后的所有菌株分别接种于液体的异养硝化培养基中,30℃、150 r/min的条件下振荡培养3 d,培养期间每天用萘氏试剂检验各个培养基中氨氮的降解情况,同时做空白对照,选择氨氮去除效果最好的一株作为实验菌株。
1.2.3 菌株的鉴定 委托上海生工生物工程股份有限公司对16S rDNA的PCR扩增产物进行序列测定,应用BLAST软件将所得序列与Internet上GenBank中的有关序列进行同源性分析。
1.2.4 生长特性的研究 将所筛菌株培养至稳定期然后接种于已灭菌的异养硝化液体培养基中,于30℃、150 r/min 条件下恒温培养48 h后作为接种液使用。将准备好的接种液以10%的比例(体积比)转接入4个盛有100 mL灭菌培养基的锥形瓶中,以空白培养基为对照。在30℃、150 r/min 条件下恒温培养,并于开始后0、4、8、12、16、20、24、28和32 h 时取样,测定培养液体中菌体的细胞密度OD600的值,并取样在离心分离器中经3 000 r/min、10 min离心分离,然后取上清液测定NH4+-N、TN、NO3--N、NO2--N,分析其浓度变化。
1.2.5 培养条件的优化
1.2.5.1 接种量 将筛选出来的菌株按接种量0%、1%、3%、5%、7%和10%接种至 100 mL 新鲜培养基中,30℃、150 r/min 摇床培养,24 h后检测氨氮的浓度转化情况。初始pH值在此前实验的基础上,取100 mL培养基置于250 mL锥形瓶中,用1 mol/L HCl或1 mol/L NaOH调节培养基的pH值为5.0、6.0、7.0、8.0、9.0和10.0,24 h后检测氨氮的浓度转化情况。
1.2.5.2 碳源 在此前实验的基础上,分别改变碳源为葡萄糖、丁二酸钠、柠檬酸三钠(含碳量相等),24 h后检测氨氮的浓度转化情况。
1.2.5.3 温度 在此前实验的基础上,取100 mL培养基置于250 mL锥形瓶中,培养温度分别设置为15℃、20℃、25℃、30℃和35℃,24 h后检测氨氮的浓度转化情况。
1.2.5.4 摇床转速 在此前实验的基础上,取100 mL培养基置于250 mL锥形瓶中,摇床转速分别设置为100、150、200和250 r/min,恒温培养24 h后取样测定氨氮的去除情况。
1.2.6 分析方法 样品在经过3 000 r/min的离心机离心10 min后取上清液测定氮素含量。显色剂采用萘氏试剂、格里斯试剂和二苯胺;氨氮的测定采用纳氏试剂分光光度法(HJ535-2009);亚硝态氮的测定采用N-(1-萘基)-乙二胺分光光度法(GB/T7493-1987);硝态氮的测定采用酚二磺酸分光光度法(HJ/T346-2007);总氮的测定采用碱性过硫酸钾消解紫外分光光度法(GB11894-89);菌体数量采用分光光度计测定波长为600 nm时的吸光度值来表征;pH值的测定采用Delta320型数字精密pH计。
2 结果
2.1 菌株的筛选与鉴定
2.1.1 菌株的筛选 通过富集培养、分离和纯化,共获得16株能在异养硝化培养基上生长的不同菌落形态的菌株。将这16株菌株接种于异养硝化培养基,培养过程中,用萘氏试剂检测氨氮的去除效果,筛选出对萘氏试剂显色效果较好,即氨氮去除效果明显的菌株2株C1和C2。同时,分别用格里斯试剂和二苯胺对两株菌进行检测,发现这两株菌在培养过程中均具有亚硝态氮及硝态氮的少量积累,说明二者都具有异养硝化的特性。
分别用异养硝化培养基对C1和C2进行培养,以空白培养基作为对照,48 h后测定氨氮的浓度变化。结果显示菌株C2的氨氮去除率高于C1,为78.87%,因而选择C2作为后续实验的菌种。
2.1.2 菌种的鉴定 经过形态观察发现:C2菌落呈圆形,透明的黄色,表面光滑,产生荧光物质,为革兰氏阴性菌。将本实验筛选到的菌株C2,委托上海生工生物工程股份有限公司对C2的16S rDNA PCR扩增产物进行序列测定,初步鉴定C2属于假黄单胞菌属(Pseudoxanthomonas sp.)。
2.2 菌株的生长曲线及氨氮转化效率
菌株在异养硝化培养基中的生长曲线及氮素转化情况,如图1和图2所示。图1显示,菌株C2接种后经过短暂的调整后进入对数生长期,大约24 h左右菌体的生长量达到最大值,然后进入稳定期。
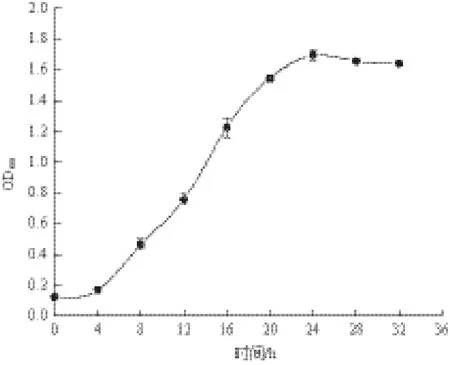
图1 菌株C2的生长曲线
图2显示,菌株C2对NH4+-N的快速降解发生在前24 h,由94.31 mg/L 快速下降至19.93 mg/L,去除率达78.87%。进入稳定期后,NH4+-N的去除效果随之下降,TN含量基本上在小范围内波动,NO-3-N、NO2--N都有积累。
2.3 培养条件的优化
2.3.1 接种量的影响 当pH为7.2、以丁二酸钠为唯一碳源、温度为30℃、摇床转速为200 r/min时,分析不同接种量时的NH4+-N去除情况。结果(图3)显示,菌株C2在接种量为3%时NH4+-N去除效率最高。当接种量小于3%时,NH4+-N的去除率随着接种量的增加而增大,但当接种量超过3%后,NH4+-N的去除率反倒有所降低。
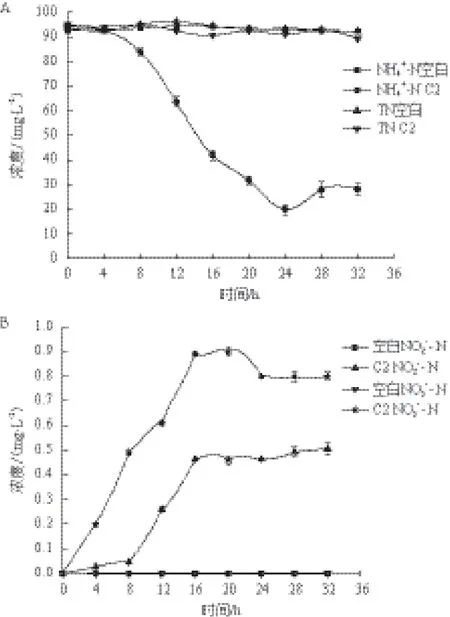
图2 NH4+-N、TN、NO2--N和NO3--N浓度随时间的变化
2.3.2 初始pH的影响 当接种量为3%、以丁二酸钠为唯一碳源、温度为30℃、摇床转速为200 r/min时,研究初始pH对菌株脱氮效果的影响。结果(图4)显示,菌株C2在pH<6或是pH>9时NH4+-N的去除率都迅速降低,只有在pH7-9时较高,并且在pH为9时NH4+-N的去除率达到最大值94.89%,pH升高到10时,微生物的活性受到抑制,脱氮效果下降。
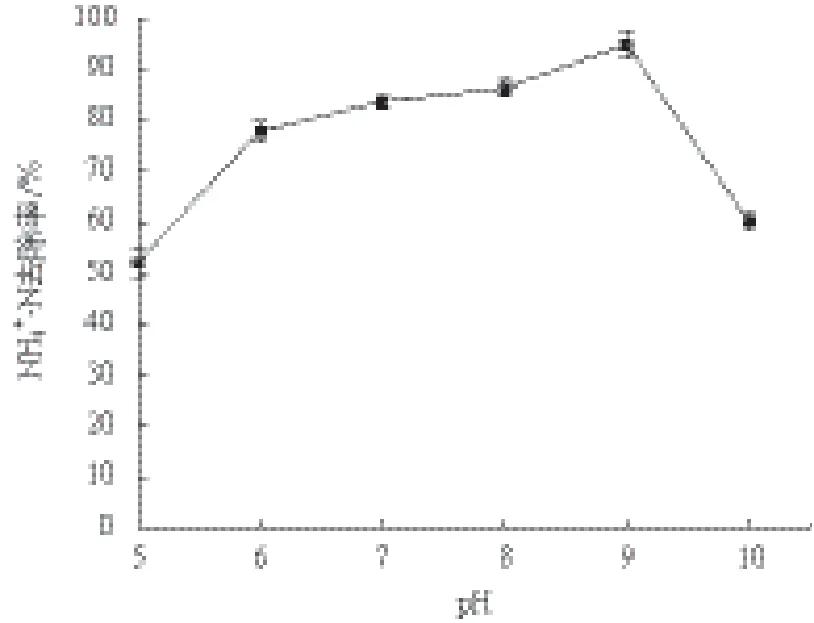
图4 初始pH对菌株C2氨氮去除效率的影响
pH对NH4+-N浓度的测定有一定的影响,为降低实验误差,本研究另选取一组培养前的NH4+-N含量数据进行分析,结果(表1)显示,各组的NH4+-N含量均随pH值的升高而呈现降低的趋势。
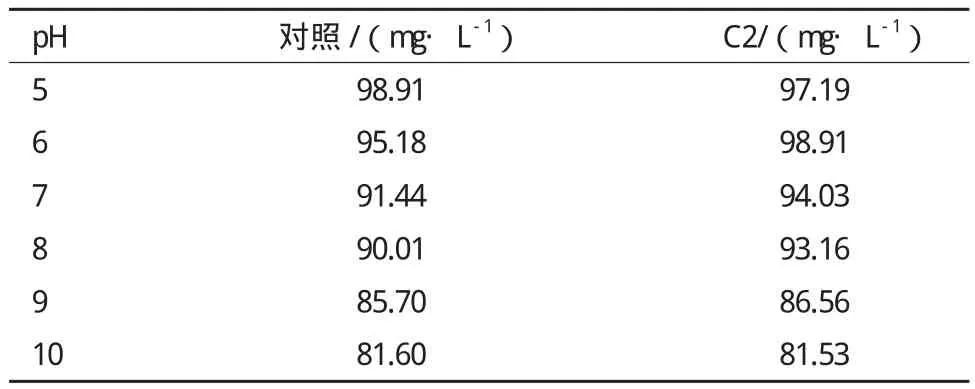
表1 培养前各pH条件下的氨氮含量
2.3.3 不同碳源的影响 当接种量为3%、初始pH为9.0、温度为30℃、摇床转速为200 r/min时,分别以葡萄糖、丁二酸钠、柠檬酸三钠为唯一碳源,分别以相应未接种的液体培养基作对照,培养24 h,分析各组NH4+-N的去除情况。结果(图5)显示,以葡萄糖为唯一碳源培养24 h后培养液基本清澈,菌株C2的脱氮效率只有22.88%,而分别以丁二酸钠和柠檬酸三钠为唯一碳源时的脱氮效果均比较好,其中以丁二酸钠为唯一碳源时的效果最好,达到84.47%。
2.3.4 温度的影响 当接种量为3%、初始pH为9.0、以丁二酸钠为唯一碳源、摇床转速为200 r/min时,分别在不同的温度条件下培养菌株,分析温度对NH4+-N去除效率的影响。结果(图6)显示,在温度为20℃-35℃之间时,菌株C2对NH4+-N的去除效果差别不大,在温度为15℃时为82.80%。
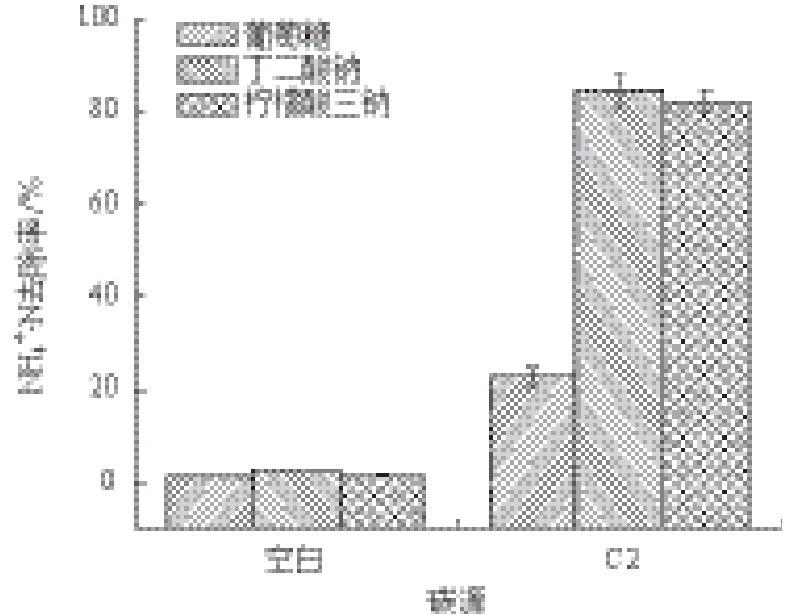
图5 碳源对菌株氨氮去除效率的影响
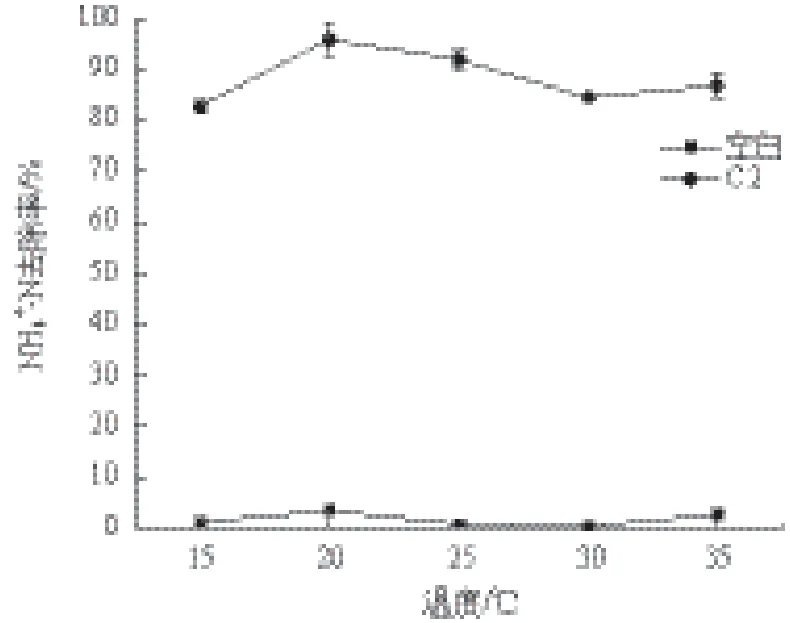
图6 温度对氨氮去除率的影响
2.3.5 摇床转速的影响 当接种量为3%、初始pH为9.0、以丁二酸钠为唯一碳源、温度为20℃时,分析摇床转速对NH4+-N去除率的影响。结果(图7)显示,摇床的震荡速度对菌株C2的NH4+-N去除效率影响不大,在150 r/min时NH4+-N去除率最高达97.80%,在低于或高于150 r/min时NH4+-N去除率稍有降低。
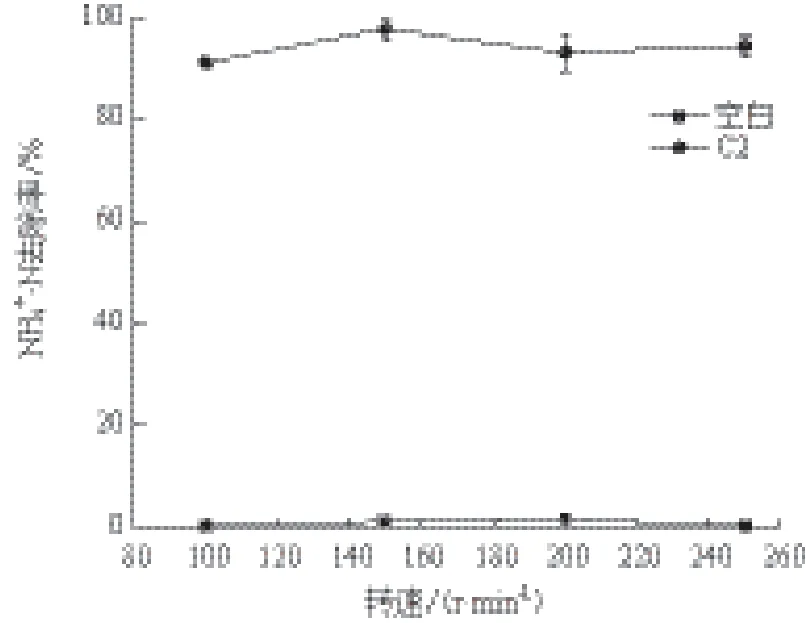
图7 摇床转速对C2去除氨氮效率的影响
3 讨论
3.1 菌株的筛选及性能检测
本研究所得到的菌株初步鉴定为假黄单胞菌属(Pseudoxanthomonas sp.),对氨氮具有较好的去除效果。并且该菌株经过短暂调整便进入对数生长期,体现了异养硝化菌相对于自养硝化菌具有较强的适应环境的能力,生长速度相对较快[17]。但在培养的过程中如果时间较长,由于菌株C2已经消耗掉了培养基中大量的营养物质,NH4+-N的去除效果也随之下降[18]。在实验的过程中NO3--N、NO2--N都有积累,说明在异养条件下菌株C2有硝化作用,但两者积累量都不大,所以该菌株是否同时具有反硝化作用有待进一步探讨。
3.2 培养条件的优化
微生物的培养是一个非常复杂的过程,其脱氮性能的好坏受到很多因素的影响,如接种量、所选碳源,温度、pH等。因而对菌株的培养条件进行优化十分必要。
培养基中细菌生物量的高低直接影响着氨氮转化效果的好坏[19]。接种量小,微生物群体对环境的抵抗能力弱,相应的适应期就长,从而影响到NH4
+-N的去除效率;接种量过大可提高氨氮转化率,在短时间内效果较好,但营养条件等受到限制,从而制约了细菌的继续生长,因而NH4+-N的去除率不再增大。
菌株的生长需要合适的pH,pH值可影响酶活性、菌体对营养物质的吸收及菌体细胞的结构,从而影响菌体的生长和反应活性[20];此外,pH对游离氨质量浓度有一定影响,废水中氨随pH不同分别以离子态和分子态形式存在,从而影响菌种的活性。本实验中菌株C2在中性及偏碱条件下的氨氮去除效果较好。
有机碳源不仅影响着异养硝化菌的生长,也影响着它的硝化活性[21],所以有机碳源的类型对异养硝化活性也起到至关重要的作用。能够被利用来维持异养硝化菌生长的碳源类型非常广泛,但能够被异养硝化菌利用来进行硝化反应的碳源类型却有所限制[22]。本实验中以丁二酸钠为最佳碳源。
温度主要影响微生物酶的活性,从而影响其生长和代谢。温度过高或过低都不利于菌株酶活性的发挥,从而导致生长停滞,氨氮去除能力下降。有研究资料显示:一般温度在低于15℃或高于40℃时才会对异养硝化菌产生显著影响[22],但由于本实验设置的温度范围较窄,因此菌株C2对于此温度范围外的脱氮效果还有待于进一步探讨。
摇床转速与培养基中的溶解氧浓度具有密切的关系,溶解氧对菌株的生长和代谢都有一定的影响。当振荡速度过高时,氨氮的去除率反而会下降,这可能是因为充足的溶解氧使细菌提前进入衰亡期菌体死亡自溶导致的[23]。
4 结论
本研究通过富集培养、分离纯化,从贾鲁河采集的样品中筛选出1株繁殖速率较快且具有氨氮去除能力的菌株C2,在24 h之内即可将氨氮浓度从94.13 mg/L降低到19.89 mg/L,去除率达78.87%;经分子生物学鉴定,初步确定该菌属于假黄单胞菌属(Pseudoxanthomonas sp.);对菌株C2的培养条件经行优化,当接种量为3%、以丁二酸钠为唯一碳源、pH为6-9、温度为20℃-35℃时脱氮效率较高,培养条件均最佳时,氨氮去除率可达97.80%,在本研究中转速对其脱氮效果影响不大。
[1]Xia S, Li J, Wang R. Nitrogen removal performance and microbial community structure dynamics response to carbon nitrogen ratio in a compact suspended carrier biofilm reactor[J]. Ecological Engineering, 2008, 32(3):256-262.
[2]Kim JK, Park KJ, Cho KS, et al. Aerobic nitrification-denitrification by heterotr-ophic Bacillus strains[J]. Bioresource Technology, 2005, 96(17):1897-1906.
[3]刘翠霞, 代巍, 邓素君, 等. 贾鲁河郑州段水环境污染现状及治理面临的挑战[J]. 河南科学, 2014, 32(2):270-272.
[4]潘丹, 黄巧云, 陈雯莉, 等. 两株异养硝化细菌的分离鉴定及其脱氮特性[J]. 微生物学报, 2011, 51(10):1382-1389.
[5]Shuo Yao, Jinren Ni, Tao Ma, et al. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2[J]. Bioresource Technology, 2013, 139(C):80-86.
[6]Islam A, Chen D, White RE. Heterotrophic and autotrophic nitrification in two acid pasture soils[J]. Soil Biology&Biochemistry, 2007, 39(4):972-975.
[7]Burton J, Chen C, Xu Z, et al. Gross nitrogen transformations in adjacent native and plantation forests of subtropical Australia[J]. Soil Biology and Biochemistry, 2007, 39(2):426-433.
[8]王洁, 蓝江林, 刘波. 一株异养硝化细菌的分离鉴定和脱氮特性研究[J]. 农业环境科学学报, 2013, 32(4):805-810.
[9]胡甜, 江林峰, 陈青云, 等. 高效异养硝化细菌的分离筛选及多样性分析[J]. 湖北农业科学, 2015, 54(5):1181-1185.
[10]连红民, 邱忠平, 何昆明, 周文秀. 一株好氧反硝化-异养硝化菌的筛选及脱氮特性研究[J]. 生物技术通报, 2015, 31(6):138-143.
[11]黄廷林, 张丽娜, 张海涵, 等. 一株贫营养异养硝化-好氧反硝化菌的筛选及脱氮特性[J]. 生态环境学报, 2015, 24(1):113-120.
[12]辛玉峰, 曲晓华, 袁梦冬, 等. 一株异养硝化-反硝化不动杆菌的分离鉴定及脱氮活性[J]. 微生物学报, 2011, 51(12):1646-1654.
[13]芮传芳, 吴涓, 李玉成, 等. 异养硝化细菌的筛选、鉴定及其氨氮转化特性的研究[J]. 生物学杂志, 2012, 29(1):37-41.
[14]苏婉昀, 高俊发, 赵红梅. 异养硝化-好氧反硝化菌的研究进展[J]. 工业水处理, 2013, 33(12):1-5.
[15]于鲁冀, 杨强, 李廷梅, 等. 纳污水体中好氧脱氮菌的筛选与氨氮去除特性[J]. 环境工程学报, 2013, 7(12):5032-5036.
[16]周群英, 王士芬. 环境工程微生物学[M]. 第3版. 北京:高等教育出版社, 2008:400-406.
[17]苟莎, 黄钧. 异养硝化细菌脱氮特性及研究进展[J]. 微生物学通报, 2009, 36(2):255-260.
[18]Hu TL, Kung KT. Study of heterotrophic nitrifying bacteria from wastewater treatment systems treating acrylonitrile, butadiene and styrene resin wastewater[J]. Water Science and Technology, 2000, 42(3-4):315-321.
[19]魏巍, 黄廷林, 苏俊峰, 等. 1株贫营养好氧反硝化菌的分离鉴定及其脱氮特性[J]. 生态环境学报, 2010, 19(9):2166-2171.
[20] 傅金祥, 张羽, 杨洪旭, 等. 短程硝化反硝化影响因素研究[J].工业水处理, 2010, 30(12):38-41.
[21]宋宇杰, 李屹, 刘玉香, 等. 碳源和氮源对异养硝化好氧反硝化菌株Y1脱氮性能的影响[J]. 环境科学学报, 2013, 33(9):2491-2497.
[22]张培玉, 曲洋, 于德爽, 等. 菌株qy37的异养硝化-好氧反硝化机制比较及氨氮加速降解特性研究[J]. 环境科学, 2010, 31(8):1819-1826.
[23]吴建江, 王兆阳, 许培雅, 等. 一株高效异养硝化菌的分离、鉴定及其氨氮去除特性[J]. 中国环境科学, 2013, 33(7):1309-1315.
(责任编辑 马鑫)
Screening and Growth Characteristics of a Heterotrophic Nitrification Bacterium
HAO Minghui1YU Lu-ji1,2LI Ting-mei2LIU Pan-long2
(1. College of Water Conservancy & Environmental,Zhengzhou University,Zhengzhou 450001;2. Research Center for Environment Policy Planing & Assessment of Zhengzhou University,Zhengzhou 450002)
The objective of this study is to isolate a strain of heterotrophic nitrification bacterium with high efficiency of removing ammonia-nitrogen from Jialu River of collecting wastewater at Zhengzhou City of Henan Province,and to study its growth characteristics. The collected samples were screened by the traditional methods of microorganism separation and purification,the strain was identified using molecular biology methods,and the culture conditions of the strain were optimized by single factor experiment. Based on 16S rDNA sequence analysis,it was identified as Pseudoxanthomonas sp.,designated as C2. The strain C2 had heterotrophic nitrification and grew rapidly while organic substances existed. C2 entered the logarithmic phase after 4 hours of culturing when the inoculation quantity was 10%. The optimal condition for heterotrophic nitrification was as follows:the inoculation quantity was 3%,the sodium succinate was taken as the only carbon source,the initial pH was 6-9,and the incubation temperature ranged from 25-30℃;the shaking speed had little effect on the activity of removing ammonia-nitrogen in this experiment. In conclusion,the removal rate of ammonia-nitrogen is relatively high,which demonstrates that it is promising to be applied in removing ammonia-nitrogen from practical water bodies.
heterotrophic nitrification;screening;ammonia-nitrogen;removal efficiency
10.13560/j.cnki.biotech.bull.1985.2016.04.022
2015-07-22
国家水体污染控制与治理重大专项(2012ZX07024-001-004)
郝明辉,女,硕士研究生,研究方向:水污染控制理论与技术;E-mail:hmh920706@126.com
于鲁冀,男,教授,研究方向:环境工程、环境微生物、环境规划、环境政策及环境经济相关研究;E-mail:yuluji@126.com

