盐芥TsGPX3基因的克隆、亚细胞定位与原核表达
王宁陈静,2高飞李华云隋欣周宜君
(1. 中央民族大学 生命与环境科学学院,北京 100081;2. 公安部物证鉴定中心,北京 100741)
盐芥TsGPX3基因的克隆、亚细胞定位与原核表达
王宁1陈静1,2高飞1李华云1隋欣1周宜君1
(1. 中央民族大学 生命与环境科学学院,北京 100081;2. 公安部物证鉴定中心,北京 100741)
以盐芥(Thellungiella salsuginea)为材料,获得TsGPX3的cDNA全长序列,其开放阅读框(ORF)序列长591 bp,编码196个氨基酸,具有GPXs家族的3个保守的特征结构域。系统进化分析显示,TsGPX3与同属于十字花科的萝卜RsGPX3、油菜BnGPX3和花椰菜BoGPX3等具有较高的同源性。构建植物表达载体pRTL2-TsGPX3-GFP,利用PEG转化拟南芥原生质体细胞进行瞬时表达,发现TsGPX3蛋白主要定位在细胞膜上。构建原核表达载体pET-TsGPX3,采用不同浓度IPTG对转入E.coli BL21(DE3)的pET-TsGPX3进行诱导表达,获得了分子量约为27 kD的蛋白,该蛋白在37℃、诱导培养5 h时可获得较高的表达量。
TsGPX3;盐芥;亚细胞定位;原核表达
谷胱甘肽过氧化物酶(Glutathione peroxidases,GPXs)是维持细胞内H2O2稳态的关键酶[1],它通过催化还原型谷胱甘肽(Glutathione,GSH)与H2O2反应生成氧化型谷胱甘肽(GSSG)及水,从而阻止羟基自由基(·OH)的产生,避免由其引发的质膜过氧化,进而保护细胞膜结构和功能的完整性[2]。由多个成员组成的GPXs广泛存在于动物和植物中,目前已发现植物体GPXs为诱导型表达,在不同胁迫条件下,编码GPXs基因的mRNA呈现不同水平的表达,GPXs在植物抗氧化过程中可能具有重要作用[3,4],因此关于植物中GPXs的相关研究备受关注,包括GPXs家族成员的获得、结构特征的阐释,以及应答胁迫的表达模式和亚细胞定位等[5-7]。
盐芥(Thellungiella salsuginea)是模式植物拟南芥的近缘物种,与拟南芥具有相似的生物学特征[8],且二者的cDNA序列同源性高达90%-95%[9,10],但属于盐生植物的盐芥却能够在含有500 mmol/L NaCl的高盐环境或 -15℃的低温条件下生存[11],具有强耐逆性。此外由于盐芥具有模式植物的生物学特性,因此被作为耐盐性研究的模式植物[12,13]。研究表明,拟南芥中AtGPXs由8个成员组成,其中AtGPX3不仅可以作为氧化信号传感器,还能在干旱胁迫下清除植物体内多余的脱落酸(Abscisic acid,ABA),响应ABA和干旱胁迫,这种双重机制在其他植物中也具有相似性[14]。本实验室前期对盐芥TsGPXs家族的8个成员进行了研究,皆具有3个典型的GPXs特征结构域,同时在应答不同胁迫时表达模式不同。在8个TsGPXs成员中,只有TsGPX3具有跨膜结构域,属于分泌蛋白,亚细胞定位预测分析显示可能定位在内质网或质膜上[7]。本研究通过构建植物表达载体、利用PEG介导拟南芥原生质体的瞬时表达进行TsGPX3亚细胞定位研究;构建原核表达载体,对蛋 白表达条件进行初步研究,旨在为进一步研究TsGPX3与盐芥抗逆性关系及植物GPXs的功能研究提供依据。
1 材料与方法
1.1 材料
盐芥山东生态型种子为本实验室保存。Trizol试剂购自Invitrogen公司,反转录酶M-MLV、pGEM-T载体、pET28a、限制性内切酶Nde I和Sal I购自Promega公司,大肠杆菌(Escherchia coli)DH5α和BL21(DE3)购自北京博迈德科技发展有限公司,pRTL2表达载体由北京师范大学惠赠,限制性内切酶Xho I和Xba I购自Fermentase公司,ECL试剂盒购自天根生化科技(北京)有限公司,考马斯亮蓝R-250购自北京百泰克生物技术有限公司,PVDF膜购自Millipore公司,辣根过氧化酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司,根据盐芥TsGPXs蛋白序列设计的盐芥TsGPX特异抗体(TsGPX-A)由北京华大蛋白质研发中心制备。
1.2 方法
1.2.1 材料准备 室内培养盐芥实生苗,培养基质为营养土∶蛭石= 3∶1的混合土,培养条件为光周期16 h/d,光照强度93 μmol/(m2·s),相对湿度60%/80%(昼/夜),温度为23℃/18℃(昼/夜),用Hoagland营养液浇灌。生长8周后,以Hoagland营养液配制300 mmol/L NaCl溶液,采用根灌法处理盐芥幼苗12 h后取样,迅速冻于液氮中,保存于-80℃,用于总RNA的提取。
1.2.2 盐芥总RNA的提取与盐芥TsGPX3基因全长的获得 采用Trizol法提取盐芥总RNA。以盐芥总RNA为模板,用M-MLV反转录酶合成cDNA,操作步骤按说明书进行。
根据本实验室前期获得的TsGPX3基因序列设计引物,引物序列为F1:5'-TGTCGATGCCTAAATCAAGC-3'/ R1:5'-GAAAATGAGATTCACACTGGTACTC-3'。以反转录得到的cDNA为模板进行PCR扩增,扩增条件为:95℃预变性3 min;95℃变性30 s,54℃退火50 s,72℃延伸50 s,共30个循环;72℃延伸7 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后回收目的条带,回收产物与pGEM-T载体连接,转化E.coli DH5α感受态细胞,并送至北京华大基因公司进行测序。
1.2.3 盐芥TsGPX3系统进化分析 在NCBI搜索与TsGPX3同源性较高的16种植物GPX3序列,采用MEGA 5.0进行系统进化分析。
1.2.4 盐芥TsGPX3的亚细胞定位 对TsGPX3基因序列和含有绿色荧光蛋白(Green fluorescence protein,GFP)的植物表达载体pRTL2-GFP进行酶切图谱分析,设计含酶切位点的引物F2:5'-CCGCT CGAGCGATGCCTAAATCAAGCACTTGG-3'(下划线部分为Xho I的酶切位点)/ R2:5'-GCTCTAGATCA AGCAGATGCCAATAGCTTC-3'(下划线部分为Xba I的酶切位点)。利用限制性内切酶Xho I 和Xba I将TsGPX3构建入pRTL2的C端GFP载体中,获得重组质粒pRTL2-TsGPX3-GFP,转化至E.coli DH5α中,菌液PCR鉴定与测序验证。
制备拟南芥叶片细胞的原生质体,将鉴定正确的重组质粒pRTL2-TsGPX3-GFP和空载体pRTL-GFP分别以PEG介导转化拟南芥原生质体,用激光共聚焦显微镜观察GFP标签的表达。
1.2.5 盐芥TsGPX3的原核表达 设计含有酶切位点的引物F3:5'-GGGAATTCCATATGCGATGCCTAAATCAAGCACTTGG-3'(下划线部分为Nde I酶切位点)/ R3:5'-ACGCGTCGACTCAAGCAGATGCCAATAGCTTC-3'(下划线部分为Sal I的酶切位点)。利用限制性内切酶Nde I和Sal I将 TsGPX3构建入pET28a载体中,获得重组质粒pET-TsGPX3。将重组质粒pET-TsGPX3和pET28a空载体分别转化至E.coli BL21(DE3)中,筛选阳性克隆进行酶切与测序验证。
分别将含有重组质粒pET-TsGPX3和空载体pET28a的E.coli BL21(DE3)接种于含氨苄青霉素(Ampicillin,Amp)的10 mL LB液体培养基,于37℃条件下振荡培养。在菌液到达对数期(OD600为0.8左右)时加入终浓度为1 mmol/L异丙基硫代半乳糖苷(IPTG)进行诱导。分别取1 mL菌液,在37℃下分别培养1、2、3、4和5 h,以确定最佳表达时间。分别取1 mL菌液,在16℃、28℃和37℃分别培养5 h时,以确定最佳表达温度。分别收集上述条件下所得菌体。每个样品取5 μL进行SDSPAGE电泳,考马斯亮蓝R-250染色,检测融合蛋白的表达情况。
1.2.6 诱导表达融合蛋白的Western blotting检测 SDS-PAGE电泳后,将未进行染色的凝胶转硝酸纤维素膜(转膜15 V,30 min),加入5%脱脂奶封闭液,于 100 r/min的摇床上室温封闭30 min。加入一抗(TsGPX-A抗体),于100 r/min的摇床上37℃孵育1 h,用TBST洗3遍,5 min/次。加入二抗(HRP标记的山羊抗小鼠IgG),于100 r/min的摇床上37℃孵育1 h,用TBST洗3遍,5 min/次。用ECL试剂盒进行显色,将试剂盒A、B液1∶1混合配成2 mL溶液,室温孵育PVDF膜1 min,用凝胶成像系统观察。
2 结果
2.1 盐芥TsGPX3基因的扩增与系统进化分析
以引物序列F1/R1 扩增TsGPX3的全长cDNA序列,大小为776 bp,其中6-596 bp为开放阅读框(ORF),编码196个氨基酸(图1)。TsGPX3蛋白的理论相对分子量为23.258 kD,理论等电点为7.33。TsGPX3具有植物GPX蛋白活性中心的3个保守Cys(C)残基以及3个保守特征结构域(催化结构域NVASKCG、标志性基序ILAFPCNQF和PHGPX的特征基序KWNFAKFL),且3个保守结构域中各含有1个催化氨基酸残基,即C、Q和W(图2)。
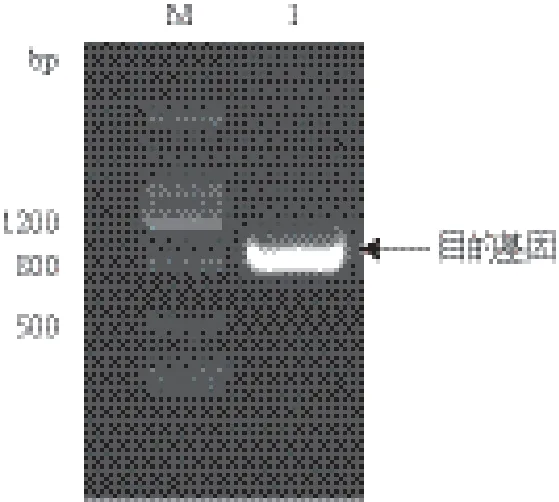
图1 盐芥TsGPX3基因全长cDNA的PCR扩增产物

图2 TsGPX3的核苷酸及推测的氨基酸序列
为了研究TsGPX3的进化关系,采用MEGA 5.0对TsGPX3及与TsGPX3同源性较高的16种植物GPX3序列进行系统进化树分析,结果(图3)显示,盐芥TsGPX3与同属于十字花科的萝卜(Raphanus sativus)RsGPX3、油菜(Brassica napus)BnGPX3、花椰菜(Brassica oleracea)BoGPX3、拟南芥(Arabidopsis lyrata)AlyGPX3和拟南芥(A. thaliana)At-GPX3同源性较高,聚为一类。与非十字花科的高粱(Sorghum bicolor)SbGPX3、玉米(Zea mays)ZmGPX3、水稻(Oryza sativa)OsGPX3、大麦(Hordeum vulgare)HvGPX3、蓝桉树(Eucalyptus globulus)EglGPX3、巨桉(Eucalyptus grandis)EgrGPX3以及小麦(Triticum aestivum)TaGPX3-1A、TaGPX3-1B、Ta-GPX3-1D的同源性较低。另外,研究发现,上述物种与莱茵衣藻(Chlamydomonas reinhardtii)CreGPX3和小立碗藓(Physcomitrella patens)PpaGPX3的同源关系均较远。
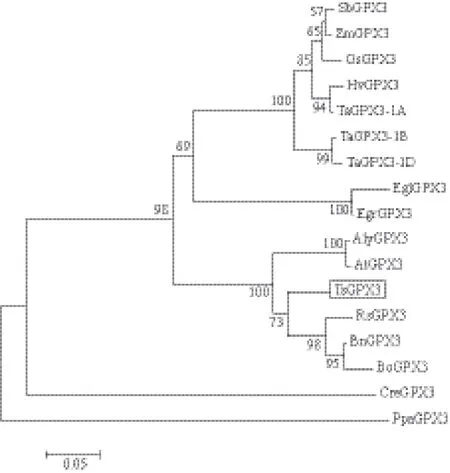
图3 盐芥TsGPX3及其他植物GPX3序列的系统进化分析
2.2 TsGPX3基因的亚细胞定位
将pRTL2空载体和经过鉴定的pRTL2-TsGPX3-GFP载体以PEG介导分别转化拟南芥原生质体,结果见图4。pRTL2空载体亚细胞定位结果(图4-A)显示,GFP荧光蛋白在细胞的各个部位都有表达,显示清晰的GFP绿色荧光信号。pRTL2-TsGPX3-GFP载体亚细胞定位结果(图4-B)显示,TsGPX3∷GFP融合蛋白仅在细胞膜位置产生荧光,由此推测TsGPX3基因所编码的蛋白主要定位在细胞膜上,与生物信息学预测结果基本一致。
2.3 盐芥TsGPX3蛋白的诱导表达
以未被IPTG诱导的pET28a空载体为对照,将经过鉴定的含有重组质粒pET-TsGPX3的E.coli BL21(DE3)在IPTG诱导下表达1、2、3、4和5 h后进行SDS-PAGE电泳,结果(图5-A)显示,含有pET-TsGPX3表达载体的E.coli BL21(DE3)在不同诱导条件下、在27 kD附近都出现1条新的特异条带,与TsGPX3预测大小基本一致,pET28a空载体没有特异蛋白表达。在5个诱导时间(1、2、3、4和5 h)处理中,TsGPX3融合蛋白的表达呈逐渐上升趋势,在5 h达到最高;在3个处理温度(16℃、28℃和37℃)下表达5 h,TsGPX3融合蛋白的表达量逐渐增加,在37℃时达到最高。采用Western blotting对诱导表达的融合蛋白进行验证,诱导表达的融合蛋白能够与抗体发生特异反应,证明表达产物为目的蛋白(图5-B)。
3 讨论
作为生物体抗氧化酶防御体系的关键酶之一,谷胱甘肽过氧化物酶(GPXs)通过多种信号途径在植物响应逆境中发挥重要作用[15]。本研究获得的盐芥TsGPX3基因所编码的蛋白含有植物GPXs蛋白活性中心的3个保守Cys(C)残基以及植物GPXs的3个保守特征结构域,且在3个保守结构域中均具有3个GPXs催化残基Cys70(C)、Gln101(Q)和Trp159(W),说明本研究获得的TsGPX3属于植物GPXs家族。与其他植物GPX3进行系统进化分析结果显示,TsGPX3与同属于十字花科物种的GPX3亲缘关系最近,而与非十字花科物种的GPX3亲缘关系较远,说明在进化过程中,不同科属植物物种的GPX3序列发生了一定的变化。

图4 空载体(A)及盐芥TsGPX3(B)亚细胞定位结果
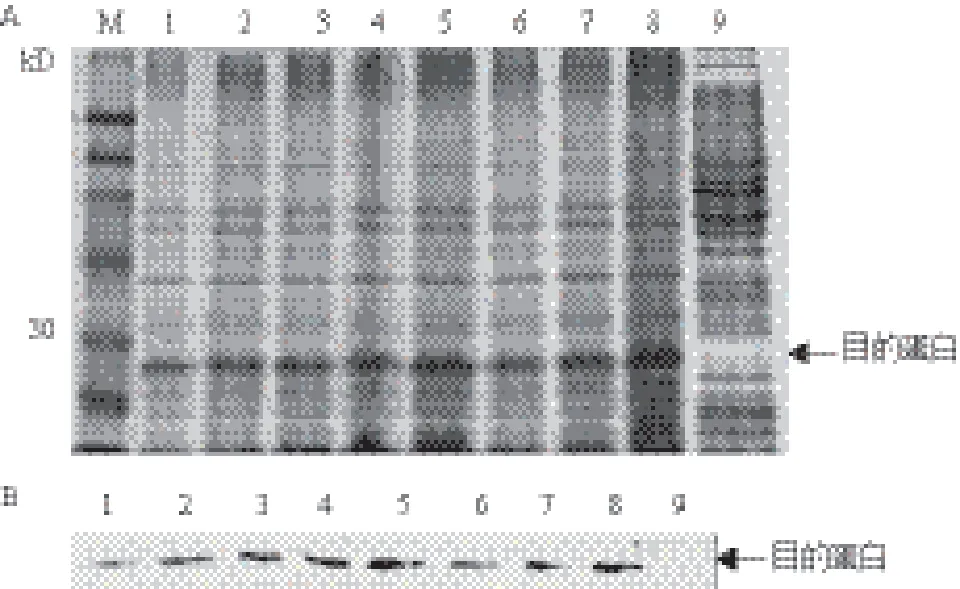
图5 pET-TsGPX3在E.coli BL21(DE3)中表达的SDSPAGE检测(A)和Western blotting鉴定(B)
植物GPXs家族有多个成员,不同成员的亚细胞定位与其行使的生物学功能相关。采用PSORT 在线分析软件进行盐芥TsGPXs 8个成员的亚细胞定位分析结果显示,TsGPX1和TsGPX7定位在叶绿体中,TsGPX2、TsGPX4、TsGPX5和TsGPX8定位在细胞质溶质中,TsGPX6定位在线粒体中,而TsGPX3定位在细胞膜和内质网膜上,且具有信号肽[7]。构建亚细胞定位载体进行亚细胞定位研究表明,盐芥TsGPX6主要定位在线粒体和内体中[16]。本研究通过亚细胞定位研究显示TsGPX3定位于细胞膜上,与预测基本相符。由于膜上分布众多的载体蛋白、与细胞活动相关的离子泵、通道蛋白和蛋白受体等,因此推测TsGPX3对细胞质膜的稳定或控制蛋白转运具有一定的作用[17]。已有研究显示拟南芥[14]、杨树[5]和百脉根[6]GPX3定位在细胞质中,而盐芥TsGPX3与其不同,主要定位在细胞膜上,其不同物种的GPX3亚细胞定位差异可能与抗逆功能有关,有待进一步探究。
大肠杆菌表达系统是目前应用最为广泛的原核表达系统[18],但融合蛋白在该系统中的表达结果可受多种因素影响,如诱导温度、诱导剂的浓度、诱导时间等。已有研究显示TsGPX8的原核表达融合蛋白大小约为23 kD,最佳表达条件为37℃,诱导培养5 h[19]。本研究构建了TsGPX3的原核表达载体并进行了原核表达蛋白的分析。前期预测的TsGPX3的分子量约为23 kD,将TsGPX8与His-tag融合后分子量大约为27 kD,与原核表达电泳图显示的结果一致。采用Western blotting验证诱导表达的融合蛋白,证明表达产物为目的蛋白。与TsGPX8原核表达体系的表达条件相似,从本研究实验结果可知,TsGPX3原核表达体系在37℃,诱导培养5 h具有较高的蛋白表达量。
4 结论
盐芥TsGPX3基因的全长cDNA序列大小为776 bp,编码一个包含196个氨基酸的蛋白,具有植物GPXs的特征结构域。系统进化分析表明,盐芥TsGPX3与同属于十字花科的萝卜RsGPX3、油菜BnGPX3和花椰菜BoGPX3等同源性较高。亚细胞定位研究显示TsGPX3主要定位于细胞膜上。TsGPX3原核表达体系在37℃,诱导培养5 h具有较高的蛋白表达量。
[1]Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends Plant Sci, 2002, 7(9):405-410.
[2]Bérczi A, Møller IM. Redox enzymes in the plant plasma membrane and their possible roles[J]. Plant, Cell and Environ, 2000, 23(12):1287-1302.
[3]赵宝添, 孙娜娜, 马志媛, 等. 实时定量 PCR 检测拟南芥和盐芥谷胱甘肽过氧化物酶表达水平[J]. 现代农业科技, 2009(14):332.
[4] 苗雨晨, 白玲, 苗琛, 等. 植物谷胱甘肽过氧化物酶研究进展[J]. 植物学通报, 2005, 22(3):350-356.
[5]Navrot N, Collin V, Gualberto J, et al. Plant glutathione peroxidases are functional peroxiredoxins distributed in several subcellular compartments and regulated during biotic and abiotic stresses[J]. Plant Physiol, 2006, 142(4):1364-1379.
[6]Ramos J, Matamoros MA, Naya L, et al. The glutathione peroxidase gene family of Lotus japonicus:characterization of genomic clones, expression analyses and immunolocalization in legumes[J]. New Phytol, 2009, 181(1):103-114.
[7]Gao F, Chen J, Ma TT, et al. The glutathione peroxidase gene family in Thellungiella salsuginea:genome-wide Identification, classification, and gene and protein expression analysis under stress conditions[J]. Int J Mol Sci, 2014, 15:3319-3335.
[8]王莹, 任大明. 盐芥一新型耐盐模式植物及其研究进展[J].湖北农业科学, 2010, 49(9):2264-2267.
[9]Wang ZL, Li PH, Zhang H, et al. Expressed sequence tags from Thellungiella halophila, a new model to study plant salttolerance[J]. Plant Sci, 2004, 166(3):609-616.
[10]Wong CE, Li Y, Whitty BR, et al. Expressed sequence tags from the Yukon ecotype of Thellungiella reveal that gene expression in response to cold, drought and salinity shows little overlap[J]. Plant Mol Biol, 2005, 58(4):561-574.
[11]Taji T, Seki M, Satou M, et al. Comparative genomics in salt tolerance between Arabidopsis and Arabidopsis-related halophyte salt cress using Arabidopsis microarray[J]. Plant Physiol, 2004, 135(3):1697-1709.
[12]Meng CM, Cai CP, Zhang TZ, et al. Characterization of six novel NAC genes and their responses to abiotic stresses in Gossypium hirsutum L. [J]. Plant Sci, 2009, 176(3):352-359.
[13]Hasegawa M, Bressan R, Pardo JM. The dawn of plant salt tolerance genetics[J]. Trends Plant Sci, 2000, 5(8):317-319.
[14]Miao Y, Lv D, Wang P, et al. An Arabidopsis glutathione peroxidase functions as both a redox transducer and a scavenger in abscisic acid and drought stress responses[J]. Plant Cell, 2006, 10(18):2749-2766.
[15]Rodriguez Milla MA, Maurer A, Rodriguez Huete A, et al. Glutathione peroxidase genes in Arabidopsis are ubiquitous and regulated by abiotic stresses through diverse signaling pathways[J]. Plant J, 2003, 36(5):602-615.
[16]马亭亭, 周宜君, 高飞. 盐芥谷胱甘肽过氧化物酶基因(ThGPX6)的克隆及表达分析[J]. 植物遗传资源学报, 2012, 13(2):252-258.
[17]邢浩然, 刘丽娟, 刘国振. 植物蛋白质的亚细胞定位研究进展[J]. 华北农学报, 2006, 21:1- 6.
[18]李秀娟. 盐藻DsRab基因的载体构建、原核表达及亚细胞定位分析[D]. 大连:大连海洋大学, 2014.
[19]张孜宸, 隋欣, 高飞, 等. 盐芥谷胱甘肽过氧化物酶基因(ThGPX8)的克隆与原核表达[J]. 西北农林科技大学学报, 2013, 41(11):165-172.
(责任编辑 马鑫)
Cloning,Subcellular Localization and Prokaryotic Expression of Gene TsGPX3 from Thellungiella salsuginea
WANG Ning1CHEN Jing1,2GAO Fei1LI Hua-yun1SUI Xin1ZHOU Yi-jun1
(1. College of Life and Environmental Sciences,Minzu University of China,Beijing 100081;2. Institute of Forensic Science,Ministry of Public Security of P. R. China,Beijing 100741)
A cDNA of TsGPX3(Thellungiella salsuginea GPX3)was isolated from T. salsuginea,and it contained a complete ORF with 591 bp encoding 196 amino acid residues. The three conservative domains of TsGPX3 protein in GPXs family was predicted by bioinformatics analysis. Phylogenetic analysis discovered that TsGPX3 was in high homology with RsGPX3 of Raphanus sativus,BnGPX3 of Brassica napus,and BoGPX3 of B. oleracea etc.,all belonging to Brassicaceae. The plant-expressed vector pRTL2-TsGPX3-GFP was transiently expressed by transforming the protoplasts of Arabidopsis thaliana via PEG method,and it was discovered that the TsGPX3 protein was mainly located in the plasma membrane. The constructed prokaryotic vector pET-TsGPX3 was transferred into Escherichia coli strain BL21(DE3)for induced expression under different concentration of IPTG,and a 27 kD recombinant protein was highly expressed after induced for 5 h at 37℃.
TsGPX3;Thellungiella salsuginea;subcellular localization;prokaryotic expression
10.13560/j.cnki.biotech.bull.1985.2016.04.014
2015-07-09
国家自然科学基金项目(31370356,31070361),中央民族大学一流大学一流学科项目(YLDX01013,2015MDTD08C),中央民族大学研究生科研创新项目(2015)
王宁,女,硕士,研究方向:植物分子生物学,E-mail:wzpn123@163.com;陈静为本文并列第一作者
周宜君,女,博士,教授,研究方向:植物分子生物学;E-mail:queenzhou@263.net

