三个绵羊群体MC4R基因多态性及生物信息学分析
刘娇娇马友记
(1. 甘肃农业大学 动物科学技术学院,兰州 730070;2. 甘肃省肉羊繁育生物技术工程实验室,民勤 733300)
三个绵羊群体MC4R基因多态性及生物信息学分析
刘娇娇1,2马友记1,2
(1. 甘肃农业大学 动物科学技术学院,兰州 730070;2. 甘肃省肉羊繁育生物技术工程实验室,民勤 733300)
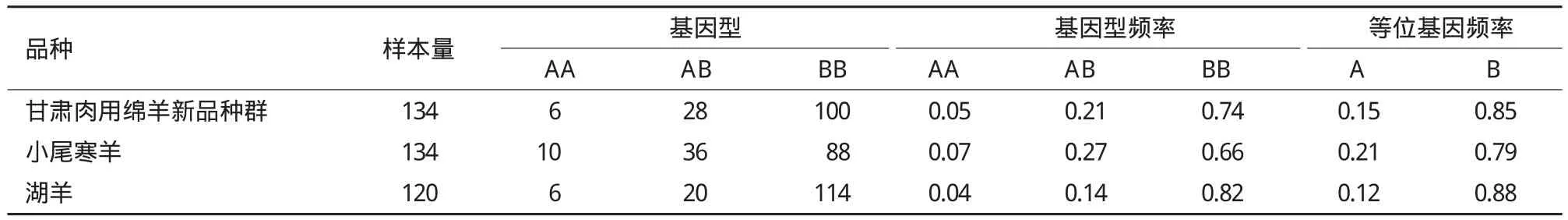
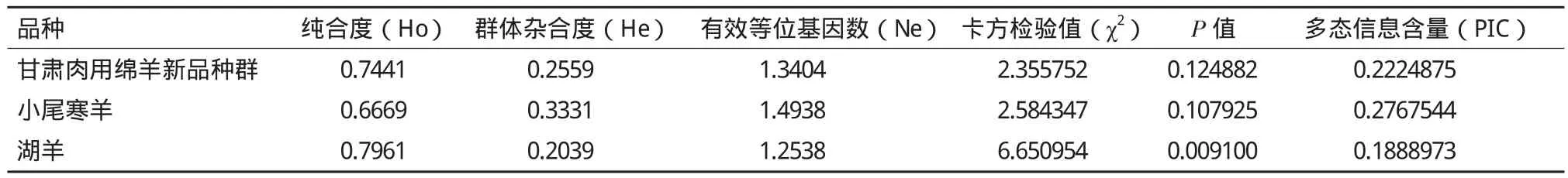
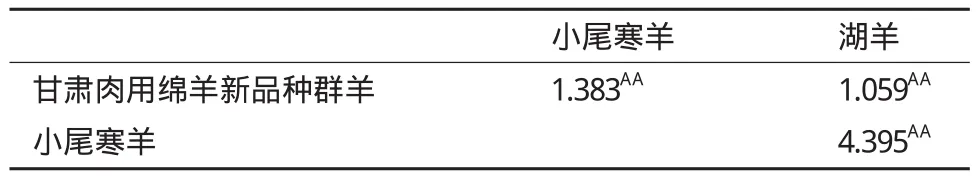
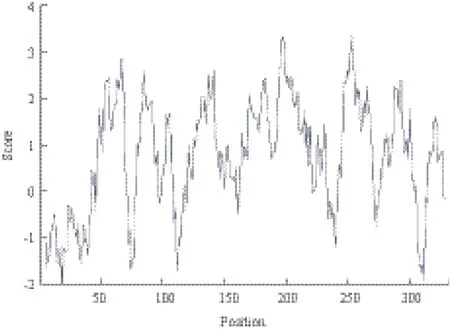
旨在探讨绵羊黑素皮质素受体-4(melanocortin-4 receptor,MC4R)的分子机理,采用PCR-SSCP方法对3个绵羊群体(甘肃肉用绵羊新品种群、小尾寒羊和湖羊)的MC4R基因外显子进行多态性检测和生物信息学分析。结果表明,3个绵羊群体均存在3种基因型AA型、AB型和BB型,优势基因型为BB,其中优势等位基因为B;测序结果表明,野生型BB型和突变型AB型相比,AB型个体在该基因编码区第511位点发生G→A突变,第495位发生C→T突变;AA型个体在该基因编码区第511位点发生G→A突变,出现AA的纯合,第495位发生C→T突变,出现CC纯合;3个绵羊群体中小尾寒羊的多态信息含量属于中度多态(0.25 绵羊;黑素皮质素受体-4;多态性;生物信息学 MC4R(Melanocortin-4 receptor)是下丘脑腹内侧核(VMH)分泌的一种肽类物质,它是G蛋白偶联受体(G protein coupled receptors,GPCRs)超家族的一个成员,在人和鼠的体重、能量稳态和采食量的调控中具有重要作用[1]。MC4R在哺乳动物中,具有介导瘦蛋白(Leptin)的功能,是一个调节能量动态平衡的重要信号分子[2]。MC4R是第一个被发现的与人类显性遗传疾病性肥胖相关的靶位点[3]。鼠和人遗传学研究显示MC4R基因在采食量和能量平衡调控中具有重要作用,缺乏MC4R基因的鼠易多食、肥胖,说明MC4R基因在采食量和能量平衡调控中具有重要作用[4,5]。MC4R 在哺乳动物下丘脑、丘脑、胎盘、十二指肠、脑干、脊索、胰腺、胃,鸡肾上腺、性腺、脾、脂肪和脑等组织均有表达,具有多种生物学活性。在貉子[6]、猪[7,8]、牛[9]、鸡[10]中,MC4R基因突变已经被确定为生长性状的遗传标记。甘肃肉用绵羊新品种选育群是利用杜泊、无角陶赛特等引入品种为父本,小尾寒羊和蒙古羊为母本,采用复杂育成杂交培育出的生长发育快、抗病力强、繁殖力高的适应甘肃河西走廊生态条件的肉用绵羊新品种群;湖羊是原产于太湖流域的高繁殖力品种,目前已引入到甘肃肉用绵羊新品种选育群的核心育种区域且表现出良好的适应性。本研究在分析MC4R基因在小尾寒羊、湖羊和甘肃肉用绵羊新品种群中的多态性的基础上,应用生物信息软件对其生物信息学分子特征进行分析,以期为下一步的育种工作提供理论依据。 1.1 材料 1.1.1 血样采集 小尾寒羊(134只)、湖羊(120只)和甘肃肉用绵羊新品种群羊(134只)均来自甘肃永昌肉用种羊场,颈静脉采血10 mL,ACD 抗凝剂,-20℃冰箱保存备用。 1.1.2 主要试剂 所需要的试剂主要有:蛋白酶K、PCR mix酶,6×Buffer、PCR产物回收试剂盒、琼脂糖、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵等。采用西班牙的琼脂糖,来自于百泰克的PCR mix酶。 1.2 方法 1.2.1 血液基因组DNA的提取及检测 采用传统的酚氯仿法提取基因组DNA,用1%琼脂糖凝胶电泳检测。 1.2.2 引物 参考MC4R基因序列(GenBank登录号:JQ710684)设计引物,引物由生工生物工程(上海)有限公司合成。序列及相应的摸索条件见表1。 表1MC4R外显子引物序列、摸索条件及PCR产物大小和位置 1.2.3 PCR扩增 PCR反应体系:25 μL,其中模板基因组DNA 1.0 μL,上下游引物各1.0 μL(10 pmol/μL),PCR mix酶12 μL,水10 μL。PCR反应程序:94℃ 4 min;94℃ 45 s,61.2℃ 45 s,72℃ 1 min。PCR 产物用2%琼脂糖凝胶电泳检测,以确认扩增效果。 1.2.4 SSCP分析 将3 μL PCR产物和7 μL变性剂(98%甲酰胺、0.025%溴酚蓝、0.025%二甲苯氰、10 mmol/L EDTA)混匀,98℃变性10 min,立即冰浴10 min变性,变性后的PCR产物在12%非变性聚丙烯酰胺Acr∶bis(29∶1)凝胶中在常温环境下电泳,250 V 电压10 min 后,改为160 V 电压8 h。电泳结束后用硝酸银染色,显色后,用去离子水洗2遍。 1.2.5 测序 对目的PCR产物中的目的条带用回收试剂盒进行回收,检测纯度,送到上海生工生物工程(上海)有限公司进行测序。 1.2.6 数据统计与分析 利用DNAman和Bioeditor软件进行测序结果分析;使用Popgene Version 32生物软件计算等位基因频率、基因型频率、群体纯和度(Ho)、群体杂合度(He)、有效等位基因数(Ne),并检验是否处于Hardy-Weinberg平衡;利用PIC软件计算多态信息含量(PIC)值;利用SAS 8.0软件进行显著性分析;利用NCBI中的ORF find 确定寻找了MC4R的编码区,并进行氨基酸的翻译,利用BLAST对突变位点编码的氨基酸序列进行比对,采用NetPhos 2.0 Server在线分析程序预测蛋白质的磷酸化位点,采用Interpro在线分析软件预测蛋白质中包含的结构域,采用PredictProtein在线预测蛋白质的二、三级结构。 图1 MC4R基因外显子PCR扩增产物的SSCP分析 2.1 MC4R基因PCR-SSCP结果 对扩增产物进行SSCP分析,结果(图1)显示出现3种基因型,分别为BB、AB和AA型。 2.2 测序结果 测序结果发现BB型和AB型相比,AB型个体在该基因编码区第511位点发生G→A的突变,出现G/A的杂合,第495位发生C→T的突变,出现C/T杂合;AA型个体在该基因编码区第511位点发生G→A的突变,出现AA的纯合,第495位发生C→T的突变,出现CC纯合。第495位的C→T转换并没有引起对应密码子翻译的氨基酸发生改变,由AGC变为AGT,均翻译成丝氨酸(Ser);第511位的C→T转换后密码子由GAA→AAA,翻译的氨基酸由谷氨酸(Glu)转换为赖氨酸(Lys)。 2.3 MC4R基因外显子的群体遗传学分析 通过对3个绵羊品种共388个样本SSCP检测结果(表2)进行分析发现,甘肃肉用新品种群羊、小尾寒羊和湖羊的优势基因型均为BB型,优势等位基因均为B基因。群体纯和度(Ho)、杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC)是评价群体内遗传多样性的指标,小尾寒羊属于中度多态(0.25 表2 基因型和基因型频率 表3 遗传多态性分析 2.4 不同基因型在3个绵羊群体中分布的差异显著性检验 采用SAS 8.0软件对MC4R基因外显子不同基因型在3个绵羊群体中的分布差异进行显著性检验,结果(表4)表明,甘肃肉用新品种群羊、小尾寒羊和湖羊3个品种的绵羊之间分布差异均不显著(P>0.05)。 表4 3个绵羊群体在MC4R基因外显子中分布的独立性检验 2.5 MC4R基因的生物信息学分析结果 2.5.1 MC4R基因编码蛋白的理化性质 MC4R基因编码蛋白的基本理化性质,用Protparam工具进行在线预测。预测结果表明,该蛋白分子式为C1666H2621N413O456S26,其理论等电点为7.09,分子量为3.0472 kD。该蛋白共包含20种基本氨基酸,Leu含量最高,占11.4%,其中Trp含量最低,为0.9%。该蛋白共含有17个负电荷残基(ASP+Glu)和17个正电荷残基(Arg+Lys)。总平均亲水性为0.755,脂溶指数为118.31,不稳定指数为49.06,为不稳定蛋白。 2.5.2 MC4R基因编码蛋白的疏水性/亲水性预测和分析 MC4R基因编码蛋白的亲水性和疏水性分析运用ProtScale在线软件进行。氨基酸亲水性越强其分值越低,反之分值越高疏水性越强。图2显示,整个多肽链表现为疏水性。 2.5.3 MC4R基因编码蛋白信号肽和跨膜区分析对MC4R基因编码蛋白的信号肽分析,用SignalP3.0在线软件进行分析,SignalP3.0主要是预测信号肽的切割位点及其分泌途径,结果(图3)表明该蛋白存在信号肽,发现在第1-22位氨基酸可能为信号肽,并且可能在第22和23位氨基酸之间发生切割。MC4R 基因编码蛋白的跨膜结构经TMHMM2.0分析,结果(图4)表明,编码蛋白序列有7个跨膜区域,属于跨膜转运蛋白。 图2 MC4R基因编码蛋白疏水性分析 图3 MC4R基因编码氨基酸序列信号肽分析 图4 MC4R基因编码氨基酸序列跨膜区预测 2.5.4 MC4R基因编码蛋白结构域和蛋白质功能位点预测 结构域是蛋白质亚基结构中明显分开的紧密球状结构区域,是蛋白序列结构和进化单元,具有一定生物学功能。通过InterPro对MC4R基因编码蛋白的结构域预测,结果(图5)显示,该序列在第61-302位氨基酸之间属于G蛋白偶联受体超家族结构域,它具有7个结构域,分别位于氨基酸位点 64-70、79-100、129-151、165-186、193-216、243-267和284-310。通过NetPhos 2.0对蛋白质的磷酸化位点预测,结果表明,该蛋白含有10个磷酸化位点,分别位于第15、30、35、47、127、150、162、178、30和312位处。 2.5.5 MC4R基因编码蛋白的高级结构 蛋白质的空间构象与功能有密切关系,生物体内蛋白质的合成、加工和成熟是一个复杂的过程,其中多肽链的正确折叠对其正确构象的形成和功能的发挥至关重要。因而预测及分析蛋白质的高级结构对了解其空间构象具有重要意义。MC4R基因编码蛋白的 二级结构预测结果(图6)表明,该蛋白由51.5%的α螺旋、1 6.27%的β折叠 和32.23%的无规则卷曲组成。可推断MC4R基因编码蛋白主要的二级结构元件是α螺旋和无规则卷曲。运用同源建模的方法,将MC4R基因编码蛋白序列提交至SWISS-MODEL,该结果(图7)与二级结构预测结果基本一致。 图5 MC4R基因编码蛋白的结构域预测 2.5.6 MC4R同源性比对 在各物种中MC4R基因具有高度的同源性,通过绵羊的MC4R基因与山羊(Capra hircus,NCBI登录号:NM_001285591.1)、牛(Bos taurus,NCBI登录号:EU366351.1)、野猪(Sus scrofa,NCBI登录号:EU169096.1)、人类(Homo sapiens,NCBI登录号:JX515605.1)及大猩猩(Gorilla gorilla,NCBI登录号:FJ373054.1)进行同源性比对,结果表明,他们的相似性分别为97%、94%、81%、83%和83%。 图6 MC4R基因编码蛋白的二级结构预测 图7 MC4R基因编码蛋白质的三级结构预测模型 绵羊MC4R基因有1 765 bp,含有998 bp的完整CDs,编码332个氨基酸(GenBank登录号:JQ710684.1),只有一个外显子,编码332个氨基酸(GenBank登录号:AFJ95892.1)。近年来,国内外关于绵羊MC4R基因多态性的研究报道有第1232位点的G→A 的突变与绵羊背膘厚度间存在关联,AG和AA 型较GG型具有较高的背膘厚度;第1 016位点的G→A转换,湖羊基因型GG型,有较高的45 d断奶体重[11]。本实验发现3个绵羊群体均存在3种基因型,AB型个体在该基因编码区第511位点发生G→A的突变,出现G/A的杂合,第495位发生C→T的突变,出现C/T杂合;AA型个体在该基因编码区第511位点发生G→A的突变,出现AA的纯合,第495位发生C→T的突变,出现CC纯合。其中第495位的C→T转换并没有引起对应密码子翻译的氨基酸发生改变,由AGC变为AGT,均翻译成Ser;第511位的C→T转换后密码子由GAA→AAA,翻译的氨基酸由Glu转换为Lys。MC4R基因编码区第511位点的突变在不同绵羊群体中分布差异不显著,但编码的氨基酸不同,可能会引起黑素皮质素受体的构型不同,导致蛋白质的功能可能有所差异,作为控制绵羊生长性状的潜在遗传标记位点,还有待于进一步的实验确认。 3个绵羊品种的优势基因型均为BB型,优势等位基因均为B基因。小尾寒羊多态信息含量处于0.25-0.5之间,属于中度多态,甘肃肉用绵羊新品种群羊和湖羊属于低度多态(PIC<0.25);χ2适合性检验表明:除湖羊之外,其余2个绵羊品种均处于Hardy-Weinberg平衡状态;这2个品种的绵羊已经形成了适应各自生存环境的遗传特性,该突变位点在所在群体内能够稳定遗传。而湖羊的非Hardy-Weinberg平衡状态,说明该地区自然选择或者人工选择对该基因分布的影响较大,造成其分布的不平衡,这可能与育种中的个体选择有关。显著性检验分析表明:该突变位点在3个品种绵羊相互之间分布差异不显著。 生物信息学的预测对MC4R功能研究具有一定的指导意义。研究发现MC4R基因蛋白分子式为C1666H2621N413O456S26,其理论等电点为7.09,分子量为 3.047 2 kD,包含20种基本氨基酸,总肽链表现为疏水性,脂溶指数为118.31,流动性较强,不稳定指数为49.06,属于跨膜转运蛋白,这与张菊等[12]利用生物信息学方法,对MC4R编码的蛋白进行功能预测结果一致。 绵羊的生长性状是其重要的经济性状之一,国内外的大量研究表明,MC4R基因在动物体重、采食量和能量稳态的控制中具有重要作用,是一个调节能量平衡与能量动态平衡的重要信号分子,在人、猪和马等哺乳动物中主要影响机体脂肪、增重和采食等性状[13]。而绵羊的多态性突变也会影响到背膘厚和初生重、断奶重等生长性状,而本研究检测到的位点在甘肃肉用绵羊新品种群羊、小尾寒羊和湖羊3个品种间没有显著性差异,若将该位点作为绵羊生长性状相关突变位点研究还需扩大种群数量、品种种类并同生产性状进行进一步的研究。 MC4R在甘肃肉用绵羊新品种群羊、湖羊和小尾寒羊群体中均存在3种基因型AA型、AB型和BB型,2个多态性位点C495T、G511A;χ2适合性检验表明,甘肃肉用绵羊新品种群羊和小尾寒羊均处于Hardy-Weinberg平衡状态;生物信息学分析表明绵羊MC4R是一个非常保守的蛋白,在绵羊的生长发育中起着重要作用。 [1]蒋思文, Acobsson L, Kerje S, 等. 参考家系鸡黑素皮质素受体3基因多态性与体重关系研究[J]. 遗传学报, 2002, 29(4):322-325. [2]Walter MA, Spillett DJ, Thomas P, et al. A method for constructing radiation hybrid maps of whole genomics[J]. Nature Genetics, 1994, 7(1):22-28. [3]Hwa JJ, Ghibaudi L, Gao J, et al. Centro melanocortin system modulates energy intake and expenditure of obese and lean Zucker rats[J]. American Journal of Physiology, 2001, 281(2):444-451. [4]Huszar D, Lynch CA, Faichild-Huntress V, et al. Targeted disruption of the melanocortin 4 receptor results in obesity in mice[J]. Cell, 1997, 88(1):131-141. [5]Yeo GS, Farooqi IS, Aminian S, et al. A frame shift mutation in MC4R associated with dominantly inherited human obesity[J]. Nature Genetics, 1998, 20(2):111-112. [6]潘宝丽. 貉子MC4R、POUIFI基因多态性及其与生长性状关系的研究[D]. 长春:吉林农业大学, 2011. [7]赵晓枫, 聂光军, 徐宁迎. 金华猪促黑激素皮质素受体4基因多态性分析[J]. 养猪, 2004, 18(5):22-24. [8]李海涛. 猪PGC-1、Mc4R基因的多态性及其与主要经济性状关系的研究[D]. 哈尔滨:东北农业大学, 2008. [9]刘洪瑜. 牛脂肪代谢相关基因遗传分析及其与秦川牛经济性状关联分析[D]. 杨凌:西北农林科技大学, 2009. [10]仇雪梅, 李宁, 邓学梅, 等. 鸡 MC4R 基因的 SNPs 及其与屠体性状的相关研究[J]. 中国科学C辑生命科学, 2006, 36(2):127-133. [11]张高振. MC4R基因多态性及其与湖羊早期生长性状的相关研究[D]. 南京:南京农业大学, 2009. [12]张菊. 绵羊CAST、MC4R和BTG1基因的克隆、组织表达和遗传多态性分析[D]. 北京:中国农业科学院, 2009. [13]吴建平, 张利平. 肉羊体脂脂肪酸与肉品质关系的研究[J].甘肃农业大学学报, 2000, 36(4):363-369. (责任编辑 狄艳红) Polymorphism and Bioinformatics Analysis of Gene MC4R in 3 Sheep Populations LIU Jiao-jiao1,2MA You-ji1,2 To investigate the molecular mechanism of Melanocortin-4 receptor(MC4R),PCR-SSCP was used to detect the polymorphism and analyze the bioinformatics of gene MC4R exon in 3 sheep populations(Gansu meat sheep new breeding population,Small Tail Han sheep,and Hu sheep). The results showed that 3 genotypes of AA,AB and BB existed in 3 populations,and the dominant genotype was BB,the preponderant allele was B. The sequencing analysis indicated that comparing wild BB and mutated AB,G→A mutation in locus 511 and T→C mutation in locus 495 happened in AB;G→A mutation in locus 511 with AA homozygosity and T→C mutation in locus 495 with CC homozygosity happened in AA. The PIC of Small Tail Han sheep was moderately polymorphic(0.25 < PIC < 0.50),Gansu meat sheep new breeding population and Hu sheep belonged to low polymorphism(PIC < 0.25). Except the Hu sheep,the other 2 sheep breeds were in Hardy-Weinberg equilibrium by χ2test. Bioinformatics analysis showed that the amino acid sequence of MC4R had hydrophobic region significantly,7 transmembrane helical regions and signal peptide. The main elements in the second structure of the encoded protein were the α helix and random coil. Homology analysis demonstrated that the similarity of gene MC4R in sheep with goat,cattle,pig,human,and gorilla was 97%,94%,81%,83% and 83% respectively,indicating that MC4R was an evolutionarily conserved protein,and played an important role in growth o f sheep. sheep;gene MC4R;polymorphism;bioinformatics 10.13560/j.cnki.biotech.bull.1985.2016.04.011 2015-06-23 国家科技十二·五支撑计划(2011BAD28B05),甘肃省农业生物技术研究与应用开发项目(GNSW-2012-19),甘肃省高校基本科研业务费(2014) 刘娇娇,女,硕士研究生,研究方向:动物生产学;E-mail:714643318@qq.com 马友记,博士,教授,研究方向:羊生产系统与工程;E-mail:yjma@gsau.edu.cn1 材料与方法


2 结果





3 讨论
4 结论
(1. Faculty of Animal Science and Technology,Gansu Agriculture University,Lanzhou 730070;2. Gansu Engineering Laboratory of Sheep Breeding Biotechnology,Minqin 733300)

