新型环己烯酮衍生物的合成
王玉婷, 王现全, 张 苈, 涂 红, 李 凯, 尹振东, 陈和举, 欧阳贵平*
(1. 贵州大学 精细化工研究开发中心,贵州 贵阳 550025; 2. 山东先达化工有限公司,山东 济南 250000)
·快递论文·
新型环己烯酮衍生物的合成
王玉婷1, 王现全2, 张苈1, 涂红1, 李凯2, 尹振东1, 陈和举1, 欧阳贵平1*
(1. 贵州大学 精细化工研究开发中心,贵州 贵阳550025; 2. 山东先达化工有限公司,山东 济南250000)
摘要:根据活性基团拼接原理,以烯草酮为先导化合物,通过修饰其肟醚位,引入具有除草活性的环苯草酮肟醚结构,设计并合成了一个新型的环己烯酮衍生物(7)。以对氯苯酚为原料,经取代、还原、卤代、肟醚化、水解等5步反应制得O-[2-(4-氯苯氧基)丙基]-羟胺盐酸盐(5); 5与5-[2-(乙硫基)丙基]-3-羟基-2-丙酰基-2-环己烯-1-酮反应合成了7,其结构经1H NMR,13C NMR, IR, ESI-MS和元素分析表征。
关键词:烯草酮; 肟醚; 环己烯酮; 活性基团拼接原理; 合成
部分除草剂由于长期使用,均已出现杂草抗性。药效降低,环境污染较大等问题,已成为制约除草剂效果的主要因素,新型除草剂的研发迫在眉睫[1-3]。
环己烯酮类除草剂以乙酰辅酶A羧化酶为作用靶标,具有作用机制独特和选择性较高等优点[4-6]。该类除草剂的主要有效成分包括:烯草酮(A, Chart 1),三甲基苯草酮,烯禾啶,吡喃草酮,噻草酮,环苯草酮(B, Chart 2)和丁苯草酮等。其结构特点为:5-位为含硫或氧原子烷基、苯基,肟醚位为氯代烯丙基或苯基[7-14]。
本文根据活性基团拼接原理,以A为先导化合物,通过修饰其肟醚位,引入具有除草活性的环苯草酮肟醚结构,设计并合成了7。以对氯苯酚为原料,经取代、还原、卤代、肟醚化、水解等5步反应制得O-[2-(4-氯苯氧基)丙基] -羟胺盐酸盐(5); 5与5-[2-(乙硫基)丙基]-3-羟基-2-丙酰基-2-环己烯-1-酮(6)反应合成了一个新型的环己烯酮衍生物——2-【1-{[2-(4-氯苯氧基)丙氧基]亚氨基}丙基】-5-[2-(乙硫基)丙基]-3-羟基-2-环己烯-1-酮(7, Scheme 1),其结构经1H NMR,13C NMR, IR, ESI-MS和元素分析表征。

Scheme 1

Chart 1
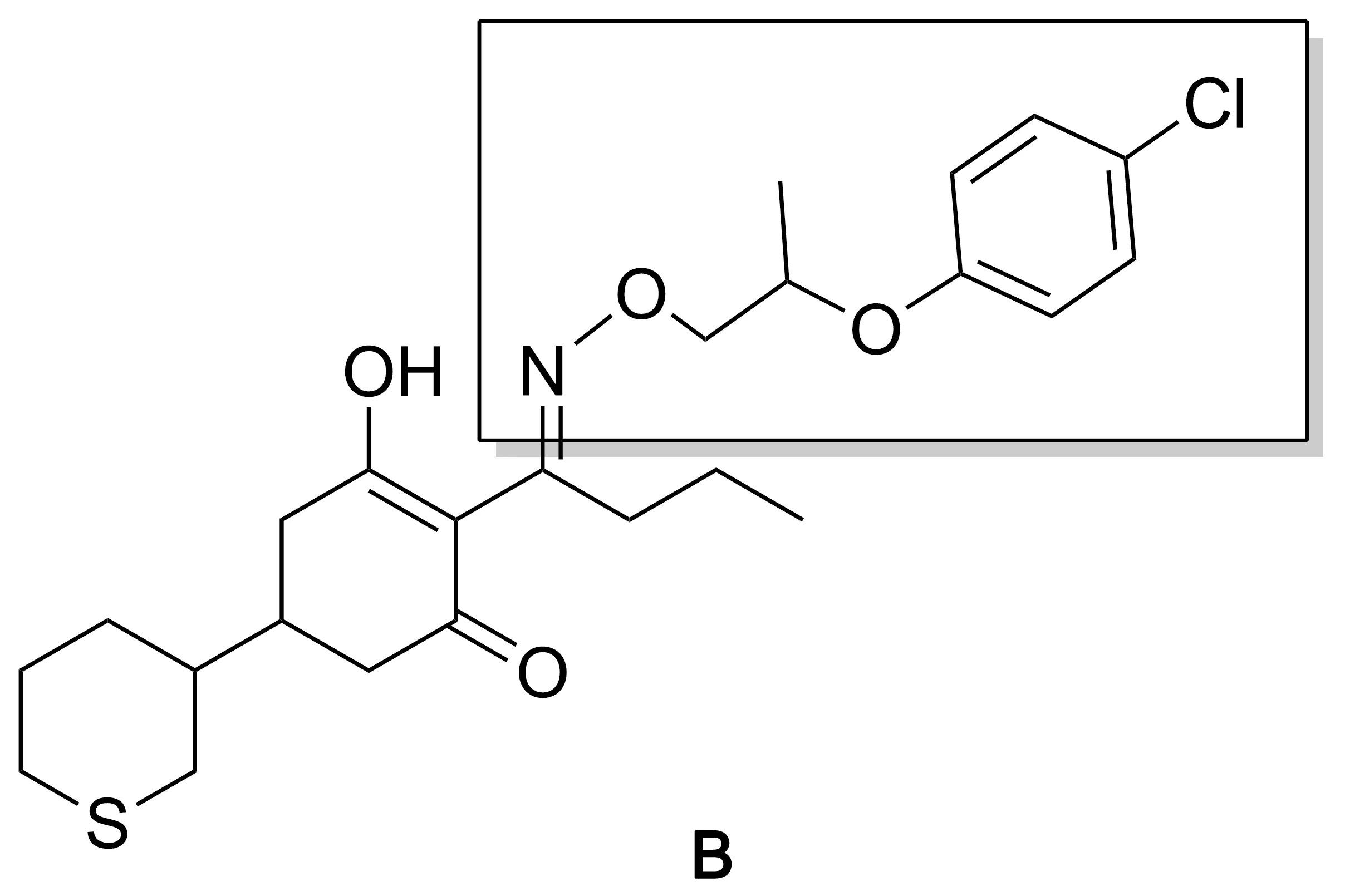
Chart 2
1实验部分
1.1仪器与试剂
ZF-Ⅰ型三用紫外分析仪;JEOL-500 MHz型核磁共振波谱仪(DMSO-d6为溶剂,TMS为内标);IR Prestige-21型红外光谱仪(KBr压片);Agilent 1100 MSD-Trap-VL型质谱仪。
6按文献[15]方法合成;其余所用试剂均为化学纯。
1.2合成
(1) 2-(4-氯苯氧基)丙酸甲酯(1)的合成
在圆底烧瓶中加入对氯苯酚5.00 g(38.89 mmol)和无水DMF 20 mL,搅拌使其溶解;加入K2CO38.14 g,于60 ℃反应1 h。缓慢滴加2-氯丙酸甲酯5.04 g(41.12 mmol)和KI 0.5 g,于80 ℃反应4 h(TLC检测)。用水(3×30 mL)洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂A:V(乙酸乙酯) ∶V(石油醚)=1 ∶25]纯化得淡黄色液体1 8.10 g,产率97%;1H NMRδ: 7.28(d,J=7.0 Hz, 2H), 6.90(d,J=7.0 Hz, 2H), 4.96(q,J=6.7 Hz, 1H), 3.64(s, 3H), 1.47(d,J=6.8 Hz, 3H);13C NMR: 172.20, 156.62, 129.79, 125.51, 117.39, 71.84, 52.45, 18.63。
(2) 2-(4-氯苯氧基)-1-丙醇(2)的合成
冰浴冷却下,在三口烧瓶中加入LiAlH41.72 g和无水THF 10 mL,搅拌5 min;加入AlCl31.01 g,搅拌15 min;缓慢滴加1 8.10 g(37.74 mmol)的无水THF(20 mL)溶液,滴毕(1 h),反应15 min(TLC检测)。用饱和Na2SO4溶液淬灭反应,用乙酸乙酯萃取,有机相用无水硫酸钠干燥,浓缩得无色液体2 5.35 g,产率76%;1H NMRδ: 7.26(d,J=9.4 Hz, 2H), 6.94(d,J=9.4 Hz, 2H), 4.48~4.41(m, 1H), 3.69~3.54(m, 2H), 1.26(d,J=6.8 Hz, 3H);13C NMRδ: 157.77, 129.88, 125.76, 117.80, 75.94, 65.85, 16.46; IRν: 3 400 cm-1。
(3) 2-氯异丙基-对氯苯基醚(3)的合成
在干燥圆底烧瓶中加入二氯亚砜6.3 mL和干燥CH2Cl230 mL,加热至回流;缓慢滴加2 5.35 g(28.68 mmol)的CH2Cl2(10 mL)溶液,滴毕,回流反应6 h。减压除溶,向残余物中滴加3滴吡啶,于80 ℃反应0.5 h(TLC检测)。依次用水(30 mL)和10%NaHCO3溶液(2×30 mL)洗涤,用无水硫酸钠干燥,浓缩后经硅胶柱层析(洗脱剂:A=1 ∶10)纯化得淡黄色液体3 5.25 g,产率89.4%;1H NMRδ: 7.26(d,J=8.3 Hz, 2H), 6.94(d,J=8.3 Hz, 2H), 4.66(dd,J=10.7 Hz, 5.5 Hz, 1H), 3.80~3.70(m, 2H), 1.29(d,J=6.0 Hz, 3H)。
(4)O-[2-(4-氯苯氧基)异丙基]-2-丙酮肟(4)的合成
在三口瓶中加入丙酮肟2.06 g(28.18 mmol)和无水DMF 10 mL,搅拌使其溶解;分次加入NaH 0.94 g,加毕,反应1 h。缓慢滴加3 5.25 g(25.59 mmol),反应10 h(TLC检测)。用水(3×30 mL)洗涤,用无水硫酸钠干燥,浓缩后经硅胶柱层析(洗脱剂:A=1 ∶30)纯化得淡黄色液体4 4.00 g,产率65%;1HNMRδ: 7.26(d,J=8.7 Hz, 2H), 6.92(d,J=8.7 Hz, 2H), 4.70~4.55(m, 1H), 4.00(qd,J=11.6 Hz, 5.4 Hz, 2H), 1.69(d,J=43.6 Hz, 6H), 1.19(d,J=6.3 Hz, 3H);13C NMRδ: 157.24, 155.11, 129.39, 124.52, 117.92, 75.78, 72.96, 21.45, 16.97, 15.57。
(5) 5的合成
在圆底烧瓶中加入4 4.00 g(16.44 mmol)和浓HCl 2.5 mL,搅拌下于80 ℃反应6 h(TLC检测)。减压蒸除溶剂,析出晶体,用混合溶剂[V(甲醇) ∶V(CH2Cl2)=1 ∶8] 20 mL重结晶得白色晶体5 1.76 g,产率45%;13C NMR: 157.59, 129.42, 124.52, 117.17, 75.41, 64.98, 15.59; ESI-MSm/z: {[M+H]+}202.0。
(6) 7的合成
在三口烧瓶中加入5 1.76 g(7.42 mmol),用12%NaOH溶液调至pH 8,加入6 1.90 g(7.02 mmol),反应至终点(TLC检测)。用乙酸乙酯萃取,有机相经硅胶柱层析(洗脱剂:A=1 ∶35)纯化得7 2.41 g,产率72%;1H NMRδ: 7.27~7.22(d,J=8.9 Hz, 2H), 6.97~6.89(d,J=8.9 Hz, 2H), 4.70~4.58(m, 1H), 4.14~3.84(m, 3H), 2.79(dd,J=14.0 Hz, 7.0 Hz, 1H), 2.50~2.12(m, 6H), 1.92(d,J=28.2 Hz, 1H), 1.83~1.38(m, 4H), 1.22~1.12(m, 8H), 0.96(dt,J=14.9 Hz, 7.2 Hz, 1H), 0.78(t,J=7.6 Hz, 2H);13C NMRδ: 170.87, 159.01, 157.23, 155.47, 129.71, 124.52, 118.27, 111.29, 76.04, 72.96, 60.48, 42.31, 36.42, 30.66, 23.56, 21.78, 21.17, 16.95, 15.83, 14.53, 10.22; ESI-MSm/z: 454.1{[M+H]+}, 476.1{[M+Na]+}, 492.1{[M+K]+}; Anal.calcd for C23H32NO4SCl: C 60.90, H 7.13, N 3.08, S 7.05; found C 60.88, H 7.28, N 3.10, S 7.06。
2结果与讨论
2.1合成
合成1时,以DMF为溶剂,不加KI,产率较低,其可能原因为:酚羟基氧原子上的电子分散在苯环上,亲核性较弱,不易发生成醚反应。加入KI,氯代物碳原子的正电性增强,酚盐负离子易发生取代反应。
合成2时,THF使用前需进行无水处理(加Na过夜,1%CaH回流4 h,重蒸)。2后处理时容易吸附。用饱和硫酸钠溶液猝灭反应比NaOH溶液更容易处理,经多次萃取即可减少吸附。
合成3时,必须使用吡啶催化,其原因在于:醇与亚硫酰氯反应生成过渡态氯代亚硫酸酯,性质较稳定,产率很低。加入弱亲核试剂(如吡啶)可与氯代亚硫酸酯和生成的氯化氢反应成盐,利于反应进行。实验结果表明:吡啶催化效果优于DMF和三乙胺。
1~4均为液体,纯度均较高(>90%), 5可通过重结晶提纯。反应路线操作方便,后处理简单。
2.2表征
由2的IR分析可见,3 400 cm-1处特征峰为羟基吸收峰,1 596, 1 489, 1 450 cm-1处特征峰为苯环伸缩振动吸收峰。由7的1H NMR分析可见,δ7.27~7.22和δ6.97~6.89处吸收峰为苯环氢特征峰,δ4.14~3.84处吸收峰为1,2-H特征峰。由7的13C NMR分析可见,δ170.87处吸收峰为3-C特征峰,δ129.71, 124.52, 118.27, 111.29为苯环碳特征峰。由7的ESI-MS分析可见,454.1为{[M+H]+}峰,476.1为{[M+Na]+}峰,492.1为{[M+K]+}峰。
参考文献
[1]Wtueg G, Quadranti M, Zoschke A. Herbicide research and development:Challenges and opportunities[J].European Weed Research Society Weed Research,2007,47:271-275.
[2]刘长令. 国内外新农药品种的研究进展[J].农化新世纪,2008,7:18-20.
[3]Zhang M H, Gao S, Zhang Z J. Performance of the cyclohexanedione herbicide market[J].Agrochemicals,2012,51(2):79-89.
[4]Wang S, Zhang R Q, Ye F. Research developments on acetyl-coacarboxylase inhibitors[J].Pesticide Science and Administration,2003,24(10):26-32.
[5]王恒亮,吴仁海,职倩倩,等. 除草剂作用机制研究进展[J].河南农业科学,2013,12:11-15.
[6]Tong L. Acetyl-coenzyme a carboxylase:Crucial metabolic enzyme and attractive target for drug discovery[J].Cellular and Molecular Life Sciences,2005,(16):1784-1803.
[7]张静. 我国除草剂的登记现状及其发展趋势分析[D].保定:河北农业大学,2013.
[8]张一宾. 环己烯酮类除草剂的品种、市场及发展[J].世界农药,2011,06:26-28.
[9]成四喜,李海屏,刘尚钟,等. 世界农药新化合物研发的现状与发展趋势[J].农药研究与应用,2008,05:7-9.
[10]王芳. 除草剂烯草酮的合成研究[D].长春:吉林大学,2006.
[11]孙洪涛,刘长令. 水田除草剂环苯草酮[J].农药,2005,12:558-573.
[12]逯州,侯志广,王岩,等. 吡喃草酮在不同类型土壤环境中降解行为[J].农药,2010,05:353-355.
[13]唐韵. 除草剂最新品种介绍[J].农药市场信息,2012,22:36.
[14]Li Z G, Lin J. Recent advances in cyclohexadiones herbicide[J].Agrochemicals,2010,07:478-499.
[15]UIf M, Meyer N, Kast J,etal. Cyclohexenone oxime ethers,their preparation,intermediates for their preparation and their use as herbicides:US 5 228 896(A)[P].1993.
Synthesis of A Novel Cyclohexanedione Derivative
WANG Yu-ting1,WANG Xian-quan2,ZHANG Li1,TU Hong1,>LI Kai2,YIN Zhen-dong1,CHEN He-ju1,OUYANG Gui-ping1*
(1. Center for Research and Development of Fine Chemicals, Guizhou University, Guiyang 550025, China 2. Shandong Cynda Chemical Co., LTD., Jinan 250000, China)
Abstract:Herbicidal activity structure of profoxydim oxime-ether was introduced by modifying the oxime-ether structure of clethodim, according to the active-group combination principle. O-[2-(4-chlorophenoxy)propyl]-hydroxylamine hydrochloride(5)was obtained by substitution, reduction, halogenation, oxime etherification and hydrolysis, using p-chlorophenol as starting materials. A novel cyclohexanediones derivative was designed and synthesized by the reaction of 5 with 5-[2-(ethylthio)proplyl]-3-hydroxy-2-propionyl-2-cyclohexen-1-one. The structure was characterized by1H NMR,13C NMR, IR, ESI-MS and elemental analysis.
Keywords:clethodim; oxime ether; cyclohexanedione; active-group combination principle; synthesis
收稿日期:2016-01-04
基金项目:企业委托“药物创制研究开发”项目(H140192)
作者简介:王玉婷(1990-),女,汉族,山西运城人,硕士研究生,主要从事新型除草剂的设计与合成研究。 E-mail: 1096039689@qq.com通信联系人: 欧阳贵平,教授, E-mail: oygp710@163.com
中图分类号:O621.3
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.16017

