左旋组氨酸对匹罗卡品致痫大鼠海马区神经肽Y表达和神经细胞凋亡影响的实验研究*
翟 煜,霍小林,王永利
(1.天津医科大学基础医学院生理学与病理生理学系,天津 300070 2.中国科学院电工研究所,北京 100000 3.天津医科大学总医院神经外科,天津 300070)
左旋组氨酸对匹罗卡品致痫大鼠海马区神经肽Y表达和神经细胞凋亡影响的实验研究*
翟 煜1,霍小林2,王永利3**
(1.天津医科大学基础医学院生理学与病理生理学系,天津 300070 2.中国科学院电工研究所,北京 100000 3.天津医科大学总医院神经外科,天津 300070)
摘 要:目的:实验研究左旋组氨酸对匹罗卡品致痫大鼠海马区神经肽Y表达和神经细胞凋亡影响。方法:统计分析60只Ⅱ级健康纯系雄性SD大鼠的相关资料。结果:研究组和对照组大鼠建模成功率78.3%(18/ 23)、77.3%(17/ 22)之间的差异无统计学意义(P>0.05);研究组大鼠的潜伏期显著长于对照组(P<0.05),痫波频率低于对照组(P<0.05),大发作次数少于对照组(P<0.05),成功建模动物模型后1d、2d、3dCA1区、CA3区、齿状回神经肽Y阳性细胞计数均低于对照组(P<0.05),凋亡染色阳性细胞计数均显著低于对照组(P<0.05)。结论:左旋组氨酸能够有效降低匹罗卡品致痫大鼠海马区神经肽Y表达和神经细胞凋亡数值,具有抗痫作用。
关键词:左旋组氨酸; 匹罗卡品致痫大鼠; 海马区神经肽Y表达; 神经细胞凋亡
**通讯作者
为临床有效治疗癫痫提供科学依据,本研究对60只Ⅱ级健康纯系雄性SD大鼠的相关资料进行了统计分析,实验研究了左旋组氨酸对匹罗卡品致痫大鼠海马区神经肽Y表达和神经细胞凋亡影响,现报道如下。
1 材料与方法
1.1实验动物及分组:购买北京军事医学科学院实验动物中心提供的60只Ⅱ级健康纯系雄性SD大鼠,体重240~260g,平均体重为(250±10)g。所有大鼠均接受常规饲养、自由进食等。随机将这些大鼠分为研究组(n=30)和对照组(n = 30)两组。给予研究组匹罗卡品联合左旋组氨酸治疗,给予对照组单纯匹罗卡品治疗。给予两组腹腔注射350mg/ kg体重剂量匹罗卡品,以对颞叶癫痫模型进行诱导,依据Racine标准中动物行为特征分癫痫为5个级别,如果大鼠嘴部和面部运动具有节律性,代表为咀嚼、头部阵挛,则评定为Ⅰ级;如果大鼠点头,则评定为Ⅱ级;如果大鼠前肢出现阵挛现象,则评定为Ⅲ级;如果大鼠身体出现上举现象,则评定为Ⅳ级;如果大鼠身体出现上举伴跌倒现象,则评定为Ⅴ级。癫痫模型成功诱导标准为Ⅲ级以上,将没有达到标准的大鼠剔除,另行补充。
1.2方 法
1.2.1药品和试剂:购买Sigma公司生产的左旋组氨酸(L-His)、匹罗卡品(PLO)等,购买广州市鸿洲实验器材有限公司生产的磷酸盐缓冲液,购买德国宝灵曼公司生产的原位细胞凋亡检测试剂盒,购买天津市化学试剂厂生产的水合氯醛(AGAC)及分析纯。
1.2.2皮质脑电图检测:给予大鼠模型腹腔注射300mg/ kg水合氯醛进行麻醉,将脑电记录电极安置其中。固定后将骨孔从大鼠颅骨双侧额叶皮质、顶叶皮质相应部位打开,骨孔直径为1mm,将银、氯化银球形记录电极分别插入。在大鼠前卤后2mm安置参考电极。术后进行5d的休养,然后开始皮质脑电图检测。将记录装置连接起来,对脑电路记录的正确可靠情况进行认真检查。给予对照组大鼠腹腔注射350mg/ kg匹罗卡品建模,然后对其2h皮质脑电图进行连续记录;给予干预组大鼠腹腔注射300mg/ kg左旋组氨酸,1h后给予其腹腔注射250mg/ kg匹罗卡品建模。将2h内皮质脑电图变化数据连续记录[1]。
1.2.3皮质脑电图分析指标:腹腔注射匹罗卡品到痫波首次出现的时间段为潜伏期。为时程为1min的脑电图中尖波/棘波数值计数,每隔12min 1次,2h共将采集10个数值,每分钟痫波频率即为该组数据平均数。大发作标准为连续痫波时间在10s以上,将数据详细记录,将每组数据平均值及标准差计算出来[2]。
1.2.4神经肽Y检测:应用链霉卵白素-过氧化物酶(Histontain-SP)试剂盒,运用第二代LAB-SA技术检测神经肽Y。运用亲和纯化的二抗和Histontain-SP轭合物对已经在组织细胞抗原上结合的一抗进行检测,通过酶催化底物对所形成的抗原/抗体/酶复合物进行反映,从而将抗原的位置及分布确定下来[3~5]。
1.2.5病理组织取材方法:成功建模动物模型后1d、2d、3d将每组10只建模大鼠分别抽取出来,给予其腹腔注射350mg/ kg水合氯醛试液进行麻醉,开胸在4℃的环境下行升主动脉灌流250mL 4%多聚甲醛+250mL生理盐水。取出脑,将其固定在4%多聚甲醛溶液中。将海马取出来,将最大剖面冠状切开,将厚度为6μm的石蜡切片制备出来,进行细胞凋亡染色,染色过程中严格依据凋亡检测试剂盒设计程序进行[6]。
1.2.6凋亡染色分析:凋亡细胞的细胞核在凋亡染色后的颜色为棕色或棕褐色,光学显微镜下对CA1区、CA3区、齿状回进行观察,高倍视野(10×20)下将6个区域从130μm×130μm网格中随机选取出来,区域面积为0.0169m2,计数神经肽Y阳性细胞数及染色凋亡的阳性细胞,对颗粒细胞层NPY阳性反应密度比值进行检测,检测过程中用图像分析系统,将每组数据平均值及标准差值计算出来。
1.3统计学分析:用软件SPSS20.0对数据进行统计分析,用(±s)表示实验数据,单因素用方差分析(One -Way ANOVA),检验水准α=0.05。
2 结 果
2.1两组大鼠建模成功情况比较:研究组和对照组大鼠建模成功率78.3%(18/23)、77.3%(17/22)之间的差异不显著(P>0.05),具体见表1。
2.2两组潜伏期、痫波频率及大发作次数比较:研究组大鼠的潜伏期显著长于对照组(P<0.05),痫波频率显著低于对照组(P<0.05),大发作次数显著少于对照组(P<0.05),具体见表2。

表1 两组大鼠建模成功情况比较n(%)
2.3两组大鼠各时间点海马各区神经肽Y阳性细胞计数变化情况比较:研究组大鼠成功建模动物模型后1d、2d、3d CA1区、CA3区、齿状回神经肽Y阳性细胞计数均显著低于对照组(P<0.05),具体见表3。
表2 两组潜伏期、痫波频率及大发作次数比较(±s)

表2 两组潜伏期、痫波频率及大发作次数比较(±s)
注:与对照组比较,*P<0.05
组别 只数 潜伏期(s)痫波频率( / min)大发作次数(次)研究组 30 475±112.5* 136.7±24.6* 21.8±3.56*对照组 30 117.6±37.13 386.68±60.38 94.2±23.2
表3 两组大鼠各时间点海马各区神经肽Y阳性细胞计数变化情况比较(个,±s)
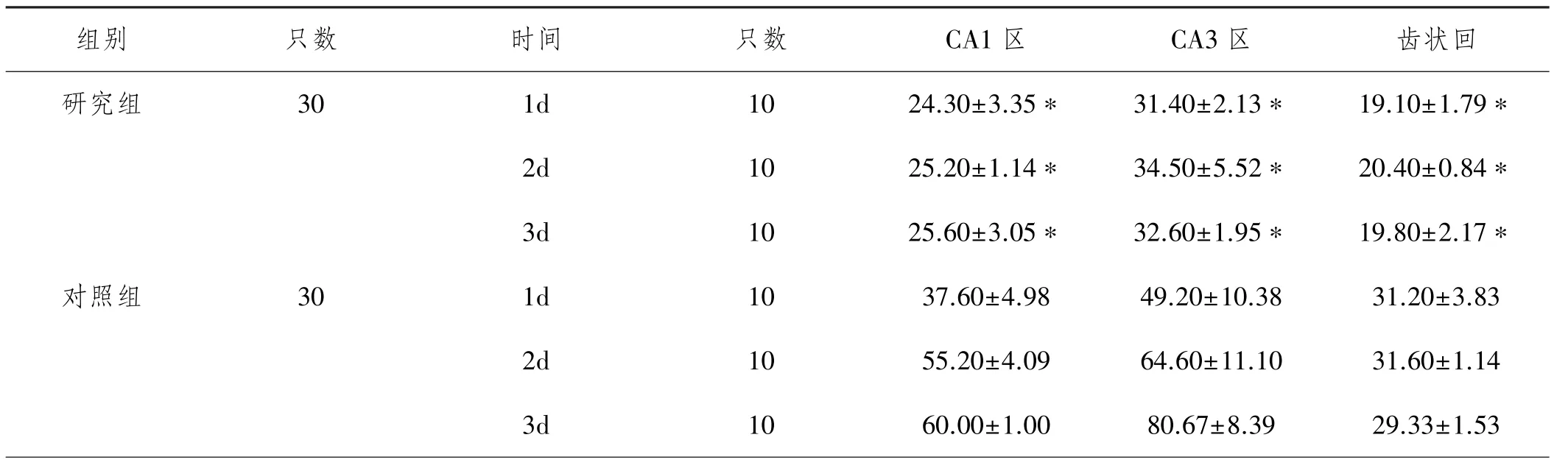
表3 两组大鼠各时间点海马各区神经肽Y阳性细胞计数变化情况比较(个,±s)
注:与对照组比较,*P<0.05
组别 只数 时间 只数 CA1区 CA3区 齿状回研究组 30 1d 10 24.30±3.35* 31.40±2.13* 19.10±1.79* 2d 10 25.20±1.14* 34.50±5.52* 20.40±0.84* 3d 10 25.60±3.05* 32.60±1.95* 19.80±2.17*对照组 30 1d 10 37.60±4.98 49.20±10.38 31.20±3.83 2d 10 55.20±4.09 64.60±11.10 31.60±1.14 3d 10 60.00±1.00 80.67±8.39 29.33±1.53
2.4两组大鼠各时间点海马各区凋亡染色阳性细胞计数变化情况比较:研究组大鼠成功建模动物模型后1d、2d、3dCA1区、CA3区、齿状回凋亡染色阳性细胞计数均显著低于对照组(P<0.05),见表4。
表4 两组大鼠各时间点海马各区凋亡染色阳性细胞计数变化情况比较(个,±s)
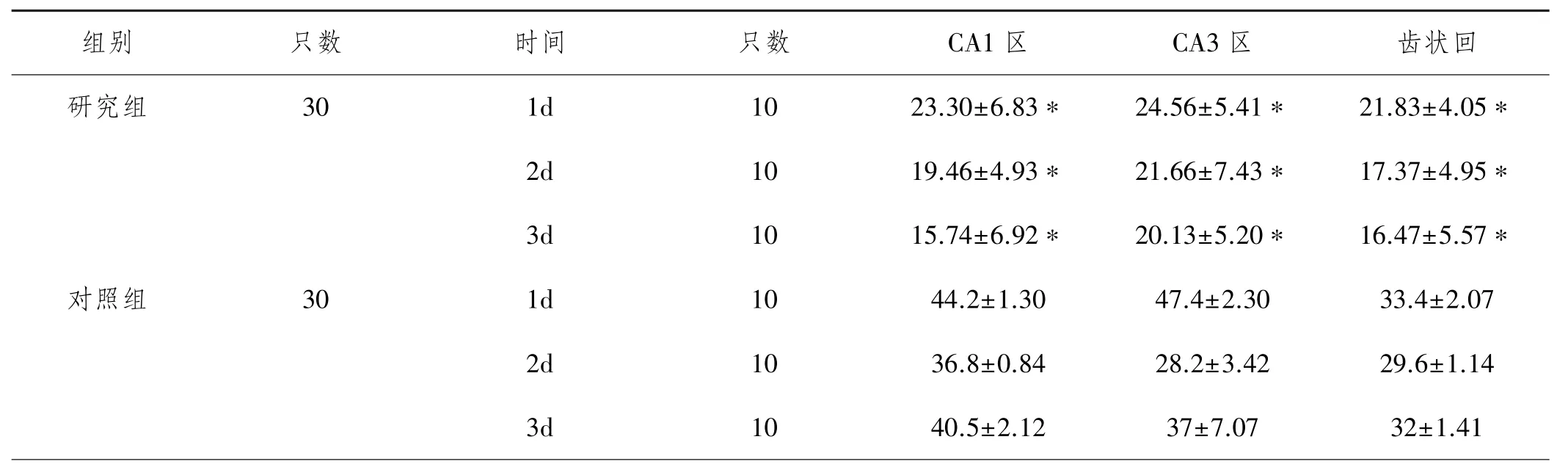
表4 两组大鼠各时间点海马各区凋亡染色阳性细胞计数变化情况比较(个,±s)
注:与对照组比较,*P<0.05
组别 只数 时间 只数 CA1区 CA3区 齿状回研究组 30 1d 10 23.30±6.83* 24.56±5.41* 21.83±4.05* 2d 10 19.46±4.93* 21.66±7.43* 17.37±4.95* 3d 10 15.74±6.92* 20.13±5.20* 16.47±5.57*对照组 30 1d 10 44.2±1.30 47.4±2.30 33.4±2.07 2d 10 36.8±0.84 28.2±3.42 29.6±1.14 3d 10 40.5±2.12 37±7.07 32±1.41
3 讨 论
本研究结果表明,研究组和对照组大鼠建模成功率78.3%(18/23)、77.3%(17/22)之间的差异不显著(P>0.05);研究组大鼠的潜伏期显著长于对照组(P<0.05),痫波频率显著低于对照组(P<0.05),大发作次数显著少于对照组(P<0.05),成功建模动物模型后1d、2d、3d CA1区、CA3区、齿状回神经肽Y阳性细胞计数均显著低于对照组(P<0.05),凋亡染色阳性细胞计数均显著低于对照组(P<0.05),充分说明了左旋组氨酸能够有效降低匹罗卡品致痫大鼠海马区神经肽Y表达和神经细胞凋亡数值,同时显著延长大鼠的潜伏期,降低大鼠的痫波频率,减少大鼠的大发作次数,具有抗痫作用,值得临床推广。
参考文献:
[1] 葛宇星.ClC-2对慢性颞叶癫痫大鼠海马CA1区α5亚基-GABA_AR介导紧张性抑制的影响[D].复旦大学,2012.
[2] 程蕊.NAP对匹鲁卡品致痫大鼠海马神经元的保护作用[D].山东大学,2012.
[3] 张帆.重组腺相关病毒神经肽Y基因转染对海人酸致痫大鼠海马突触重建的影响及其机制研究[D].河北医科大学,2013.
[4] 董长征.重组腺相关病毒神经肽Y基因转染对红藻氨酸致痫大鼠癫痫发作的影响及其机制探讨[D].河北医科大学,2013.
[5] 孟春想.柴胡皂苷a对难治性癫痫大鼠痫性发作及P-GP表达的影响[D].南方医科大学,2012.
[6] 黄彦思,林云宾,冯婉萍,等.癫痫儿童智能和适应能力分析及抗癫痫药物治疗的影响[J].河北医学,2015,20(8): 1390~1394.
Experimental Study of Influences of L-histidine in Y Neuropeptide Expression on the Hippocampus and Neuronal Apoptosis of Pilocarpine-induced Seizures Rats
ZHAI Yu,HUO Xiaolin,WANG Yongli
(Physiology and Pathophysiology Department of Basic Medical Faculty,Tianjin Medical University,Tianjin 300070,China)
Abstract:Objective: To experimentally study the influences of L-histidine on Y neuropeptide expression in the hippocampus and neuronal apoptosis of pilocarpine-induced seizures rats. Method: The relevant information of 60 cases of Class II healthy pure male SD rats were statistically analyzed. Result: The difference of modeling success rate between the study group and the control group was not significant (P>0.05);The latency of the study group was significantly longer than that of the control group ( P<0.05),epilepsy wave frequency was significantly lower (P<0.05),the large number of attacks was significantly lower (P<0.05),the modeled after successful animal model of 1d,2d,3d CA1 area,CA3 region,tooth Neuropeptide Y-shaped back positive cell counts were significantly lower (P<0.05),the apoptosis staining positive cell counts were significantly lower than those of the control group (P<0.05). Conclusion: L-histidine can ef-book=2,ebook=6fectively reduce the L-histidine in Y neuropeptide expression in the hippocampus and neuronal apoptosis value of pilocarpine-induced seizures rats,it has anti-epileptic effect.
Key words:L-histidine; Pilocarpine-induced seizures rats; Y neuropeptide expression in the hippocampus; Neuronal apoptosis
文献标识码:A
doi:10.3969/ j.issn.1006-6233.2016.01.001
文章编号:1006-6233(2016)01-0001-04
*基金项目:国家自然科学基金,(编号:50307013)

