缓释硫化氢供体对小鼠脑缺血急性期保护作用实验研究*
苏州大学神经科学研究所(苏州215123)
徐英秀 肖蕴祺 贾 佳▲
缓释硫化氢供体对小鼠脑缺血急性期保护作用实验研究*
苏州大学神经科学研究所(苏州215123)
徐英秀肖蕴祺贾佳▲
摘要目的:探讨缓释硫化氢缓释供体对小鼠脑缺血再灌注损伤的影响。方法:采用线栓法建立小鼠局灶性脑缺血模型,将雄性 ICR 小鼠随机分为假手术组(Sham)、溶剂对照组(Veh)和缓释硫化氢缓释供体ADT-OH 组。缺血再灌24h取脑组织,利用TTC染色法检测小鼠脑梗死体积;通过实时定量 PCR (qPCR)检测组织中炎症因子。结果:TTC染色结果显示,与Veh相比,ADT-OH能够显著降低脑缺血再灌注后大脑皮层、内囊以及大脑半球的梗死体积;qPCR 结果显示,与 Sham 组相比,Veh 组小鼠的缺血皮层组织中促炎因子iNOS、 IL-1β、TNF-α和IL-6 的表达水平明显升高;与 Veh 相比,ADT-OH显著降低促炎因子表达。结论:硫化氢缓释供体对急性期脑缺血损伤具有一定的保护作用,机制可能与抑制脑缺血损伤诱导的炎症反应相关。
主题词硫化氢@供体脑缺血/病理生理学再灌注损伤炎症介导素类小鼠
脑卒中可分为缺血性脑卒中和出血性脑卒中两种类型,其中约 80%以上是缺血性脑卒中。缺血性脑卒中是因为脑部动脉供血区的血流栓塞或出血而暂时或永久地减少导致的脑组织缺血。对于脑缺血的治疗,目前唯一有效手段是在病发3h内给予组织纤溶酶原激活物(Recombinant tissue plasminogen activator, rtPA),降低神经功能损伤。然而,这种治疗手段存在很大的风险,首先,rtPA有可能会造成患者脑出血。其次,大部分病人并不能在病发3h内接受rtPA的治疗。因此,对于此病的治疗和预防各国都在积极研究寻找有效的药物。
硫化氢(H2S)是一种具有臭鸡蛋气味的气体,一直被认为是一种有害气体,由血中进入机体细胞后,硫化氢和细胞呼吸酶结合,并因此阻断细胞内呼吸,使中枢神经细胞以及敏感的呼吸中枢细胞受损,同时硫化氢在短时间内的浓度猛增会有致死作用。然而,上世纪80年代末人们检测到在生理状态下脑组织中存在一定量的H2S,并且对机体发挥重要作用。 H2S与多种神经系统疾病都有着密切的关系,在肝脏等多种器官的缺血-再灌注损伤中具有保护作用[1-3]。但目前关于硫化氢供体在脑缺血模型中的研究较少。
最近,有研究表明H2S可以抑制LPS诱导的中枢神经炎症[4]。然而在小鼠急性期脑缺血再灌注损伤时H2S如何发挥作用及其是否对炎性细胞因子的调节作用尚不清楚。因此,本研究应用小鼠脑缺血模型,分别观察脑缺血损伤后给予H2S缓释供体ADT-OH对脑组织中炎症因子iNOS、IL-1β、TNF-α、IL-6表达的影响,从炎症反应角度探讨H2S在小鼠急性期脑缺血中的作用。
资料与方法
1材料清洁级ICR小鼠(上海斯莱克公司);5-对羟基苯基-1, 2-二硫杂环戊烯-3-硫酮(ADT-OH)(苏州大学药化实验室);TTC(美国 Sigma 公司);RNAiso Plus(宝生物工程有限公司);cDNA逆转录试剂盒及SYBR Green I购自美国Invitrogen公司。
2方法
2.1小鼠局暂性大脑中动脉栓塞(tMCAO)模型建立:将小鼠腹腔注射水合氯醛(10g/ml),使其完全麻醉;将小鼠固定在手术台上腹部向上,在显微镜下,打开颈部,钝性分离颌下腺,从小鼠右边气管处分离出颈总动脉,用缝合线轻微扎住。然后,继续向头部分离,分离到颈总动脉分叉处,将颈外动脉分离,用缝合线扎紧,电凝烧断颈外动脉分支。同时扎紧颈总动脉。随后,将颈外动脉用缝合线拉紧,在靠近结扎处,剪一小口,插入线拴,缓缓前进至颈内动脉并沿入颅骨方向推进,同时观察血流仪数值,当数值突降约至基值30%,停止插栓,用缝合线将线拴系紧,然后将小鼠缝合。手术过程中,加热灯保持温度(37℃±0.5℃)。小鼠缺血1h后,拔出线栓,回复血流,实现再灌注。假手术组不插入线栓,其余操作与手术组相同。
2.2实验分组:小鼠缺血再灌注3h后随机分组,经腹腔注射给予ADT-OH(50 mg/kg)或溶剂对照组(Veh )。再灌注24h取组织进行TTC染色或检测炎症因子的表达。
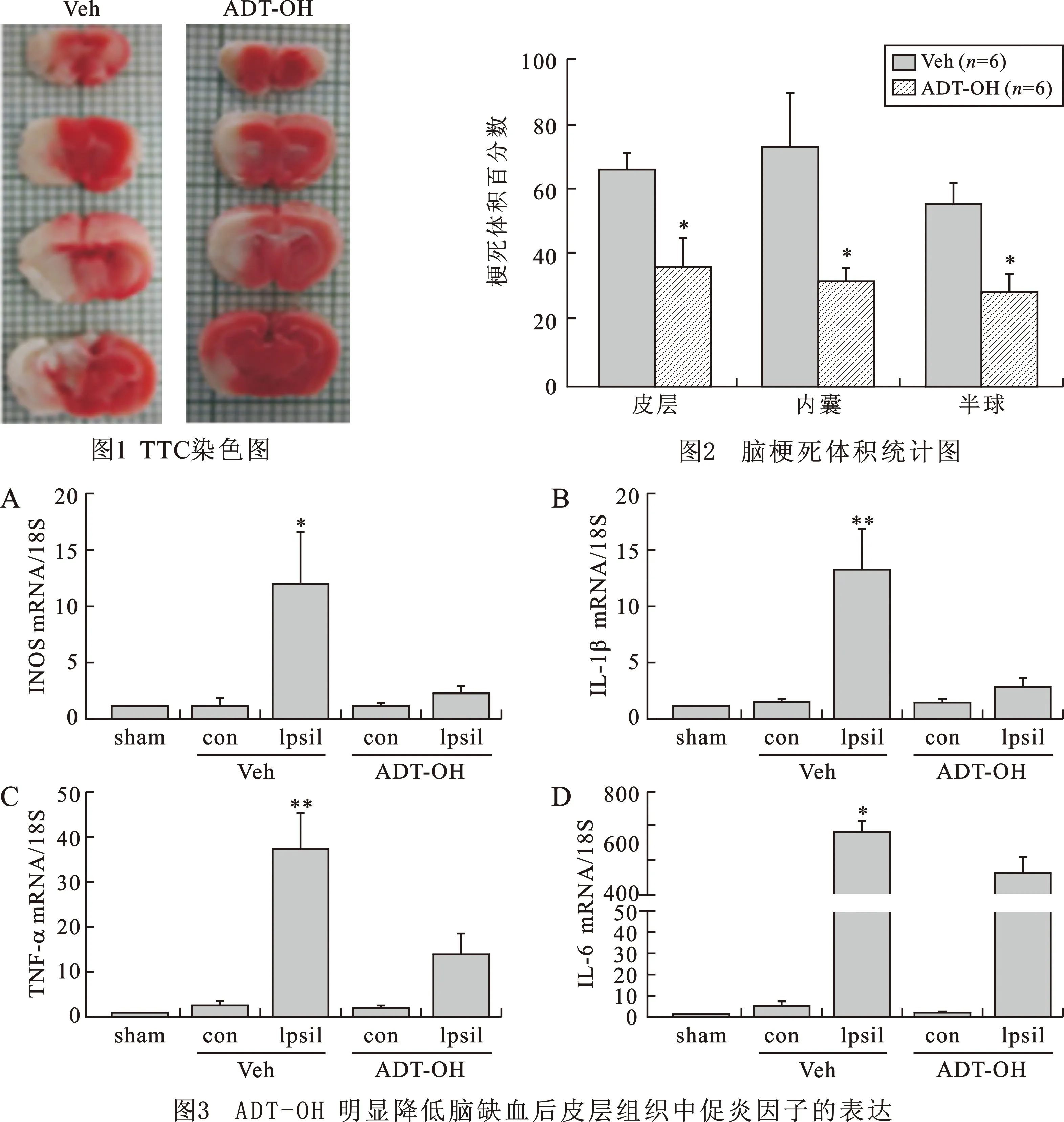
2.3TTC染色:将小鼠脱臼处死,小心取出完整的脑,并将脑切成 2 mm厚的切片,置于 1%的 2,3,5-三苯基氯化四氮唑(TTC)中,37℃恒温水浴,5 min后,去除 TTC 染色剂,并用干净的吸水纸吸取脑切片表面的水分。将染好脑片倒入10%的多聚甲醛溶液,淹没切片为宜,固定 24 h后,拍取照片,用图像分析软件统计分析梗死体积(正常脑组织染为红色,梗死脑组织染为白色)。
2.4实时荧光定量PCR(Real-time Quantitative PCR, qPCR):于-80℃取出脑组织样本,立即加入适量RNAiso Plus(根据组织大小估量),用研磨棒快速反复研磨匀浆,室温静置 5min,移至高速冷冻离心机,配平,4℃ 12000rPm 离心 5min,谨慎吸取上清液,移入新 1.5ml EP 管中(切勿吸取沉淀),按照RNA抽提试剂盒的操作提取总RNA,采用NanoDrop检测RNA含量,按照逆转录试剂盒操作说明于 PCR仪上反转录合成 cDNA(25℃ 10min,37℃ 120min,85℃ 5s,4℃ ∞)。在ABI 7500 PCR 仪上进行PCR扩增。PCR 扩增后进行溶解曲线观察分析非特异性扩增和引物二聚体是否存在,Ct 值用 2∧-△△Ct法计算基因表达量差异,以 18S 为参照基因。引物序列见表1。
2.5统计学方法:采用SPSS 13.0统计学软件定量实验数据采用均数±标准差表示,两独立组间比较采用t检验,多组间用one-way Anova检验。P<0.05 为差异有统计学意义。
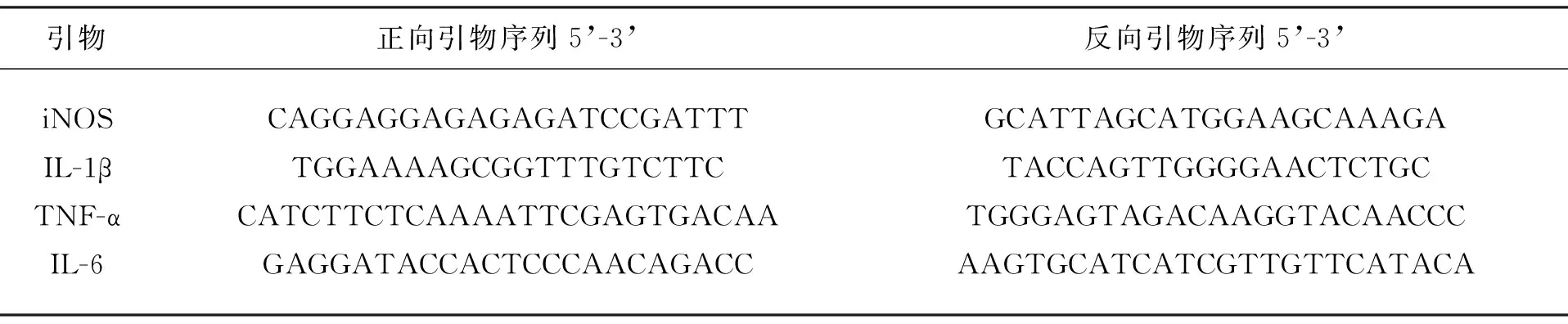
表1 引物序列表
结果
1ADT-OH 处理减少缺血后的脑梗死体积缺血再灌注 3 h后给予ADT-OH(50mg/kg)处理,再灌注 24 h后收取脑组织,进行 TTC 染色(图1),结果与溶剂对照组(Veh)相比,ADT-OH处理组(ADT-OH)梗死体积明显减少。溶剂对照组(Veh)皮层、内囊、半球梗死体积分别为 66.0±6.9%、64.0±25.2%、60.0±9.3%;ADT-OH组皮层、内囊、半球梗死体积分别为38.5±12.8%、35.1±5.6%、31.0±8.5%。结果显示(图2):ADT-OH 可明显降低皮层、内囊和半球的梗死体积(*P<0.05);与溶剂对照组(Veh)相比,ADT-OH处理组(ADT-OH)的皮层、内囊和半球的梗死体积百分率明显降低(*P<0.05)。
2ADT-OH 明显降低脑缺血后皮层组织中促炎因子的表达已有文献表明急性期脑缺血再灌注损伤会诱导大量促炎症因子释放,进一步加剧脑组织损伤,而促炎因子iNOS、TNF-α、IL-1β和IL-6都被证明与脑缺血中脑组织损伤相关。因此,本实验通过Real-time PCR检测iNOS、IL-1β、TNF-α和IL-6的mRNA水平,验证是否ADT-OH对脑缺血损伤的保护作用是通过抑制上述促炎因子表达而实现的。本实验中我们造小鼠大脑中动脉阻塞(MCAO),小鼠缺血再灌注3h通过腹腔注射ADT-OH和Veh(对照),再灌注24h提取RNA。结果显示(图3):与假手术(sham)组相比,Veh 组小鼠的缺血皮层组脑组织中促炎因子(iNOS、IL-1β、TNF-α、IL-6)的表达显著升高(*P< 0.05,**P<0.01),与注射veh的缺血侧相比, ADT-OH组缺血侧促炎因子表达明显降低(*P< 0.05,**P<0.01)。提示在小鼠脑缺血模型中ADT-OH能够抑制脑缺血再灌注引起的中枢神经炎症 。
讨论
硫化氢和NO、CO同属于“气体递质”家族,它在不同组织和器官中都具有重要的生理作用,H2S能影响神经突触传递,增强海马长时程记忆,并影响胶质细胞和周围细胞的信号传递,氧化应激而产生的内源性H2S还具有重要的抗氧化功能。H2S对于调节神经功能活性,抵制大脑缺血性损伤都有一定作用。然而,硫化氢在脑卒中方面的研究却一直存在争议,有文献报道在全脑大鼠脑缺血再灌注模型中发现,在脑缺血再灌注12h大鼠前脑皮质组织中H2S含量显著升高,而再灌注24h检测H2S含量明显下降[5],脑缺血早期(12h)产生较高水平的H2S,其原因可能是机体对神经元兴奋性作出的一种反应。再灌注24h大鼠脑组织H2S水平出现下降可能与H2S发挥清除自由基抗氧化等消耗有关。Ren[6]等在脑缺血再灌注模型中发现当给予25μmol/kg NaHS可抑制脑缺血引起的神经元损伤,而当给予180μmol/kg NaHS则加剧神经元损伤。究其原因,可能主要是在此研究中采用的是无机硫化氢供体NaHS,低浓度的无机供体是有神经保护作用的,但如果无机供体迅速释放大量的硫化氢则会产生神经毒性[7]。有机的硫化氢供体,可以缓慢且持久的释放硫化氢,其效果更优于普通的无机硫化氢供体。因此,在本研究中我们利用缓释硫化氢供体(ADT-OH),在小鼠脑缺血再灌注3h腹腔注射ADT-OH(50mg/kg)缓慢释放H2S,使脑内硫化氢含量维持正常的生理水平,再灌注24h收取脑组织。结果显示,ADT-OH能够降低脑缺血再灌注引起的皮层、内囊以及半球的梗死体积。qPCR检测显示,ADT-OH明显降低缺血侧促炎因子(iNOS /IL-1β、TNF-α、IL-6)的表达,进而抑制中枢神经炎症。
本研究表明,ADT-OH能够降低脑缺血再灌注后脑梗死体积,对脑缺血急性期损伤具有一定保护作用。ADT-OH能够抑制脑缺血后急性期促炎因子的表达,进而抑制中枢神经炎症,但具体机制尚不明确有待深入研究。这些结果提示硫化氢缓释供体可能通过抑制中枢神经炎症发挥对急性期脑缺血损伤的保护作用。
参考文献
[1] Bos EM,Wang R, Snijder PM,etal. Cystathionine gamma-lyase protects against renal ischemia/reperfusion by modulating oxidative stress [J]. J Am Soc Nephrol, 2013, 24(5): 759-770.
[2] Elrod JW, Calvert JW,Morrison J,etal. Hydrogen sulfide attenuates myocardial ischemia-reperfusion injury by preservation of mitochondrial function[J]. Proc Natl Acad Sci USA ,2007, 104(39): 15560-15565.
[3]Hunter JP,Hosgood SA,Patel M,etal. Effects of hydrogen sulphide in an experimental model of renal ischaemia-reperfusion injury [J]. Br J Surg, 2012,99(12): 1665-1671.
[4]Zhou X, Cao Y, Ao G,etal. Ca MKKβ-dependent activation of AMP-activated kinase is critical to suppressive effects of hydrogen sulfide on neuroinflammation [J]. Antioxid Redox Signal, 2014, 21(12):1741-1758.
[5]任彩丽, 李东亮, 赵红岗,等.全脑缺血-再灌注大鼠脑组织内源性硫化氢的动态变化[J].中华脑血管病杂志,2008,5(4):177-180.
[6]Ren C, Du A, Li D,etal. Dynamic change of hydrogen sulfide during global cerebral ischemia-reperfusion and its effect in rats[J].Brain Res,2010,1245:197-205.
[7]Li GF, Luo HK, Li LF,etal. Dual effects of hydrogen sulphide on focal cerebral ischaemic injury via modulation of oxidative stress-induced apoptosis[J]. Clin Exp Pharmacol Physiol, 2012, 39(9): 765-771.
(收稿:2015-06-02)
The Protective effects of a slow-releasing hydrogen sulfide donor to mice acute ischemia
Institute of Neuroscience, Suzhou University (Suzhou 215123)
Xu YingxiuXiao YunqiJia Jia
ABSTRACTObjective: To investigate the effects of the slow-releasing hydrogen sulfide donor ADT-OH in mice cerebral ischemic reperfusion injury. Methods: The mice focal cerebral ischemia model was found through MCAO and the male ICR mice were randomly divided into Sham, Veh, and slow-releasing hydrogen sulfide donor ADT-OH group. After 24 hours' ischemic reperfusion, the brain tissue was got out and the mice's brain infarct volumes were assessed with triphenyltetrazolium chloride (TTC) staining. The expression of inflammatory factors in tissue was detected by qPCR. Results: The TTC manifested that compared to Veh, the ADT-OH could significantly reduce the cerebral infarct volume of the pallium, internal capsule and cerebral hemisphere after the ischemic reperfusion. The qPCR shown that compared to Sham, the expression level of proinflammatory factors like iNOS, IL-1β, TNF-α and IL-6 in the ischemic cortex in Veh was significantly increased; while compared to Veh, ADT-OH reduced the expression of proinflammatory factors significantly. Conclusion: ADT-OH exerted protective effects to acute cerebral ischemic reperfusion injury. The underlying mechanism may be related to the inflammatory reaction which induced by the inhibition of cerebral ischemia.
KEY WORDSHydrogen sulfide@DonorsBrain ischemia/physiopathologyReperfusion injuryInlammation mediatorsMice
通讯作者:▲苏州大学药学院
【中图分类号】R363
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.03.001
·论著·基础研究·
*国家自然科学基金资助项目(81371278)

