克罗恩病并发腹腔肿瘤1例报道
曹 瑛,潘良盈,张 哲,赵 丽,巩 丽,赵曙光
第四军医大学唐都医院消化内科,陕西 西安 710038
克罗恩病并发腹腔肿瘤1例报道
曹 瑛,潘良盈,张 哲,赵 丽,巩 丽,赵曙光
第四军医大学唐都医院消化内科,陕西 西安 710038
克罗恩病(Crohn’s disease,CD)并发腹腔肿瘤的临床报道不多,本文介绍1 例患者的病例资料并进行文献复习。当CD患者症状诱导缓解后再次出现症状加重,除考虑原有治疗失效外,应考虑是否合并腹腔肿瘤。
克罗恩病;腹腔肿瘤
病例 患者,男,70岁,间断性上腹胀痛伴恶心、呕吐1年入院。1年前,患者无诱因出现间断性上腹胀痛,进食后加重,无放射痛,伴恶心、呕吐,呕吐物为胃内容物,无咖啡样物质,非喷射状,无发热、黄疸、腹泻等症状。胃镜检查示糜烂性胃炎,病理示胃窦中度萎缩性胃炎,对症治疗效果不佳。1个月后就诊于唐都医院和西京医院,腹部CT示胃窦体部改变,考虑胃癌,两次胃镜示胃窦体黏膜皱襞粗大,表面粗糙、僵硬,活检质硬,诊断为胃体病变性质待定。超声内镜示胃壁显著增厚,结构层次消失,呈低回声改变,以黏膜下层为著,胃壁周围未见明显肿大淋巴结。考虑:胃淋巴瘤?胃弥漫浸润型癌? 病理为胃体黏膜重度慢性炎,查见异型增生,诊断恶性标准不足,故给予对症支持治疗,症状无明显缓解,体质量下降5 kg,大小便正常。入院前复查胃镜考虑皮革胃,病理示胃窦体中-重度萎缩性胃炎,不除外恶变。腹部增强CT示胃底、胃体及胃窦壁不规则增厚,考虑占位性病变。门诊以“胃癌?”收入院。既往史:原发性高血压病5年,最高170/120 mmHg,口服药物治疗,血压控制良好。
入院查体:上腹部压痛,余(-)。腹部B超示胃壁弥漫性增厚,较厚处1.5 cm,提示胃癌。血尿粪常规、肝肾功、电解质、肿瘤标志物(CEA、CA199、CA125、CA153)均无异常。两次胃镜检查示胃体、胃窦黏膜肥厚粗大,腔狭窄,镜身通过幽门受限,考虑慢性肥厚性胃炎,行深挖活检,病理均提示黏膜中度慢性萎缩性炎伴纤维肉芽组织增生(见图1A~B)。两次肠镜检查示病变呈节段性分布,距肛缘19 cm至肛管密布铺路石样黏膜隆起,表面充血,腔狭窄,壁僵硬,活检质硬,横结肠近肝曲铺路石样隆起,表面充血,腔狭窄,镜身无法通过,活检质硬,考虑克罗恩病(Crohn’s disease, CD);病理:(直肠)黏膜组织慢性炎伴间质散在嗜酸性细胞浸润,(横结肠)黏膜组织慢性炎(见图1C~D)。风湿三项(ASL、RF、CRP)、补体系列、免疫球蛋白、抗双链DNA滴度、自免肝抗原谱、自身抗体ANA谱、血常规、PCT、结核抗体定性、T-spot(-)。ESR 8 mm/h。胸腹部CT:左肺炎症,双肺下叶坠积性改变,食管全段扩张,胃壁及升结肠、结肠肝区改变(见图2A~B)。PET-CT:胃体及幽门胃壁弥漫性增厚,未见葡萄糖异常高代谢;食管胸段管径增宽;升结肠及回盲部管腔钡剂残留(见图3)。按照WHO推荐的CD诊断标准[1],拟诊CD(A3,L2+L4,B2,中度活动期),CDAI评分为6分,分别于0、2、6周按5 mg/kg,300 mg/次剂量给予英夫利西单抗(Infliximab, IFX)治疗,患者症状明显缓解,CDAI评分由6分减为3分。期间因前列腺增生行手术治疗。
4个月后,患者上腹胀痛较前加重,食欲减退,排便排气减少,解少量稀糊便,体质量下降。查体:腹膨隆,腹壁硬,右下腹近腹股沟区可触及条索状物,质韧,基底粘连,与局部皮肤无粘连,移动性浊音阳性。腹部B超:大量腹水。腹水检测:渗出液。粪常规:转铁蛋白阳性。腹水CEA 287 ng/ml。腹部平片:上腹肠管扩张,多个短小气液平。腹部CT:胃壁增厚情况较前无明显变化,直肠管壁均匀增厚,结肠管壁结构显示不清,大量腹水(见图2C~D)。小肠成像提示:腹腔大量积液,膀胱前上方弥漫软组织影,大小网膜多发软组织结节影,大网膜处融合呈饼状,侵及右半横结肠致肠壁增厚,肠腔狭窄,上述改变多考虑为恶性;胃体底壁弥漫性增厚,黏膜强化,炎性可能性大;直肠、乙状结肠下段肠壁炎性增厚,黏膜强化,回肠末端肠壁炎性增厚。遂行腹腔镜检查:腹腔内大量淡黄色稍浑浊液体,共吸出5 000 ml,部分小肠粘连成团,网膜及肠系膜组织挛缩融合成团;肠壁、胃壁及网膜组织水肿明显;肝脏、壁层腹膜、肠壁及网膜组织可见大量散在灰白色结节。术中诊断:腹腔肿瘤。病理:肠系膜送检少许脂肪及纤维结缔组织内查见极少许散在变性的异型细胞,组织学特点及免疫学表型特征符合低分化腺癌(见图4)。
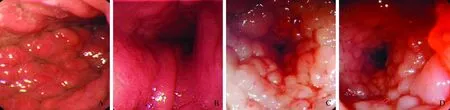
图1 内镜检查结果 胃体(A)和胃窦(B)黏膜皱襞粗大,表面粗糙、僵硬,管腔狭窄;直肠(C)和横结肠(D)密布铺路石样黏膜隆起,表面充血,腔狭窄,管壁僵硬,管腔狭窄
Fig 1 Endoscope findings The mucosal folds of the gastric body (A) and the antrum (B) were thicken with rough and stiff surface, and the lumens were stricture; rectum (C) and transverse colon (D) were covered with diffuse mucosal granularity with congestion surface, stiff wall and stricture lumen
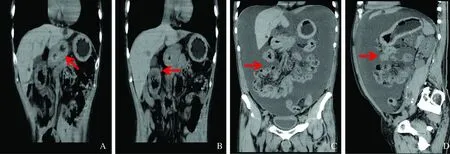
图2 腹部CT结果 A~B:胃壁、升结肠和结肠肝曲管壁增厚;C~D:肠道管壁增厚,大量腹水
Fig 2 Abdominal CT findings A~B: the thicken walls of stomach, ascending colon and hepatic flexure of colon; C~D: the intestinal wall thickening and massive ascites
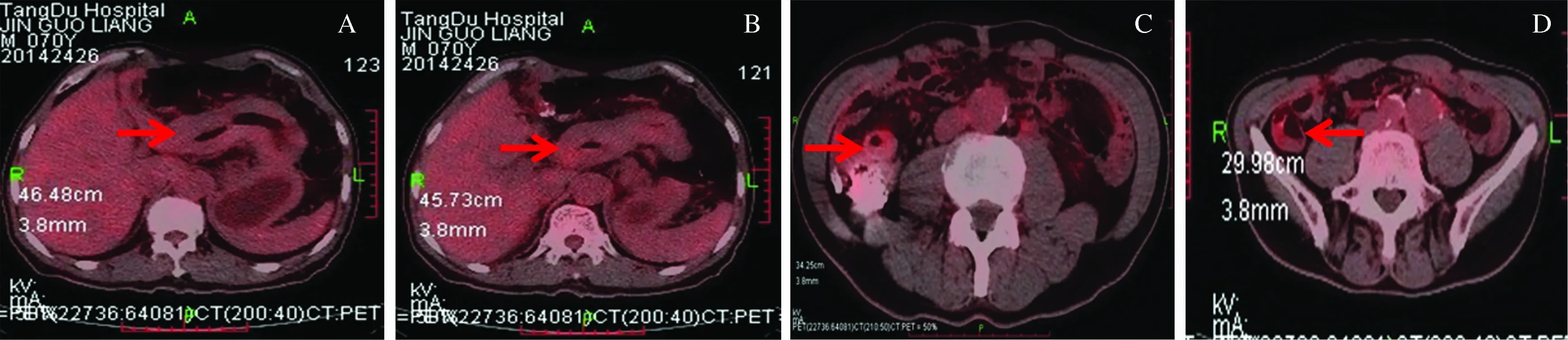
图3 PET/CT结果 胃体(A)和胃窦(B)黏膜弥漫性增厚,未见异常葡萄糖高代谢;升结肠(C)和回盲部(D)管壁增厚,管腔钡剂残留
Fig 3 PET/CT findings The walls of gastric body (A) and antrum (B) were diffuse thickening without abnormaly high glucose metabolism; the walls of ascending colon (C) and ileocecal region (D) were thickening with residue barium agent in lumens
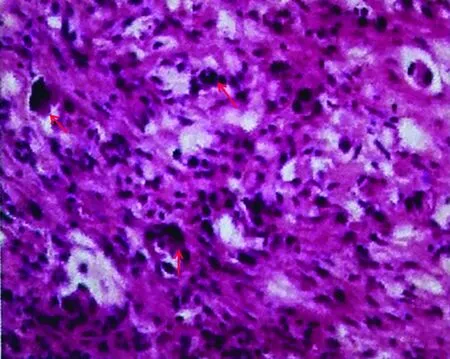
图4 腹膜病理(200×) (肠系膜)查见少许散在变性的异型细胞,组织学特点和免疫学表型特征符合低分化腺癌(红色箭头所指为异型细胞)
Fig 4 Peritoneal pathological findings (200×) A few scattered denatured atypical cells were found in mesenteric, and the features of histology and immunological phenotype were consistent with poorly differentiated adenocarcinoma (red arrow indicated the denatured atypical cells)
讨论 CD是一种慢性非特异性肉芽肿性炎症,可累及消化道任何部位,呈非连续性分布,最常累及部位为末端回肠、结肠和肛周[1]。CD临床表现多样,腹泻、腹痛和体质量减轻是CD最常见的临床表现。CD的诊断缺乏金标准,需结合临床表现、内镜、影像学和病理组织学进行综合分析并随访观察。CD最常发生于青年期,好发年龄为18~35岁,男性略多于女性。50~60岁以上患者占CD患者总数的5%~30%,因其临床表现缺乏特异性,给疾病的诊断和治疗带来困难[2]。研究[3]显示老年CD临床表现以腹痛、腹泻、发热、腹部包块、消瘦等为主。肠外表现以口腔溃疡为主,病变部位以末端回肠和回结肠为主,较少并发肛周病变。病变类型以狭窄型和穿透型为主,营养状况普遍较好。本例患者为老年男性,消化道表现仅为上腹胀痛,无腹泻、血便,全身表现无发热、贫血,仅表现为食欲不振、体质量减轻,无肠外表现和并发症。病变部位为上消化道和回结肠。由于该患者主要表现为上腹胀痛,而无腹泻、腹部包块等症状,忽视了肠道筛查,发病1年内虽多次反复胃镜检查,却无法对疾病做出诊断。提示CD临床表现缺乏特异性,对于胃镜检查发现的黏膜皱襞增厚,而活检无恶性证据的患者,除常规考虑弥漫浸润型胃癌及淋巴瘤等常见疾病外,应及早进行肠道CD筛查。
CD治疗效果个体差异较大,对于有2个或以上高危因素的患者宜开始治疗时就给予早期积极治疗。目前较为认同的预测“病情难以控制”的高危因素包括:合并肛周病变、广泛性病变(病变累及肠段累计>100 cm)、食管胃十二指肠病变、发病年龄轻、首次发病即需要激素治疗等。所谓早期积极治疗就是不必经过“升阶治疗”阶段,活动期诱导缓解的治疗一开始就予更强的药物。主要包括两种选择:一是激素联合免疫抑制,或是直接予以IFX(单独用或与AZA联用)。该患者具有两个以上高危因素,给予3次IFX诱导治疗后,症状缓解, CDAI降低3分,提示治疗有效。因此,应用IFX早期积极治疗是CD活动期缓解的有效手段。
随访4个月后患者出现大量腹水,CT成像考虑腹腔恶性占位性病变。腹腔镜探查及病理结果证实为腹膜低分化腺癌。既往研究[4-10]发现长期使用IFX可能使患者罹患非何杰金氏淋巴瘤的风险增加,但此部分患者往往在生物治疗前均已接受免疫调节剂治疗,该患者病理明确诊断为低分化腺癌,与文献[4-7]报道IFX可能诱发肿瘤类型不一致,提示腹腔肿瘤的发生与使用IFX无关。那么是否存在另一种可能,发病即为胃癌,后来发生的腹腔肿瘤即为胃癌的转移病灶。入院时多种影像学、病理及肿瘤标志物检查均不支持胃癌,且多种证据表明为节段性病变,故可能性较小。因此,考虑该患者腹膜腺癌为新发疾病。
CD患者常合并结直肠癌(colorectal cancer, CRC)、小肠癌、肠外肿瘤、淋巴瘤和皮肤癌,总体上肿瘤发病率低于普通人群,但小肠癌、结肠癌和皮肤癌发病率增高[4, 11-17]。流行病学研究[11]表明,CD患者肠道癌变的相对危险度较普通人群高15~20倍,UC和CD患者CRC的发生率接近[14]。CD患者CRC的总发生率为2.5%,如果为结肠CD则增加为5.6%,累及回结肠者CRC相对危险度为3.2,仅累及小肠者CRC风险并未增加[15]。结肠CD患者CRC相对风险增加也被另一荟萃分析[16]证实,CD患者结肠癌的相对危险度为2.5,其中结肠病变和回肠病变的相对危险度分别为4.5和1.1,确诊10年后2.9%的患者发生CRC,小肠癌的相对危险度为33.2,30年后相对危险依然没有降低。无论CD累及部位如何,确诊10年、20年、30年后CRC的累积风险分别为2.9%、5.6%和8.3%。纳入34项研究共计60 122例CD患者的荟萃分析[17]表明,与普通人群相比,CD患者发生小肠癌、CRC、肠外肿瘤及淋巴瘤的相对危险度分别为28.40、2.40、1.27和1.42。亚组分析发现,CD患者发生结肠癌的危险度明显升高,相对危险度为2.59,而直肠癌相对危险度并未升高。对9 100例IBD患者进行了5年随访,其中133例患者共发现肿瘤145例,但其总发病率低于对照组,但非黑色素瘤皮肤癌和小肠癌的发病风险显著增加,非黑色素皮肤癌相对危险度为3.85,小肠癌相对危险度为3.70[18]。因此,CD患者CRC、小肠癌、皮肤癌的风险显著增加,肠镜筛查和减少日照是减轻肿瘤发生的重要途径[12,17]。
确诊癌症IBD患者继续使用甲氨蝶呤、硫嘌呤和TNF-α单克隆抗体的免疫抑制剂并不增加癌症新发和原有癌症恶化的风险[18]。对528例儿童患者随访了9 516患者年,证实TNF-α单克隆抗体治疗的儿童IBD患者其淋巴瘤发生率并不高于其他药物治疗的患者,也不高于TNF-α单克隆抗体治疗的成人患者[6]。对6 273例CD患者5年随访[8]显示,接受IFX治疗和其他免疫调节剂治疗者,其实体瘤、淋巴瘤和非黑色素皮肤癌总体发病率接近。Beaugerie等[7]对17 047例 IBD患者进行随访,发现年龄、癌症史、免疫抑制剂使用史是新发癌症的独立危险因素。有癌症史IBD患者更易发生新的癌症,而不是之前癌症的复发。有癌症史IBD患者使用免疫抑制剂对新癌发生或旧癌复发的总体风险并无影响。一项包括41 176例IBD患者的随访5年的研究[4]表明,免疫调节剂增加了非黑色素瘤皮肤癌发病风险,但不增加淋巴瘤、黑色素瘤、CRC的风险。因此,对于CRC患者合并肿瘤,目前并不认为与治疗IBD使用的免疫调节剂相关。
老年CD临床表现缺乏特异性,诊断困难,对于不典型的上消化道症状,反复病理检查提示为炎症性病变,应注意进行CD筛查。当CD患者临床表现不能用CD进展来解释时,注意合并其他疾病,尤其是肿瘤。
[1]中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见[J]. 中华内科杂志, 2012, 51(10): 818-831. Inflammatory Bowel Disease Study Group of Digestive Disease Branch, the Chinese Medical Association. The diagnosis and treatment consensus of inflammatory bowel disease [J]. Chin J Intern Med, 2012, 51(10): 818-830.
[2]Grenth J, Torok HP, Koenig A, et al. Comparison of inflammatory bowel disease at younger and older age [J]. Eur J Med Res, 2004, 9(12): 552-554.
[3]吴茸, 郭振, 李毅, 等. 老年克罗恩病病人临床特征分析[J]. 肠外及肠内营养, 2014, 21(2): 69-71, 75. Wu R, Guo Z, Li Y, et al. Analysis of clinical characteristics of eldly patients with Crohn’s disease [J]. Parenteral and Enteral Nutrition, 2014, 21(2): 69-71, 75.
[4]Kopylov U, Vutcovici M, Kezouh A, et al. Risk of lymphoma, colorectal and skin cancer in patients with IBD treated with immunomodula
tors and biologics: a QUEBEC claims database study [J]. Inflamm Bowel Dis, 2015, 21(8): 1847-1853.
[5]Nieminen U, Färkkilä M. Malignancies in inflammatory bowel disease [J]. Scand J Gastroenterol, 2015, 50(1): 81-89.
[6]Dulai PS, Thompson KD, Blunt HB, et al. Risks of serious infection or lymphoma with anti-tumor necrosis factor therapy for pediatric inflammatory bowel disease: a systematic review [J]. Clin Gastroenterol Hepatol, 2014, 12(9): 1443-1451.
[7]Beaugerie L, Carrat F, Colombel JF, et al. Risk of new or recurrent cancer under immunosuppressive therapy in patients with IBD and previous cancer [J]. Gut, 2014, 63(9): 1416-1423.
[8]Lichtenstein GR, Feagan BG, Cohen RD, et al. Serious infection and mortality in patients with Crohn’s disease: more than 5 years of follow-up in the TREATTMregistry [J]. Am J Gastroenterol, 2012, 107(9): 1409-1422.
[9]Brown SL, Greene MH, Gershon SK, et al. Tumor necrosis factor antagonist therapy and lymphoma development: twenty-six cases reported to the Food and Drug Administration [J]. Arthritis Rheum, 2002, 46(12): 3151-3158.
[10]Deepak P, Sifuentes H, Sherid M, et al. T-cell non-Hodgkin’s lymphomas reported to the FDA AERS with tumor necrosis factor-alpha (TNF-α) inhibitors: results of the REFURBISH study [J]. Am J Gastroenterol, 2013, 108(1): 99-105.
[11]池肇春. 克罗恩病与肿瘤[J]. 中国医师进修杂志, 2007, 30(10C): 1-2. Chi ZC. Crohn’s disease and tumor [J]. Chin J Postgrad Med, 2007, 30(10C): 1-2.
[12]Wang ZH, Fang JY. Colorectal cancer in inflammatory bowel disease: epidemiology, pathogenesis and surveillance [J]. Gastrointest Tumors, 2014, 1(3): 146-154.
[13]Mooiweer E, van der Meulen-de Jong AE, Ponsioen CY, et al. Incidence of interval colorectal cancer among inflammatory bowel disease patients undergoing regular colonoscopic surveillance [J]. Clin Gastroenterol Hepatol, 2015, 13(9): 1656-1661.
[14]Lukas M. inflammatory bowel disease as a risk factor for colorectal cancer [J]. Dig Dis, 2010, 28(4-5): 619-624.
[15]Ekbom A, Helmick C, Zack M, et al. Increased risk of large-bowel cancer in Crohn’s disease with colonic involvement [J]. Lancet, 1990, 336(8711): 357-359.
[16]Canavan C, Abrams KR, Mayberry J. Meta-analysis: colorectal and small bowel cancer risk in patients with Crohn’s disease [J]. Aliment Pharmacol Ther, 2006, 23(8): 1097-1104.
[17]von Roon AC, Reese G, Teare J, et al. The risk of cancer in patients with Crohn’s disease [J]. Dis Colon Rectum, 2007, 50(6): 839-855.
[18]Algaba A, Guerra I, Marín-Jiménez I, et al. Incidence, management, and course of cancer in patients with inflammatory bowel disease [J]. J Crohns Colitis, 2015, 9(4): 326-333.
(责任编辑:陈香宇)
Crohn’s disease complicated with abdominal tumors: one case report
CAO Ying, PAN Liangying, ZHANG Zhe, ZHAO Li, GONG Li, ZHAO Shuguang
Department of Gastroenterology, Tangdu Hospital, the Fourth Military Medical University, Xi’an 710038, China
The clinical features of Crohn’s disease (CD) complicated with abdominal tumors have been seldom reported. The clinical data of one case was introduced and the relevant literatures were reviewed. If the abdominal symptoms of CD patients are worse again after remission induction with Infliximab treatment, it should be taken into account of the possibility of abdominal tumors in addition to consider the original treatment failure.
Crohn’s disease; Abdominal tumor
曹瑛,主治医师,研究方向:炎症性肠病。E-mail:mengnvhaiying@yeah.net
赵曙光,博士,副主任医师,硕士生导师,研究方向:非酒精性脂肪性肝病。E-mail:zsg1203@126.com
10.3969/j.issn.1006-5709.2016.08.026
个案报道
R574.62
B
1006-5709(2016)08-0929-04
2015-09-02

