STAT3和SOCS3蛋白在中耳胆脂瘤中的表达及意义
叶放蕾 李萌 李世超 王乐 赵堃 朱晓丹 张婷
·实验研究·
STAT3和SOCS3蛋白在中耳胆脂瘤中的表达及意义
叶放蕾1李萌1李世超1王乐1赵堃1朱晓丹1张婷1
【摘要】目的研究信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)和细胞因子信号抑制因子3(suppressor of cytokine signaling 3,SOCS3)在中耳胆脂瘤中的表达及意义。 方法采用免疫组织化学法检测30例中耳胆脂瘤标本与20例正常外耳道皮肤中STAT3及SOCS3蛋白的表达。 结果STAT3蛋白阳性表达定位于胞浆和胞核,其在中耳胆脂瘤上皮中阳性表达率为76.7%(23/30),高于正常外耳道皮肤组的25.0%(5/20),差异有统计学意义(P<0.05);SOCS3蛋白阳性表达主要定位于胞浆,其在中耳胆脂瘤上皮的阳性表达率为33.3%(10/30),低于正常外耳道皮肤组的65.0%(13/20),差异有统计学意义(P<0.05);在30例中耳胆脂瘤上皮组织中, STAT3与SOCS3蛋白的表达呈负相关(r=-0.476,P=0.008,P<0.05)。 结论STAT3和SOCS3蛋白在中耳胆脂瘤中的异常表达可能与中耳胆脂瘤上皮细胞的过度增殖和凋亡抑制相关,进而参与了胆脂瘤的发生发展。
【关键词】信号转导和转录激活因子3;细胞因子信号抑制因子3;胆脂瘤;中耳
中耳胆脂瘤以中耳腔内异常增殖、堆积的角化鳞状上皮和进行性骨质破坏为特征,但其发病机制至今尚未明确。上皮细胞异常增殖、凋亡和骨质破坏吸收是目前胆脂瘤发病机制的研究热点。Janus蛋白酪氨酸激酶/信号转导和转录激活因子(janus protein- tyrosine kinase/signal transducer and activator of transcription, JAK/STAT)是一条由细胞因子激活的信号通路,参与细胞增殖、分化、凋亡和免疫调节等生理过程,其负反馈调节主要由细胞因子信号抑制因子(suppressor of cytokine signaling,SOCS)介导[1]。STAT3和SOCS3分别是STATs和SOCSs家族的重要成员,研究发现多种肿瘤细胞中[2]均存在STAT3和SOCS3的异常表达,并对其发挥促增殖和抗凋亡的效应。为了解STAT3和SOCS3蛋白在中耳胆脂瘤中的表达,本研究拟采用免疫组织化学方法检测中耳胆脂瘤上皮中STAT3和SOCS3蛋白的表达,并分析两者之间的相关性,探讨它们在胆脂瘤发生发展中的作用。
1材料与方法
1.1标本的收集收集郑州大学第一附属医院耳鼻咽喉科2011年7月~2014年9月收治的中耳胆脂瘤患者手术清除的胆脂瘤标本30例(胆脂瘤组),其中男12例,女18例;年龄7~74岁,平均42.21±15.85岁,病程9个月~51年;全部患者术前临床诊断及术后病理诊断均为中耳胆脂瘤。同时收集其中20例患者术耳外耳道皮肤作为对照组(部分患者不同意取外耳道正常皮肤)。所有收集的标本均迅速固定后石蜡包埋备用。本研究通过郑州大学第一附属医院医学伦理委员会审批,并且所有患者均签署知情同意书。
1.2主要试剂鼠抗人STAT3单克隆抗体、鼠抗人SOCS3单克隆抗体均购自美国SANTA CRUZ公司;即用型SP免疫组化试剂盒。AEC染色剂、MPBS缓冲液粉剂、构椽酸缓冲液粉剂均购自北京鼎国昌盛生物科技公司。
1.3标本染色方法两组标本蜡块连续切片,行HE染色和免疫组化染色。步骤:石蜡切片脱蜡,充分水化后,PBS冲洗5 min,3次;柠檬酸抗原修复10 min,自然冷却;PBS浸泡5 min,3次;3%H2O2封闭内源性过氧化物酶,室温下孵育20 min;PBS浸泡5 min,3次;每张片子滴加山羊血清50 μl,室温条件下封闭内源性生物素20分钟;甩除勿洗,滴加一抗50 μl/片,4 ℃过夜;PBS浸泡5 min,3次;滴加二抗50 μl/片,37 ℃ 30分钟;PBS浸泡5 min,3次;滴加辣根酶标记卵霉链白素50 μl/片,37 ℃ 30分钟;PBS浸泡5 min,3次;DAB显色,显微镜下控制,蒸馏水中止;苏木素复染,梯度酒精脱水;二甲苯透明,中性树胶封片;显微镜观察和照相。用已知阳性片作阳性对照,用PBS缓冲液代替一抗作阴性对照,以排除非特异性着色。
1.4结果判定显微镜下观察STAT3及SOCS3有表达,以细胞核或细胞质着棕黄色者为阳性表达细胞。评分方法:先按染色程度计分,无染色0分,微弱棕黄色为1分,棕黄色2分,棕褐色3分;然后在400倍显微镜下随机选取5个不重叠的视野,每个视野计数100个细胞,按染色范围计分:无染色0分,<20%为1分,21%~50%为2分;>50%为3分。染色结果为染色程度和染色范围之和,0、1分为阴性,2分为弱阳性,3分为阳性,大于等于4分为强阳性。
1.5统计学方法采用SPSS21.0充计分析软件,STAT3、SOCS3在中耳胆脂瘤组及正常对照组之间阳性率比较采用χ2检验, STAT3、SOCS3在中耳胆脂瘤的相关分析采用Spearman等级相关检验。P<0.05为差异有统计学意义。
2结果
2.1HE染色结果中耳胆脂瘤组上皮细胞层数增多,鳞状上皮增生活跃,上皮内及上皮下有不同程度的炎性细胞增生,可见大量角质层;正常外耳道皮肤表皮由内至外由基底层、棘层、颗粒层、透明层、角质层构成,未见鳞状上皮增生活跃及角质层增多,上皮内及上皮下未见明显炎性细胞浸润(图1、2)。
2.2免疫组化染色结果
2.2.1STAT3在中耳胆脂瘤上皮和正常外耳道皮肤中的表达STAT3在中耳胆脂瘤上皮全层细胞的胞浆及胞核强阳性表达,颜色呈棕黄色,30例中有23例阳性,阳性率76.67%。阴性对照无染色。在正常外耳道皮肤中可见STAT3在基底细胞层胞浆少量表达,棘层及颗粒层未见表达,整体呈阴性或弱阳性表达,20例正常外耳道皮肤中,5例阳性表达,阳性率25.0%;STAT3在中耳胆脂瘤组的表达明显高于对照组,差异有统计学意义(P<0.05)(图3、4,表1)。

表1 STAT3在中耳胆脂瘤上皮和正常
注:*与对照组比较,χ2=19.431,P=0.000,P<0.05
2.2.2SOCS3在中耳胆脂瘤上皮和正常外耳道皮肤的表达SOCS3在正常外耳道皮肤全层细胞的胞浆表达,颜色呈棕黄色,20例正常外耳道皮肤组织中,13例阳性,阳性率65.0%。阴性对照无染色,SOCS3在中耳胆脂瘤上皮全层细胞呈弱阳性或阴性表达,30例中有10例阳性,阳性率33.33%。SOCS3在中耳胆脂瘤组织中的表达低于对照组,差异有统计学意义(P<0.05)(图5、6,表2)。
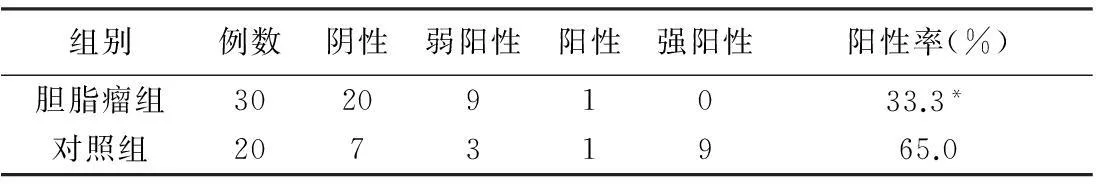
表2 SOCS3在中耳胆脂瘤上皮和正常外耳道皮肤的表达(例)
注:*与对照组比较,χ2=9.742,P=0.002,P<0.05
2.2.3STAT3、SOCS3在中耳胆脂瘤组织表达的相关性经Spearman等级相关检验,两因子在中耳胆脂瘤组织中的表达呈负相关,r=-0.476,P=0.008(P<0.05)(表3);而在正常外耳道皮肤中的表达不存在负相关。
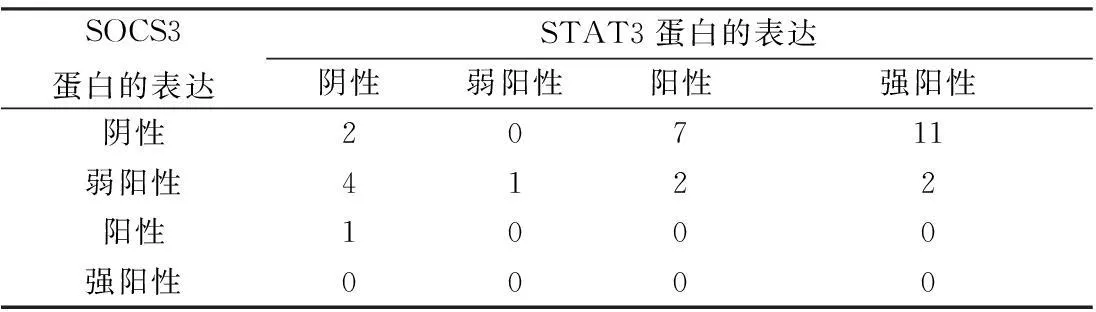
表3 中耳胆脂瘤组织中STAT3和SOCS3
注:STAT3和SOCS3蛋白在中耳胆脂瘤中的表达呈负相关,P<0.05


图1 正常外耳道皮肤染色(HE×400)
3讨论
目前,人们对中耳胆脂瘤发病机制的研究主要集中在上皮细胞异常增殖、凋亡和骨质破坏吸收三方面[3],但其具体机制尚未明确。大量关于胆脂瘤上皮细胞增殖和凋亡状态的研究显示,复层鳞状上皮的过度增殖可能参与了中耳胆脂瘤的发生发展。而关于其凋亡状态的研究仍存在分歧:一些学者认为胆脂瘤上皮细胞凋亡增加[4],进而导致中耳腔内角化鳞状上皮异常堆积;而新近的研究认为胆脂瘤上皮细胞的凋亡能力下降[5],即抗凋亡(anti-apoptosis);由于凋亡减少,细胞增殖大于凋亡,从而导致胆脂瘤上皮增生。本研究从细胞增殖和凋亡两方面研究STAT3和SOCS3蛋白在中耳胆脂瘤发生发展中的作用,从而进一步探讨中耳胆脂瘤的发病机制。
STAT蛋白是一种DNA 结合蛋白,激活后可转移至细胞核启动下游靶基因转录,现已发现7个STAT 家族的成员:STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6。STAT3是STATs家族的重要成员,在JAK/STAT信号通路中发挥重要作用,其功能结构主要包括:①SH2结构域;②SH3结构域;③酪氨酸磷酸化位点(Tyr 位点);④DNA结合区;⑤C末端、N末端[6]。细胞因子受体与磷酸化的酪氨酸残基结合并聚集STAT3,后者进而在JAKs 的作用下实现磷酸化成为具有转录因子活性的p-STAT3。两个P-STAT3分子形成同二聚体或异二聚体后,离开受体进入细胞核,通过与下游靶基因相应的启动子或特异性反应原件结合,诱导与细胞增殖、凋亡等相关的基因,如:c-Myc、 Bcl-2、CyclinD1、Bcl-xL、survivin等的表达[7]。本实验发现,STAT3在中耳胆脂瘤上皮呈阳性或强阳性表达,在正常外耳道皮肤呈阴性或弱阳性表达,STAT3蛋白在中耳胆脂瘤上皮的表达异常增高(P<0.05),由此推测STAT3在中耳胆脂瘤上皮细胞活化后,启动细胞增殖和凋亡等相关基因的转录,对细胞产生促增殖和抗凋亡效应。Friedland等[8]亦发现中耳胆脂瘤中存在IL-6受体IL-6R和gp130,且STAT3高表达与IL-6正相关,提示IL-6一方面上调STAT3蛋白表达,另一方面活化该蛋白发挥生物学作用,而STAT3的高表达和活化可能促进中耳胆脂瘤上皮细胞的过度增殖和凋亡抑制。
SOCS3蛋白作为SOCS家族的重要成员,参与JAK/STAT3信号通路的负反馈调节,其激活依赖转录因子pSTAT3的启动。SOCS3蛋白的分子结构主要包括氨基末端激酶抑制区域(kinase inhibitory region,KIR)、SH2机构域和羧基末端SOCS盒[9],其调控JAK/STAT3信号通路的可能机制包括:SOCS3可通过抑制JAK激酶的活性,阻断STAT3的磷酸化,减少pSTAT3进入细胞核,进而减少下游VEGF、CyclinD1、c-myc、Bcl-2等靶基因的转录[10];SOCS3分子上的SH2还可竞争性结合细胞因子受体上的磷酸化酪氨酸结合位点,直接阻碍STAT3磷酸化,进而阻碍信号通路的进一步转导等[11]。本研究证实,SOCS3在正常外耳道皮肤组织呈阳性或强阳性表达,在胆脂瘤上皮中少量表达,SOCS3蛋白在胆脂瘤组织中表达明显下调(P<0.05)。由此推测SOCS3蛋白在胆脂瘤上皮中的低表达,一方面抑制JAK激酶活性能力降低,促进STAT3蛋白活化;另一方面由于和细胞因子受体结合减少,增加了STAT3的活化,使活化STAT3进入细胞核的量增加,从而启动细胞增殖相关基因。
生理条件下,JAK/STAT信号通路的激活快速而短暂,并受到SOCS的精密负反馈调节,来维持内环境的稳态。在正常外耳道皮肤中,STAT3蛋白的表达增加及活化会相应地引起SOCS3蛋白的表达增多,受诱导表达的SOCS3再通过多种途径来抑制STAT3蛋白的表达及JAK/STAT通路的进一步活化,以维持外耳道皮肤正常的生理状态。但在病理条件下或SOCS表达下调时,JAK/STAT通路呈过度激活状态,引发相关疾病的发生发展[12]。研究表明,甲基化沉默SOCS3基因启动子,可使JAK/STAT3信号通路异常活化,促进肿瘤细胞增殖;而上调SOCS3蛋白表达水平,则可有效抑制JAK/STAT3信号通路,从而抑制肿瘤细胞增殖并诱导其凋亡[13]。本实验发现STAT3和SOCS3在中耳胆脂瘤上皮中的表达呈负相关,说明SOCS3蛋白的缺乏或减少引起STAT3持续过度活化,可能引起中耳胆脂瘤上皮细胞过度增殖和凋亡抑制,进而参与中耳胆脂瘤的发生发展。
综上所述,STAT3、SOCS3在中耳胆脂瘤上皮的异常表达,可能参与了中耳胆脂瘤上皮细胞的过度增殖和凋亡抑制,为进一步揭示中耳胆脂瘤的发病机制提供了依据;进一步明确STAT3在胆脂瘤发生发展中的下游调控基因,上调SOCS3蛋白的表达可能对中耳胆脂瘤的预防和治疗带来新思路。
4参考文献
1Tamiya T, Kashiwagi I, Takahashi R, et al. Suppressors of cytokine signaling (SOCS) proteins and JAK/STAT pathways: regulation of T-cell inflammation by SOCS1 and SOCS3[J]. Arterioscler Thromb Vasc Biol, 2011,31:980.
2Martha LS, Abbie L, Lisa MH, et al. Genetic variation in the JAK/STAT/SOCS signaling pathway influences breast cancer-specific mortality through interaction with cigarette smoking and use of aspirin/NSAIDs: The breast cancer health disparities study[J]. Breast Cancer Res Treat,2014,147: 145.
3潘松林,龚树生.中耳胆脂瘤发病机制研究进展[J].听力学及言语疾病杂志,2008,16:338.
4杨宁,蒋立新.凋亡抑制蛋白Livin及Survivin在中耳胆脂瘤上皮的表达及意义[J].听力学及言语疾病杂志,2011,19:356.
5Park HR, Min SK, Min K, et al. Increased expression of p63 and survivin in cholesteatomas[J]. Acta Otolaryngol,2009,129:268.
6Teramo A, Gattazzo C, Passeri F, et al. Intrinsic and extrinsic mechanisms contribute to maintain the JAK/STAT pathway aberrantly activated in T-type large granular lymphocyte leukemia[J]. Blood, 2013,121:3843.
7Kiu H, Nicholson SE. Biology and significance of the JAK/STAT signalling pathways[J]. Growth Factors, 2012,30:88.
8Friedland DR, Eernisse R, Erbe C, et al. Cholesteatoma growth and proliferation: posttranscriptional regulation by microRNA-21[J]. Otol Neurotol, 2009,30:998.
9Croker BA,Kiu H,Nicholson SE.SOCS regulation of the JAK/STAT signaling pathway[J].Semin Cell Dev Biol,2008,19:414.
10Krebs DL, Hilton DJ. SOCS proteins: negative regulators of cytokine signaling[J].Stem Cells,2001,19:378.
11Linossi EM, Nicholson SE. Kinase inhibition, competitive binding and proteasomal degradation: resolving the molecular function of the suppressor of cytokine signaling (SOCS) proteins[J]. Immunol Rev,2015 ,266:123.
12Niwa Y,Kanda H,Shinkauchi Y,et al.Methylation silencing of SOCS3 promotes cell growth and migration by enhancing JAK/STAT and FAK signaling in human hepatocellular carcinoma[J].Oncogene,2005,24:6406.
13Xiong H,Chen ZF,Liang QC,et al.Inhibition of DNA methyltransferase induces G2 cell cycle arrest and apoptosis in human colorectal cancer cells via inhibition of JAK2/STAT3/STAT5 signalling[J].J Cell Mol Med,2009,13:3668.
(2015-11-02收稿)
(本文编辑周涛)
网络出版时间:2016-4-2615:52
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20160426.1552.010.html
The Expression of STAT3 and SOCS3 Protein in the Middle Ear Cholesteatoma
Ye Fanglei, Li Meng, Li Shichao, Wang Le, Zhao Kun, Zhu Xiaodan, Zhang Ting
(Department of Otolaryngology, the First Hospital of Zhengzhou University, Zhengzhou, 450002, China)
【Abstract】ObjectiveTo study the expression of signal transducer and activator of transcription 3 (STAT3)and Suppressor of cytokine signaling 3(SOCS3) in the middle ear cholesteatoma epithelium ,and the possible roles of STAT3 and SOCS3 in middle ear cholesteatoma.MethodsThe immunohistochemical assay was used to detect expression of STAT3 and SOCS3 protein in 30 cases of middle ear cholesteatoma epithelial tissue and 20 cases of normal external auditory canal skin tissues as the control group.ResultsSTAT3 immunoreactivity was detected in the nuclei and cytoplasm of epithelial cells. The expression rates of STAT3 in middle ear cholesteatoma epithelial tissue were 76.7% and higher than in the normal epithelium (25.0%). The differences between the two groups were statistically significant (P<0.05). SOCS3 immunoreactivity was detected in the cytoplasm of epithelial cells. The expression rates of SOCS3 in middle ear cholesteatoma epithelial tissue were 33.3% and lower than in the normal epithelium (65.0%). The differences were statistically significant (P<0.05). The expression of STAT3 and SOCS3 in the middle ear cholesteatoma had negative correlation (r=- 0.476,P<0.05).ConclusionThe abnormal expression of STAT3 and SOCS3 in the middle ear cholesteatoma may be involved in hyper proliferation and anti-apoptosis of cholesteatoma cell, and play an important role in the formation and development of middle ear cholesteatoma.
【Key words】Signal transducer and activator of transcription 3(STAT3);Suppressor of cytokine signaling 3(SOCS3);Cholesteatoma;Middle ear
【中图分类号】R764.21
【文献标识码】A
【文章编号】1006-7299(2016)03-0265-04
DOI:10.3969/j.issn.1006-7299.2016.03.011
作者简介:叶放蕾,女,河南人,医学博士,主任医师,主要研究方向为耳显微外科、耳聋及耳鸣的防治。通讯作者:叶放蕾(Email:yefanglei000@sina.com)
1郑州大学第一附属医院耳鼻咽喉科(郑州450002)
——外耳道成形技术进展

