应用四条溶出曲线筛选厄贝沙坦片处方工艺
刘德智,李 鹏(浙江金立源药业有限公司,浙江 绍兴 312369)
应用四条溶出曲线筛选厄贝沙坦片处方工艺
刘德智,李鹏
(浙江金立源药业有限公司,浙江绍兴312369)
摘要:采用比较自研处方与参比制剂(亦称原研制剂)在水、醋酸盐缓冲液、盐酸、磷酸盐缓冲液中四条溶出曲线的f2因子,确定自研处方。通过调整厄贝沙坦片处方中辅料的含量,比较自制制剂(处方一~五)和参比制剂(批号:3A292)的f2因子,得到当处方中乳糖、微晶纤维素、交联羧甲基纤维素钠、羟丙基甲基纤维素、二氧化硅和硬脂酸镁含量分别为18.60%、14.34%、4.65%、1.16%、2.71%、0.39%时和参比制剂比较相似,工艺具有良好稳定性及重现性。
关键词:厄贝沙坦;处方工艺;溶出度评价
厄贝沙坦(Irbesartan)为法国赛诺菲圣德拉堡与百时美施贵宝公司共同开发成功的一种长效、非肽类选择性AT1受体拮抗剂,于1997年以片剂形式首次在英国和德国上市。2004年,在中国获准上市,商品名为安博维®(Aprovel®)。目前,厄贝沙坦已成为临床用一线降压药物,进入国家基本药物目录。我公司自主研发厄贝沙坦片(规格:0.15 g),并按照国内仿制药注册要求,采用四条溶出曲线[1]与原研制剂比较,确认该工艺处方制剂与安博维®在体外溶出行为基本一致。
1 仪器、试剂和试药
溶出仪:智能药物溶出仪RC-8MD(天津天大天发科技有限公司);紫外可见光分光光度计:紫外分光光度计UV-2600(日本岛津公司)。
纯化水;磷酸二氢钾,分析纯;氢氧化钠(片状),分析纯;三水醋酸钠,分析纯;冰醋酸;盐酸,分析纯。
厄贝沙坦(浙江金立源药业有限公司,批号:20140101);厄贝沙坦(工作对照品自制,浙江省食品药品检验研究院标化,批号20120801R);乳糖(荷兰DMV INTERNATIONAL,批号为F1312001);微晶纤维素(型号PH101,批号为F1408001)、交联羧甲基纤维素钠(批号为F1403001)、羟丙基甲基纤维素(批号为F1403001)、二氧化硅(批号为F1408001)、硬脂酸镁(批号为F1403001)、胃溶型薄膜包衣剂(型号YCW-C-020001,批号为F1408001)均为安徽山河药用辅料有限公司产品。
参比制剂:参照仿制药质量一致性评价-口服固体制剂参比制剂确立原则(草案)[2],选择原研制剂安博维®作为参比制剂,规格:0.15g,赛诺菲(杭州)制药有限公司进行分装。
2 制备工艺筛选
2.1处方前研究
本研究中确定研究剂型为片剂,规格为0.15 g。参阅安博维®RFDA说明书可以获知该制剂处方中辅料组成如下:乳糖、微晶纤维素、交联羧甲基纤维素钠、羟丙基甲基纤维素、二氧化硅和硬脂酸镁。依据制剂学知识,对上述辅料在该处方中作用分析如下:乳糖、微晶纤维素为填充剂、羟丙基甲基纤维素为粘合剂、二氧化硅和硬脂酸镁为助流剂和润滑剂[3]。
2.2自研处方设计
根据2.1项下的原研处方分析,设计自研处方,见表1,处方量为1000片。

表1 处方筛选1000片处方量/g
2.3制备工艺描述
(1)将原料厄贝沙坦用气流粉碎机粉碎成微粉(D90<7 μm),辅料乳糖、微晶纤维素、交联羧甲基纤维素钠分别过60目筛,二氧化硅和硬脂酸镁分别过100目筛,备用;(2)将羟丙基甲基纤维素,加纯化水配制成3%的溶液,作为粘合剂;(3)将厄贝沙坦、乳糖、微晶纤维素、交联羧甲基纤维素钠,混合均匀,加入黏合剂制软材,用18目筛制粒,在80℃~90℃下干燥,水分控制在4%以内,干颗粒用16目筛整粒,再加入二氧化硅和硬脂酸镁,混合均匀,压片、包衣即得。
3 溶出行为评价
根据口服固体制剂溶出度试验技术指导原则[4],的要求,仿制药需要在水、醋酸盐缓冲液、盐酸、磷酸盐缓冲液中的溶出行为与原研药品一致。因此自制制剂需在上述四种溶剂中与参比制剂考察溶出行为,分别计算相似因子[5],从而进行处方筛选。本次实验处方筛选,首先比较在水中的溶出曲线,合格后,再研究其他三种溶出介质的溶出曲线。采用中国药典2010年版附录X C第二法进行测定。
3.1自研处方和参比制剂在水溶液中溶出曲线比较
取自制处方中每个处方中5片和参比制剂1片,以水为溶出介质,分别在5 min、10 min、15 min、30 min、60 min、90 min、120 min、180 min、240 min、 360 min取样,计算各时间点的累积溶出度,并计算f2因子,结果见表2和图1。可见,处方五和参比制剂的f2因子为87.21大于50,溶出曲线与原研曲线相似度高,可以初步确定处方五和参比制剂相似。

表2 处方一~五和参比制剂在水中溶出度测定结果
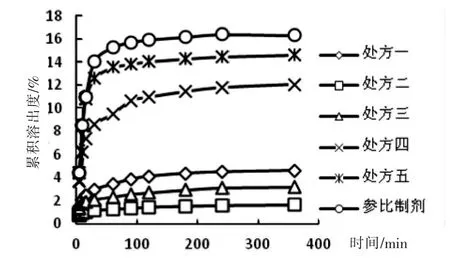
图1 处方一~五和参比制剂在水中溶出曲线图
3.2处方五和参比制剂在其它三种溶出介质中溶出曲线比较
(1)处方五和参比制剂在pH=1.0盐酸溶液中溶出曲线的比较
取处方五制备的5片,原研片1片,以pH= 1.0盐酸溶液为溶出介质,分别在5 min、10 min、15 min、20 min、30 min、45 min、60 min取样,计算各时间点的累积溶出度,结果见表3和图2,可见,处方五15 min的累积溶出度97.48,满足15 min累积溶出度大于85的要求。
(2)处方五和参比制剂在pH=4.5醋酸盐缓冲液中溶出曲线的比较
取处方五制备的5片,原研片1片,以pH=4.5醋酸盐缓冲液为溶出介质,分别在5 min、10 min、15 min、30 min、60 min、90 min、120 min、180 min、240 min、360 min取样,计算各时间点的累积溶出度,并计算f2因子,结果见表3和图3,可见,处方五和参比制剂f2因子为99.90,大于50,因此可以初步确定处方五和参比制剂在在pH=4.5醋酸盐缓冲液中溶出曲线相似。
(3)处方五和参比制剂在pH=6.8磷酸盐缓冲液中溶出曲线的比较。
取处方五制备的5片,原研片1片,以pH=6.8磷酸盐缓冲液为溶出介质,分别在5 min、10 min、15 min、20 min、30 min、60 min、90 min、120 min取样,计算各时间点的累积溶出度,结果见表3和图4,可见,处方五和参比制剂f2因子为79.65,大于50,因此可以初步确定处方五和参比制剂在pH=6.8磷酸盐缓冲液中溶出曲线相似。
(4)结论
综上所述,在水、pH=4.5醋酸盐缓冲液、pH= 6.8磷酸盐缓冲液中处方五和参比制剂的f2因子分别为87.21、99.90、79.65,均大于50,在pH=1.0盐酸溶液中满足15 min累积溶出度大于85的要求,因此可以初步确定处方五和参比制剂相似。
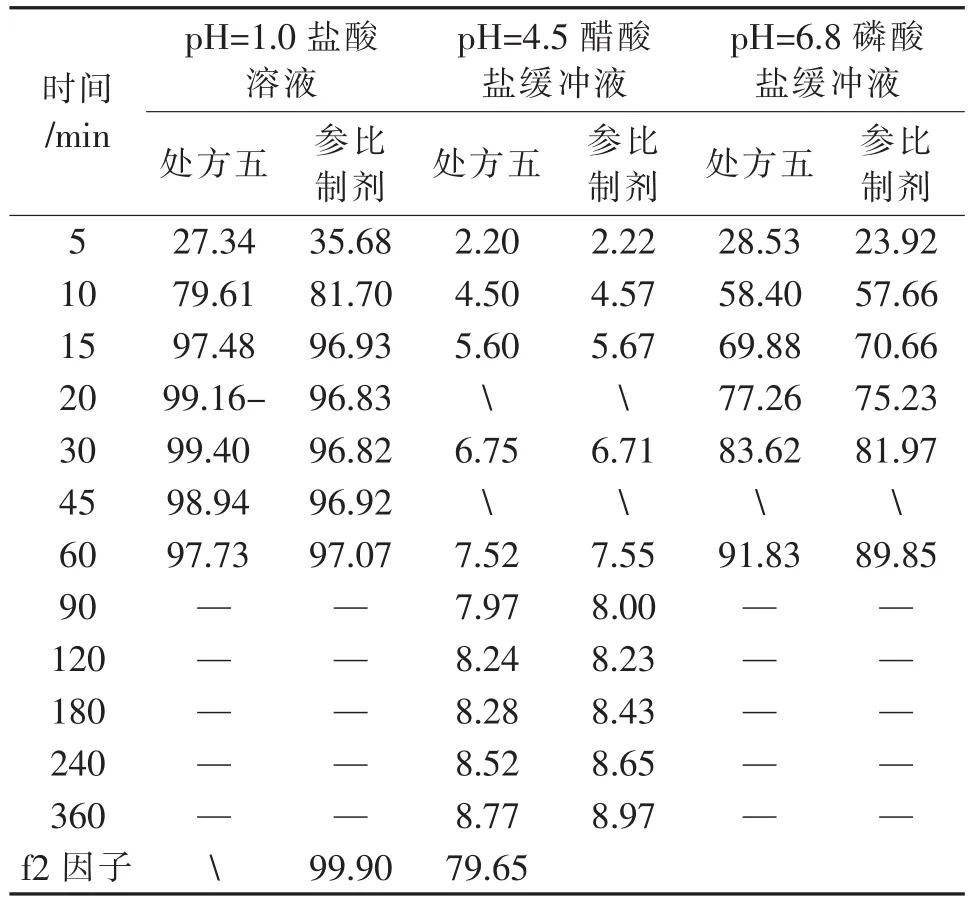
表3 不同溶出介质溶出度测定结果
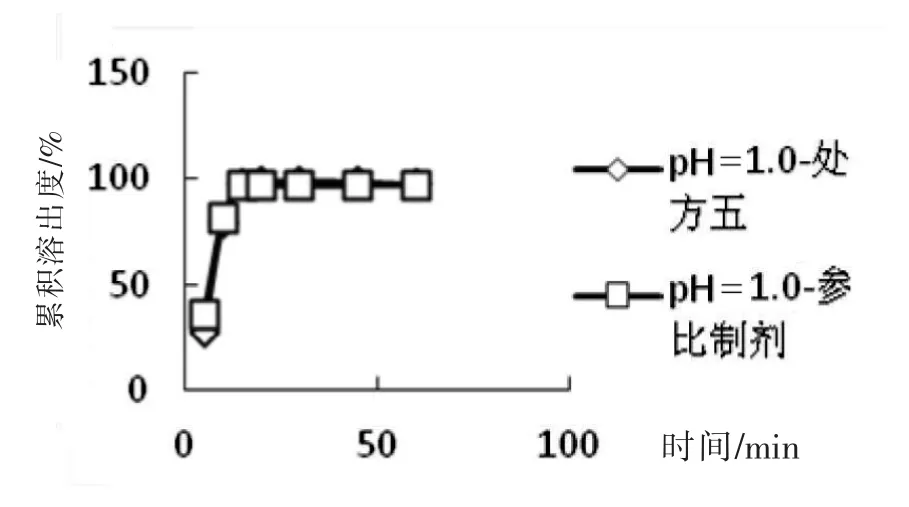
图2 处方五和参比制剂在pH=1.0盐酸溶液中溶出曲线
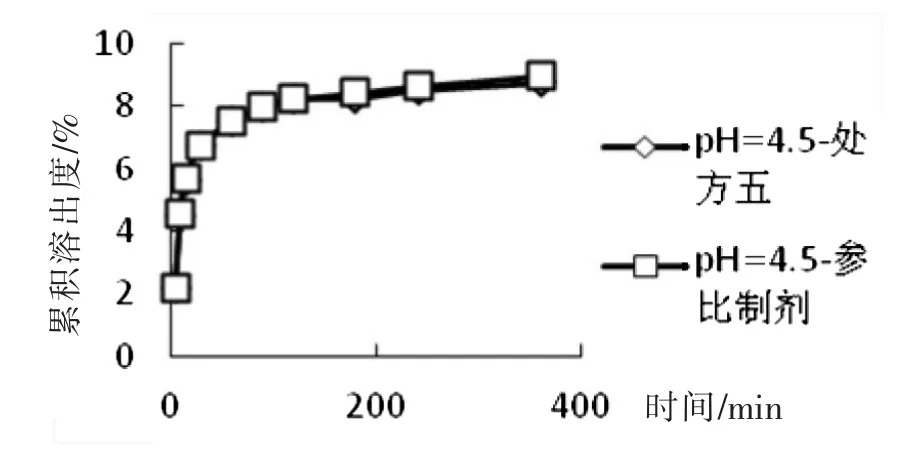
图3 处方五和参比制剂在pH=4.5醋酸盐缓冲液中溶出曲线

图4 处方五和参比制剂在pH=6.8磷酸盐缓冲液中溶出曲线
4 中试放大
为了进一步验证处方五与原研制剂在四种溶出介质中的溶出行为一致,我们按照处方五,进行中试批量放大,连续试制三批,试制批量为每批5万片,再与参比制剂的进行溶出曲线比较。结果见表4和图5。可见,三批中式放大后制得的片剂和参比制剂在水、pH=4.5醋酸盐缓冲液、pH= 6.8磷酸盐缓冲液中溶出曲线的f2因子均大于50,在pH=1.0盐酸溶液中满足15 min累积溶出度大于85的要求。中试放大后溶出曲线依然具有良好的相似性。
5 结论
本实验研究通过改变处方中乳糖、微晶纤维素101、交联羧甲基纤维素钠、二氧化硅的量,设计五个处方,见表1,并对这五个处方和参比制剂在水溶液中进行溶出曲线比较,初步确定处方五和参比制剂相似,又对处方五和参比制剂在pH= 1.0盐酸溶液、pH=4.5醋酸盐缓冲液、pH=6.8磷酸盐缓冲液中进行溶出度曲线比较,进一步确定处方五和参比制剂相似。再将处方五中试放大5万片生产三批,通过测定溶出度验证了该工艺的具有良好稳定性及重现性。

表4 三批中试样品在不同介质溶出度测定结果

图5 三批中试和参比制剂在不同介质中溶出曲线图
参考文献:
[1]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40 (12):946-950,955.
[2]中国食品药品检定研究院.仿制药质量一致性评价-口服固体制剂参比制剂确立原则(草案).2013-12-31.
[3]Ku C C,Sprockel O L,Lang B A,et al.Pharmaceutical compositions containing irbesartan:US,5994348A[P].1999-11-30.
[4]国家食品药品监督管理总局药品审评中心.口服固体制剂溶出度试验技术指导原则.2009.
[5]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-311.
精细化工
修回日期:2016-03-17
Screening the Irbesartan Tablet Formulations According to 4 Dissolution Profiles
LIU De-zhi,LI Peng
(Zhejiang Kinglyuan Pharmaceutical Co.,Ltd.Shaoxing,Zhejiang 312309,China)
Abstract:After compare the f2 factors of 4 dissolution profiles obtained from water,acetate buffer solution,hydrochloric acid solution and phosphate buffer solution due to self-developed products and reference product,the final formulation is determined.By compare the different f2 factor due to homemade products with different excipients content(Formulation 1~5)and the reference product(Lot No.:3A292),we found that when the content of lactose,microcrystalline cellulose,croscarmellose sodium carboxymethyl cellulose,hydroxypropyl methyl cellulose,silica and magnesium stearate is 18.60%,14.34%,4.65%,1.16%,2.71% and 0.39%respectively,the f2 factor of homemade product is similar with the reference product.What’s more,the process is stable and repeatable.
Keywords:irbesartan;formulation;dissolution evaluation
文章编号:1006-4184(2016)5-0024-04
作者简介:刘德智(1975-),男,浙江杭州人,工程师,主要从事药品生产、研发及质量管理工作。E-mail:344546939@qq.com。

