小细胞肺癌药物治疗进展
邸明一 张力
小细胞肺癌药物治疗进展
邸明一张力
摘要小细胞肺癌(small cell lung cancer,SCLC)约占肺癌患者的13%。与非小细胞肺癌相比具有早期转移倾向及对一线细胞毒性化疗药物敏感的特点。目前的治疗方式包括手术、胸部及脑部放疗和化疗。以铂类联合依托泊苷为标准一线化疗,治疗后复发率较高。拓扑替康单药为标准二线化疗,新型的靶向和免疫治疗等疗效均欠佳。因此小细胞肺癌的治疗亟待有新的突破。
关键词小细胞肺癌化疗一线治疗二线治疗
作者单位:北京协和医院呼吸内科(北京市100730)
中国癌症统计研究结果显示,2015年我国共有429.2万新发肿瘤病例和281.4万癌症死亡病例,以肺癌为发病率最高,并且肺癌的死亡率也位于各种不同肿瘤类型之首。小细胞肺癌(small cell lung cancer,SCLC)是肺癌的一种组织学亚型,约占肺癌患者的13%。与非小细胞肺癌相比具有早期转移倾向及对一线细胞毒性化疗药物敏感的特点。AJCC(第7版)的最新分期定义认为,局限期SCLC(limited-stage SCLC,LS-SCJC)是包括TNM分期的Ⅰ~Ⅲ期(任意T、任意N、M0)能耐受确定剂量放疗,除外多发肺结节的T3~4或肿瘤过大不能耐受放疗的患者。广泛期SCLC(extensive-stage SCLC,ES-SCLC)定义为:TNM分期的Ⅳ期(任意T、任意N、M1a/b),和多发肺结节或肿瘤过大不能耐受放疗的的T3~4患者。LS-SCLC和ES-SCLC患者MST分别为15~20个月和8~13个月。LS-SCLC患者两年生存率为20%~40%,而ES-SCLC不到5%。现将SCLC药物治疗方法综述如下。
1 一线治疗
1.1LS-SCLC
SCLC对化疗敏感,因此化疗为SCLC首选治疗,联合化疗为LS-SCLC的基础治疗。对于身体条件较好的LS-SCLC患者,顺铂+依托泊苷(EP)化疗方案联合胸部放疗为标准治疗方案。其中化疗不良反应小且无禁忌证的患者可序贯以预防性脑放疗。LSSCLC的客观缓解率(ORR)为80%,中位生存时间(OS)为17个月,12%~25%的患者可获得5年无疾病生存时间。
1970年治疗SCLC的CAV(环磷酰胺+阿霉素+长春新碱)方案被首次提出。该试验选取153例LSSCLC患者作为研究对象,给予6个周期CAV化疗方案+胸部放疗(接受CAV方案6个周期后),针对化疗有效患者预防性脑放疗(接受CAV方案3个周期后)。该研究中84%患者对治疗有反应,52%患者获得完全缓解(CR),中位OS为49周,预计2年生存率为19%。CAV化疗方案也因此被证实疗效确切且耐受性好,被视为LS-SCLC的标准治疗方案[1]。
1980年开始,EP化疗方案的使用逐渐增多。化疗客观缓解率达到63%,对初治患者尤其有效,可获得40%以上的有效率,中位OS提高至14个月。一项随机Ⅲ期临床试验研究对比EP方案和CEV方案(环磷酰胺+表柔比星+长春新碱)的疗效及不良反应的,分别予以LS-SCLC患者EP方案(静脉顺铂75 mg/m2+依托泊苷100 mg/m2d1~3、口服依托泊苷200 mg/m2d2~4,每疗程3周,5个疗程)和CEV方案(静脉表柔比星50 mg/m2+环磷酰胺1 000 mg/m2+长春新碱2 mg d1,每疗程3周,5个疗程),并接受同步胸部放疗,其中完全缓解者接受预防性脑照射。结果显示,EP组较CEV组获得更长的OS(14.5个月vs.9.7个月,P= 0.001),且血液学毒性较低。因此,EP方案逐渐取代CAV方案成为SCLC一线治疗首选方案[2]。
肺癌的发病率随着年龄增长而增加,随着世界人口老龄化,至少25%SCLC患者年龄>70岁。临床试验中此类患者入组较少(约占入组的1%)。目前认为实际年龄无意义,而生理年龄和诊断前功能状态更有助于确定治疗方案。对于诊断前数月内具有正常生活能力的高龄患者,推荐全量化疗(如具备放疗指征可同期予以同步或序贯放疗)。但该人群骨髓抑制及器官功能降低发生率相对较高,特别是化疗毒性与疾病损害叠加的第1疗程。对比依托泊苷单药与经典EP方案的研究显示,更温和的单药治疗劣于联合化疗。在年老或虚弱患者中应用短期、足量化疗,结果显示2个疗程化疗的近期与远期疗效与经典EP方案对比均未见明显劣效性。
1.2ES-SCLC
化疗是ES-SCLC的标准治疗,以4~6个疗程的顺铂/卡铂联合依托泊苷(EP或CE)方案应用最广,其ORR为50%~90%,中位OS只有7~9个月,5年生存率仅为2%[3]。一项包含19项研究数据的Meta分析显示,与不含铂方案相比,含铂方案的缓解率更高(RR=1.35,95%CI为1.18~1.55,P<0.001),死亡风险显著降低(OR=0.8,95%CI为0.69~0.93,P=0.002)。含顺铂方案组的毒性死亡率未升高(3.1%和2.7%),客观有效率显著增加(P<0.001);6个月和1年生存均增加,但差异无统计学意义。而有无依托泊苷两组分析对比的各项指标较相似[4]。与其他肿瘤一样,含铂方案对SCLC的化疗能够获得更好的结果,并且未增加致死性毒性,因此,含铂化疗方案是SCLC的标准治疗,不含铂化疗方案可作为不能接受铂类化疗的SCLC患者的备用方案。
美国西南肿瘤协作组的一项包含437例ES-SCLC患者的随机试验对比了EP、CAV及CAV/EP方案,ORR分别为61%、51%、59%;完全缓解率(CRR)分别为10%、7%、7%;OS分别为8.6、8.3、8.1个月;中位进展时间(TTP)分别为4.3、4.0、5.2个月。3个方案在疗效方面(ORR、CRR、TTP、中位OS)差异无统计学意义,在ES-SCLC的诱导缓解阶段效果相当[4]。综合分析显示,EP方案对ES-SCLC客观缓解率为70%~85%,OS为8~13个月,2年生存率为5%。但一线化疗有效维持时间短,多数患者在化疗停止6个月内疾病发生进展,同时二线化疗均表现为较低的有效率。
因顺铂的不良反应,将顺铂更换为卡铂成为目前研究的焦点。在4项随机试验的Meta分析中[4],二者的有效率、OS、PFS均基本相当,骨髓抑制在卡铂组的发生率高于顺铂组,而非血液毒性的不良反应,如恶心、呕吐、神经毒性、中毒性肾损害等不良反应在顺铂组的发生率明显高于卡铂组。该证明了卡铂与顺铂在SCLC的治疗效果上基本相同,但具有不同的不良反应,可以在使用时根据患者的基础疾病及耐受程度进行选择。
除了以上依托泊苷联合顺铂/卡铂的标准治疗方案外,许多研究致力于开发新的化疗方案,包括更改使用时间、3~4种药联合使用、加大剂量、维持治疗和联合使用靶向药物等。
1.2.1两药联用1)伊立替康+顺铂/卡铂(IP方案):伊立替康替代依托泊苷联合顺铂作为SCLC的一线治疗首先由日本专家提出。在该项随机Ⅲ期临床研究中,针对ES-SCLC患者一线使用IP方案(伊立替康60 mg/m2d 1、8、15+顺铂60 mg/m2d1)与标准EP方案进行对比,结果显示IP方案的OS、2年生存率及中位PFS均优于EP方案。二者的不良反应也有很大区别:IP方案的3~4度腹泻较重,而EP方案的骨髓抑制较为明显。伊立替康替代依托泊苷治疗ES-SCLC不同,临床试验结果不同可能与研究入组的患者特征、种族、药代动力学存在差异,给药方案也不尽相同。而IP/IC方案疗效优于标准EP方案的结论并未被欧美人群试验所验证,可能是由于潜在的药物基因组学差异(如UGT1A1酶的基因多态性),导致日本人群与欧美人群试验中得到不同的结论。2)表柔比星+顺铂(AP方案):在一项国内进行的AP方案与EP方案对比的Ⅲ期临床研究中得到结论如下,AP方案在SCLC的治疗中ORR及MST均优于EP方案,尽管AP方案中顺铂的使用量较低,但AP方案的不良反应(主要是3~4度的白细胞或中性粒细胞减低)发生率高于EP方案。3)拓扑替康+顺铂(TP方案):拓扑替康是拓扑异构酶I抑制剂。一项针对初治的ESSCLC患者的随机Ⅲ期临床试验对比标准EP方案与TP方案;该研究证实,两组的ORR分别为45.5%和55.5%(P=0.01),中位TTP分别为24.3和27.4周(P= 0.01),OS分别为40.9和44.9个月(P=0.30);预计1年生存率为36.1%和39.7%,无显著性差异(P=0.30);药物所致的死亡率在两组中分别为2.7%和5.2%,TP组高于EP组;3~4级血液毒性以TP组居多。综上,TP方案在OS上不劣于EP方案,在TTP和总有效率上优于EP方案,但不良反应更强,目前尚不适于成为标准一线治疗方案[5-6]。
1.2.2增加化疗联用药物种类近10年来,一些研究机构试图在EP标准化疗方案上增加1或2种药物以达到更好的疗效。1)EP+VIP:随机选取的171例ES-SCLC患者分别予以EP方案和EP+异环磷酰胺(VIP)治疗,两组的客观缓解率分别为67%和73%,CRR分别为20%和21%,两组有效率的差异无统计学意义。中位TTP分别为6.0和6.8个月,中位OS分别为7.3和9.1个月,1、2、3年生存率EP组分别为27%、5%、0;EP+VIP组中为36%、13%、5%,以上数据均证实EP+VIP方案在疗效上优于EP方案。然而在可完全评估的163例非分层患者中所获得的生存数据无统计学意义(P=0.06)。不良反应方面,3~4级骨髓抑制在EP+VIP组发生率较高,贫血在EP组和EP+ VIP组发生率分别为13%和42%,白细胞减低的发生率分别为39%和57%,血小板减低的发生率为18%和28%。2)EP+表柔比星+环磷酰胺:在一项入组226例ES-SCLC患者的试验中对比了EP与EP+表柔比星+环磷酰胺(PCDE)的疗效。两组的ORR分别为61% 和76%,CRR分别为13%和21%(P=0.02),TTP分别为6.3和7.2个月(P<0.001),OS分别为9.3和10.5个月(P=0.006 7),1年生存率分别为29%和40%。不良反应反面,所有级别的不良反应均以PCDE组为重,贫血的发生率在EP组与PCDE组分别为18%和51%,白细胞减低为85%和99%,血小板减少为18% 和78%;心脏毒性时间的发生率分别为2%和8%(其中PCDE组出现1例致死性心梗);发热的发生率分别为18%和79%;感染的发生率为8%和22%,其中需要使用静脉抗生素的有26%和67%;需要红细胞输注的分别为13%和45%;需要血小板输注支持治疗的分别为5%和38%。生存质量上二者无显著差异。因此在法国的一些肿瘤研究机构将PCDE方案作为优选[5-6]。
1.2.3增加药物剂量有研究试图通过加大药物剂量以增加获益[7]。美国一项包含90例患者的随机临床试验中,标准EP组给与顺铂80 mg/m2d1+依托泊苷80 mg/m2d1-3;1次/3周,共使用8个疗程;高剂量组在前两个疗程予以顺铂27 mg/m2+依托泊苷80 mg/m2d1-5,1次/3周,之后的6周期药物使用同标准剂量。结果显示,高剂量组在疗效上并不优于标准组。CRR在高剂量组和标准剂量组分别为23%和22%(P=0.99),中位OS分别为10.7和11.4个月。不良反应方面,高剂量组的骨髓抑制和体质量减轻较标准剂量组更严重[5-6]。因此,增加化疗强度将增加化疗不良反应及药物治疗相关死亡率[6]。
近期,另一项随机研究对比了增量组异环磷酰胺+卡铂+依托泊苷(HD-ICE)与标准剂量组(ICE)的疗效与不良反应,尽管化疗药物的总剂量、峰值剂量和剂量强度增加了3倍,疗效仍无明显变化,且增加了不良反应和费用[7]。
综上所述,无论何种方式的加大化疗药物剂量不仅均无法带来更多的治疗获益,而且加大了不良反应的发生率及强度。
1.2.4改变治疗持续时间改变化疗持续时间也是提高获益的研究方向之一。主要是在4~6个周期标准化疗后继续予原方案化疗或其他方案序贯治疗。但增大了化疗的不良反应,并未获得生存获益的提高。另外是将干扰素-α用于维持治疗,尽管干扰素-α对化疗药物有潜在增效作用,但并未获得生存时间的增加[8-9]。综上,目前尚缺乏资料证实延长治疗时间(原方案、其他方案、干扰素-α)可加大SCLC治疗获益。
1.2.5联用靶向治疗近年来,靶向药物(如抗血管生成药物)联合化疗或作为维持治疗成为新的研究热点。但目前作为一、二线治疗方案尚无生存获益。新的阻断CTLA-4的免疫调节药物或将成为SCLC治疗有前途的研究方向,目前已进行大量相关的研究[9]。
2 维持治疗
在完成一线诱导化疗后,同方案或更换方案的维持治疗能否为非进展期的SCLC患者带来获益也是目前研究的另一热点。一项402例患者的研究中显示,托泊替康维持组较单纯观察,未予维持治疗的患者的PFS将显著提高,但OS无显著性差异[6]。而使用CCI-700作为维持治疗方案的Ⅱ期临床试验并未得到PFS有提高的结论。一项来自21个随机试验Meta分析结果也显示[8],维持治疗未提高OS和PFS。由于维持治疗对于非选择性、非进展期SCLC患者并无明确获益,不是SCLC的常规治疗。
3 二线治疗
SCLC对初始化疗的高敏感性难以维持较长时间,大部分患者死于一线治疗。1年内的疾病复发或进展。未经治疗OS为2~3个月。在初期疾病被以铂类制剂为基础的一线治疗控制后90天内进展属于对铂类抵抗的耐药复发,而90天内未进展的称敏感复发。
若一线药物治疗有效持续时间>6个月则提示二线治疗可使用原一线含铂方案。而原药治疗对耐药复发的RR仅为10%。由此可见,SCLC对一线治疗反应的效果及持续有效时间很大程度上预示着对二线治疗的反应效果。
3.1拓扑替康
拓扑替康是FDA唯一认可的SCLC标准二线治疗,可经口服或静脉给药。相关的临床试验均显示,两种给药方式在临床疗效及耐受性上均无显著性差异。口服拓扑替康的有效率及中位生存时间均优于CAV方案及最佳支持治疗(BSC),不仅延长了OS,且提高了患者的生活质量。数据显示,拓扑替康应用于敏感复发SCLC二线治疗时ORR及中位生存期(MST)分别为6.4%~38%和6.4~8.7个月;在耐药复发组分别为2.4%~6.4%和4.1~5.1个月。而拓扑替康治疗相关的不良反应主要为骨髓抑制,一般无积累效应,给予骨髓辅助用药后可改善[10]。
3.2其他药物
除拓扑替康外,依托泊苷、伊立替康、吉西他滨、培美曲塞、特素、皮卡铂、苯达莫司汀等药物作为新型化疗药物被用于SCLC二线治疗,临床试验中RR 为0~29%,MST为3.3~7.0个月。疗效均不及拓扑替康[11]。
3.2.1伊立替康一项随机Ⅱ期临床试验对比伊立替康单药及伊立替康联合吉西他滨在SCLC二线治疗中的疗效,结果显示伊立替康单药组未见CR及PR患者,因此伊立替康用于复发SCLC二线治疗疗效尚不确切[12]。
3.2.2培美曲塞大剂量培美曲塞对复发SCLC疗效有限。培美曲塞作为SCLC二线治疗用药尚无明确数据支持,主要原因可能是SCLC中TS基因的过表达。尽管培美曲塞具有TS基因抑制功效,小细胞肺癌及鳞癌中过高表达的TS基因活性仍使培美曲塞的抗肿瘤活性不能完全发挥,这可能是导致培美曲塞在SCLC和鳞癌中抗肿瘤效果有限的主要原因[13]。
3.2.3吉西他滨在一项Ⅱ期临床研究中入组27例患者(其中包括15例敏感复发和12例耐药复发患者)均接受吉西他滨1 250 mg/m2d1、d8,静脉滴入,3例SD,无PR,耐药复发患者的RR和DCR分别为0和8.3%,中位TTP和MST分别为5.6(3~24.5)周和4.2 (1.5~13.0)个月。因此吉西他滨在复发SCLC二线治疗中效果有限[14]。
3.2.4氨柔比星第1例对比标准二线方案拓扑替康与氨柔比星的试验在日本实施,59例患者(包括23例耐药复发,36例敏感复发)随机使用氨柔比星方案(40 mg/m2d1-3,每3周为1疗程)或拓扑替康(1.5 mg/ m2d1-5,每3周为1疗程)。其RRs和DCRs在氨柔比星组(分别为38%和79%)优于拓扑替康组(分别为13%和47%)。PFS在氨柔比星组和拓扑替康组中分别为3.5和2.2个月,中位OS分别为8.1和8.4个月。多因素分析显示氨柔比星对OS影响更大。亚组分析表明氨柔比星用于ECOG0-1分的耐药复发SCLC患者的治疗可获得更高的DCR。RR及DCR在各亚组中均显示氨柔比星疗效优于拓扑替康(表1)[15]。
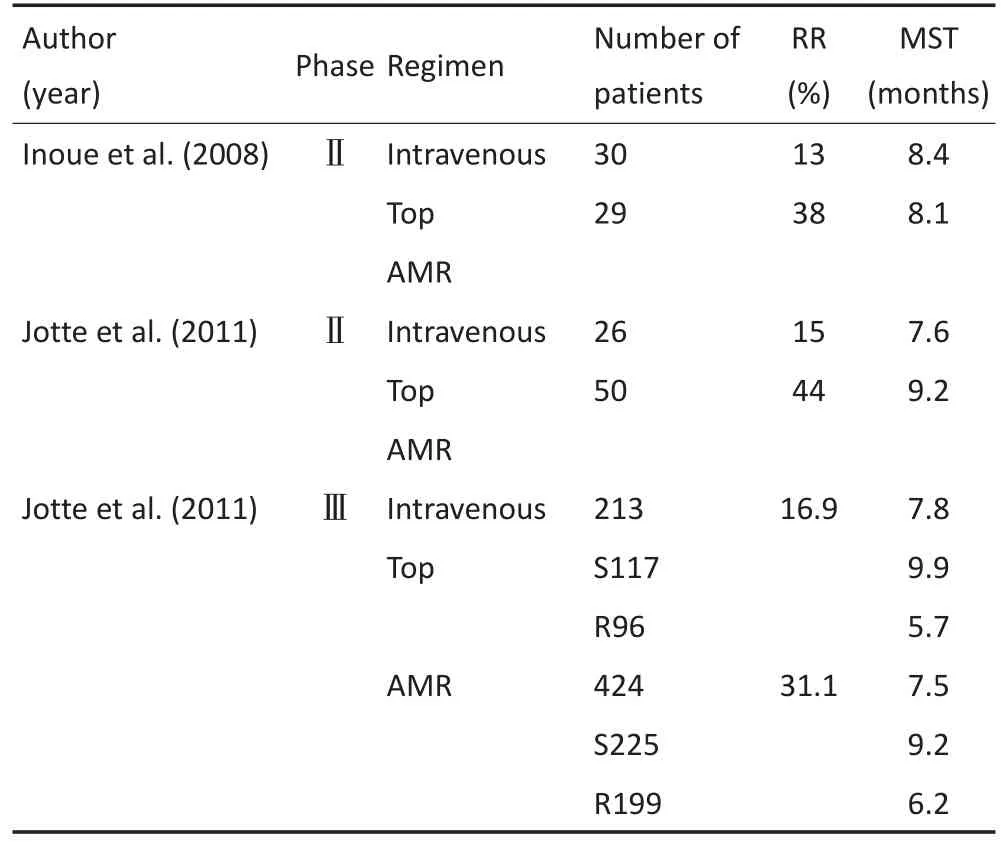
表1 氨柔比星与拓扑替康疗效对比的相关实验Table 1 Randomized phaseⅡ-Ⅲtrials of topotecan versus amrubicin for relapsed SCLC as second-line chemotherapy
另外,一线治疗使用依托泊苷的复发患者,可使用氨柔比星作为二线治疗,二者间无交叉耐药;而一线治疗使用伊立替康治疗的复发患者选用拓扑替康作为二线治疗无效。该研究中,19例使用拓扑替康进展的患者再次使用氨柔比星,其中4例得到PR(占21%)。而5例使用氨柔比星进展的患者再次使用拓扑替康则无一例有效。
不良反应方面,4度中性粒细胞减少在两组的发生率分别为79%和43%,粒缺伴发热的发生率分别为14%和3%,因此不良反应的发生率氨柔比星组高于拓扑替康组。
关于氨柔比星的Ⅱ期临床试验也证实,氨柔比星组RR远高于拓扑替康组(分别为44%和15%),氨柔比星组的中位PFS和OS均优于拓扑替康组,而两组药物的耐受性基本相当。血液毒性氨柔比星组低于拓扑替康组,3~4级中性粒细胞减少及血小板减少在氨柔比星组的发生率分别为61%和39%,而在拓扑替康组分别为78%和61%。[14-15]
一项复发SCLC二线治疗中氨柔比星对比拓扑替康的Ⅲ期临床试验中入组637例患者,按2:1的比例随机接受氨柔比星或拓扑替康。两组的RRs分别为31.1%和16.9%,DCRs分别为70.0%和61.5%;中位PFSs分别为4.1和3.5个月;中位OSs分别为7.5和7.8个月。3~4级不良反应中,中性粒细胞减少的发生率在氨柔比星组和拓扑替康组分别为41.2%和51.3%;血小板减少的发生率分别为21%和54%;贫血的发生率分别为16%和30%;感染的发生率分别为16%和10%;粒缺伴发热的发生率10%和4%(均P<0.05);而心功能不全的发生率在两组中均为5%(P= 0.84)。两组患者的输血率分别为32%和53%。因此,与拓扑替康相比,氨柔比星的RR及OS更高,血液系统毒性更小[15-17]。
此外,研究证明,不同剂量的氨柔比星的RRs和MSTs基本相当,为减轻不良反应,更倾向于使用小剂量药物治疗复发SCLC。
3.3多药联合化疗包括CDDP+CPT-11方案、GEM+CPT-11方案、CDDP+ETP+CPT-11方案、CD⁃DP+PTX+IFM等,各方案RR值与MST值为10%~88%和3.0~11.8月,尽管顺铂+依托泊苷+长春新碱+特素或伊立替康治疗复发SCLC有效,但不足以取代拓扑替康标准治疗。以伊立替康为基础的联合治疗与拓扑替康标准治疗相比同样未得到更优的抗肿瘤活性。因此多药联合化疗仍未能取代拓扑替康作为二线治疗的标准方案[18-19]。
4 靶向治疗
血管内皮生长因子(VEGF)家族由VEGF-A、VEGF-B、VEGF-C、VEGF-D和VEGF-E以及其3个VEGF受体(VEGFR1~3)所组成。VEGF信号通路可使内皮细胞的增殖、迁移和侵袭性增强,从而介导肿瘤的血管生成。SCLC患者的VEGF水平较高,且与肿瘤分期、疾病进展、化疗耐药以及预后不良有关。舒尼替尼是一种口服多靶点小分子酪氨酸激酶受体抑制剂,关于舒尼替尼的临床试验证实,其PFS和中位OS分别为1.4和5.6个月,作为SCLC的二线治疗较拓扑替康无优势(表2)。
除目前已知靶点外,由于SCLC突变率极高,人类体细胞SCLC变异率的中位值为84%、可表达高达8.26/百万碱基对的非同义突变。一项近期的研究对SCLC标本进行了全基因组测序,鉴别出了许多新的候选基因,其中一些基因可能具有治疗SCLC的意义。尽管这样的突变即时治疗结果罕见,但是目前在SCLC中是存在的(如BRAF或KIT)),表明个别患者可以从基因分型和靶向性激酶抑制剂疗法中受益。目前认为BRAF 18、KIT 19、20和PIK3CA基因突变具有潜在的治疗意义,而一些具有其他功能作用的新的基因(如KIAA1211、COL22A1、ASPM、PDE4DIP或PTGFRN)的生物功能目前还尚不清楚。但该研究第一次对SCLC进行全面的基因组分析,揭示出了这一疾病发病机制中从前未知的几个基因和生物学过程,为开发出更有效的靶向治疗干预来对抗这种致命的癌症提供了潜在的靶点[20-21]。

表2 目前的靶向药物的临床试验Table 2 Ongoing clinical trials of targeted drugs
5 免疫治疗
免疫治疗的概念于1980年由美国专家首次提出,指的是刺激免疫系统杀伤肿瘤细胞,免疫治疗不但可提高免疫系统识别和排除肿瘤细胞的能力,而且对正常组织影响轻微。目前开展的SCLC免疫治疗方法主要包括肿瘤疫苗、过继细胞免疫治疗、细胞因子和checkpoint抑制剂等。细胞免疫治疗与传统治疗联用可使疗效提高20%~30%。目前p53瘤苗已被用于一线治疗,但PFS及OS并无提高,目前尚缺乏试验明确证实关于SCLC的免疫治疗有效[22]。
综上所述,以铂类为基础的化疗是SCLC的标准治疗方案,顺铂与卡铂疗效相当,选择主要依据预期毒性谱、脏器功能与共患疾病,早期胸部放疗与化疗联合能延长生存,但是不良反应相应增高,可作为年轻、PS好且无重要脏器合并症的局限期患者的治疗选择。维持治疗不是SCLC的常规治疗。拓扑替康做为复发的SCLC的二线标准治疗,口服和静脉给药疗效相当且较BSC获益。氨柔比星的RR及OS较拓扑替康标准治疗更高,血液系统毒性更小,研究前景较为乐观。靶向治疗与免疫治疗方面开展研究较多,但均尚无明确进展。全基因组测序为SCLC的治疗提供潜在新靶点。因此,小细胞肺癌的治疗,尤其是复发后的二线治疗仍有待进一步研究。
参考文献
[1]Hermes A,Bergman B,Bremnes R,et al.Irinotecan plus carboplatin versus oral etoposide plus carboplatin in extensive small- cell lung cancer:a randomized phase III trial[J].J Clin Oncol,2008,26 (26):4261-4267.
[2]Hanna N,Bunn Jr PA,Langer C,et al.Randomized phase III trial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer[J].J Clin Oncol,2006,24(13):2038-2043.
[3]Lara Jr PN,Natale R,Crowley J,et al.Phase III trial of irinotecan/cisplatin compared with etoposide/cisplatin in extensive-stage smallcell lung cancer:clinical and pharmacogenomic results from SWOG S0124[J].J Clin Oncol 2009;27(15):2530-2535.
[4]Jiang J,Liang X,Zhou X,et al.A meta-analysis of randomized controlled trials comparing irinotecan/platinum with etoposide/platinum in patients with previously untreated extensive-stage small cell lung cancer[J].J Thorac Oncol,2010,5(6):867-873.
[5]Fink TH,Huber RM,Heigener DF,et al.Topotecan/cisplatin compared with cisplatin/etoposide as first-line treatment for patients with extensive disease small-cell lung cancer:final results of a randomized phase III trial[J].J Thorac Oncol,2012,7(9):1432-1439.
[6]Mariacarmela Santarpia,Maria Grazia Daffinà,et al.Targeted drugs in small-cell lung cancer[J].Transl Lung Cancer Res,2016,5(1):51-70.
[7]Leyvraz S,Pampallona S,Martinelli G,et al.A threefold dose intensity treatment with ifosfamide,carboplatin,and etoposide for patients with small cell lung cancer:a randomized trial[J].J Natl Cancer Inst,2008,100(8):533-541.
[8]Schiller JH,Adak S,Cella D,et al.Topotecan versus observation after cisplatin plus etoposide in extensive-stage small-cell lung cancer:E7593-a phase III trial of the Eastern Cooperative Oncology Group[J].J Clin Oncol,2001,19(8):2114-2122.
[9]Rossi A,Garassino MC,Cinquini M,et al.Maintenance or consolidation therapy in small-cell lung cancer:a systematic review and meta-analysis[J].Lung Cancer,2010,70(2):119-128.
[10]Morabito A,Carillio G,Daniele G,et al.Treatment of smalll cell lung cancer[J].Crit Rev Oucol Hematol,2014,91(3):257-270.
[11]Lee SM,Woll PJ,Rudd R,et al.Anti-angiogenic therapy using thalidomide combined with chemotherapy in small cell lung cancer:a randomized,double-blind,placebo-controlled trial[J].J Natl Cancer Inst,2009,101(15):1049-1057.
[12]Pujol JL,Breton JL,Gervais R,et al.Phase III double-blind,placebocontrolled study of thalidomide in extensive-disease small-cell lung cancer after response to chemotherapy:an intergroup study FNCLCC cleo04 IFCT 00-01[J].J Clin Oncol,2007,25(25):3945-3951.
[13]Reck M,Bondarenko I,Luft A,et al.Ipilimumab in combination with paclitaxel and carboplatin as first-line therapy in extensive-diseasesmall-cell lung cancer:results from a randomized,double-blind,multicenter phase 2 trial[J].Ann Oncol,2013,24(1):75-83.
[14]Shipley DL,Hainsworth JD,Spigel DR,et al.Topotecan:weekly intravenous(Ⅳ)schedule similar to standard 5-dayⅣschedule as second-line therapy for relapsed small cell lung cancer(SCLC).A minnie pearl cancer research network phaseⅡtrial[J].J Clin Oncol,2006,24(18S):7083.
[15]Shah C,Ready N,Perry M,et al.A multi-center phase II study of weekly topotecan as second-line therapy for small cell lung cancer.[J].Lung Cancer,2007,57(1):84-88.
[16]Spigel DR,Greco FA,Burris HA,et al.A phase II study of higher dose weekly topotecan in relapsed small-cell lung cancer[J].Clin Lung Cancer,2011,12(3):187-191.
[17]O'Brien ME,Ciuleanu TE,Tsekov H,et al.Phase III trial comparing supportive care alone with supportive care with oral topotecan in patients with relapsed small-cell lung cancer[J].J Clin Oncol,2006,24(34):5441-5447.
[18]Eckardt JR,von Pawel J,Pujol JL,et al.Phase III study of oral compared with intravenous topotecan as second-line therapy in smallcell lung cancer[J].J Clin Oncol,2007,25(22):2086-2092.
[19]Qian Ding,Jinbiao Zhan.Amrubicin:potential in combination with cisplatin or carboplatin to treat small-cell lung cancer[J].Drug Des Devel Ther,2013,7:681-689.
[20]Ciuleanu T,Samarzjia M,Demidchik Y,et al.Randomized phase III study(SPEAR)of picoplatin plus best supportive care(BSC)or BSC alone in patients(pts)with SCLC refractory or progressive within 6 months after first-line platinum-based chemotherapy[J].J Clin Oncol,2010,28:15s[supp;abstr.7002].
[21]Allen JW,Moon J,Gadgeel SM,et al.SWOG 0802:a randomized phase II trial of weekly topotecan with and without AVE0005(aflibercept)in patients with platinum-treated extensive-stage small cell lung cancer(E-SCLC)[J].J Clin Oncol,2012,32(23):2463-2470.
[22]Ready NE,Dudek AZ,Pang HH,et al.Cisplatin,irinotecan,and bevacizumab for untreated extensive-stage small-cell lung cancer[J].J Clin Oncol,2011,29(33):4436-4441.
(2016-03-08收稿)
(2016-04-14修回)
(编辑:杨红欣校对:武斌)
邸明一专业方向为肺部肿瘤研究。E-mail:dmyksxhhzby@163.com

·临床研究与应用·
Advances in chemotherapy of small cell lung cancer
Mingyi DI,Li ZHANG
Department of Respiratory Medicine,Peking Union Medical College Hospital,Beijing 100730,China
Correspondence to:Li ZHANG;E-mail:zhanglipumch@aliyun.com
AbstractSmall cell lung cancer(SCLC)accounts for about 13%of lung cancer.SCLC exhibits an early metastatic potential and sensitivity to first-line cytotoxic chemotherapy compared with non-small cell lung cancer.Current treatments include surgery,radiotherapy,and chemotherapy.Platinum plus etoposide is viewed as the standard first-line chemotherapy.However,recurrence rate of cancer after platinum plus etoposide chemotherapy is high.Topotecan monotherapy is the standard second-line chemotherapy.Meanwhile,novel targeted immunotherapy showed poor effects.Hence,new breakthroughs in the treatment of SCLC are urgently needed.
Keywords:small cell lung cancer,chemotherapy,first-line therapy,second-line therapy
doi:10.3969/j.issn.1000-8179.2016.10.275
通信作者:张力zhanglipumch@aliyun.com
作者简介

