酶联免疫法检测自身免疫性肝炎I型抗纤维肌动蛋白抗体的评估
刘 玲,黄 洁,彭晓明,肖明中,李晓东
湖北省中医院1.检验科;2.肝病科,湖北 武汉 430061
酶联免疫法检测自身免疫性肝炎I型抗纤维肌动蛋白抗体的评估
刘 玲1,黄 洁1,彭晓明1,肖明中2,李晓东2
湖北省中医院1.检验科;2.肝病科,湖北 武汉 430061
目的 对使用酶联免疫吸附试验(ELISA)检测自身免疫性肝炎(autoimmune hepatitis,AIH)Ⅰ型患者抗纤维肌动蛋白抗体(AFA)进行评估分析。方法 收集163例AIH-Ⅰ型、15例AIH-Ⅱ型、36例AIH-Ⅲ型患者临床资料及血清标本,采用ELISA法检测患者的AFA,同时采用间接免疫荧光法(IFA)检测患者的AFA和抗平滑肌抗体(ASMA)作为对照,对检测结果进行统计学分析。结果 以IFA≥1∶320、ELISA≥30 U为阳性判断标准,除AFA-ELISA与ASMA-IFA检测AIH-Ⅱ型的阳性例数差异有统计学意义外(P=0.03),AFA-ELISA与AFA-IFA、ASMA-IFA比较,检测其他AIH各型患者阳性例数差异均无统计学意义(P﹥0.05)。AFA-ELISA与AFA-IFA检测AIH-Ⅰ型的相关性比ASMA-IFA更好(r=0.97vs0.52)。AFA-ELISA与AFA-IFA相比,检测AIH-Ⅰ型有稍高的敏感性(76.07%vs71.17%)和略低的特异性(72.55%vs78.43%);AFA-ELISA与ASMA-IFA相比,检测AIH-Ⅰ型有更高的敏感性和特异性(76.07%vs64.42%,72.55%vs60.78%);AFA-ELISA 检测AIH-Ⅰ型的约登指数与AFA-IFA相近(0.49vs0.50),比ASMA-IFA高(0.49vs0.25)。AFA-ELISA检测AIH-Ⅰ型的ROC面积为0.86,当浓度为54.06 U/ml时检测的敏感性和特异性最好。结论 AFA-ELISA检测AIH-Ⅰ型的敏感性和特异性与AFA-IFA相近,但操作更方便,与ASMA-IFA的敏感性相近,但特异性更好。AFA-ELISA可作为AIH-Ⅰ型较好的筛查方法。
自身免疫性肝炎;抗纤维肌动蛋白抗体;抗平滑肌抗体;酶联免疫吸附试验;间接免疫荧光法
自身免疫性肝炎(autoimmune hepatitis,AIH)Ⅰ型是一种慢性进行性肝脏疾病,免疫抑制剂能有效控制部分患者病情的发展,如果不能正确诊断和及时有效治疗,最终可导致肝硬化、肝功能衰竭,因而早期准确诊断是关键[1]。抗纤维肌动蛋白抗体(anti-filamentous actin antibody,AFA)近年来备受关注,被认为对AIH-Ⅰ型具有较好的诊断价值[2-3],但目前对AIH自身抗体的检测方法亟待规范[4-5]。我们使用酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测AIH患者的AFA,并将检测结果与其他数据比较分析,现将结果报道如下。
1 资料与方法
1.1 一般资料收集2010年12月-2014年12月湖北省中医院确诊的163例AIH-Ⅰ型、15例AIH-Ⅱ型、36例AIH-Ⅲ型肝病患者临床资料及血清标本,AIH患者中凡伴有其他自身免疫性疾病如自身免疫性甲状腺炎、格雷夫斯病、干燥综合征、类风湿关节炎的均排除在外。另收集197名健康献血者标本作为对照组,收集血清后分装,-80 ℃冻存备用。研究对象均保留详细的临床资料,且签订知情同意书。
1.2 观察指标(1)临床表现:包括性别、年龄、临床症状;(2)影像学检查:观察患者初诊时肝脏情况;(3)血清生化指标检测:丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、血清总胆红素(TBil)、γ-谷氨酰转移酶(γ-GT)、球蛋白(GLO)、免疫球蛋白(IgA、IgM、IgG);(4)AIH自身抗体:ANA、AFA、ASMA;(5)肝脏组织病理学检查:AIH、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)、重叠综合征(AIDOS)患者于诊断前行肝穿刺活检,评价病理组织学特点。
1.3 方法
1.3.1 AIH的诊断:结合国际自身免疫性肝炎工作组(International AIH Group,IAIHG)1992年AIH诊断评分标准[6]、1999年AIH修订诊断评分标准[7]和2008年AIH简化评分标准[8]进行评分。主要内容有:(1)无遗传代谢类疾病(α1抗胰蛋白酶及血清铜蓝蛋白指标正常)、无活动性病毒感染、无饮酒或服用已知对肝脏有损伤的药物史;(2)AST、ALT显著升高,免疫球蛋白IgG升高大于正常上限;(3)自身抗体阳性,包括ANA、AFA、ASMA、抗LKM-1、抗LC-1、抗SCA/LP;(4)肝脏病理学表现以界面肝炎为主,无胆管的病理改变。
1.3.2 AIH分型:已经诊断的AIH患者参考相关标准[13],按照患者自身抗体的检测情况进行分型。
1.3.3 ELISA法检测AFA:选用美国INOVA公司提供的ELISA试剂,标本用标本稀释液1∶1稀释后加入50 μl于反应孔内,立即加入50 μl的生物素标记的抗体。盖上膜板轻轻振荡混匀,37 ℃温育1 h,甩去孔内液体,洗净拍干。每孔加入80 μl的亲和链酶素-HRP,37 ℃温育30 min。甩去孔内液体,洗净拍干。每孔加入底物A、B各50 μl,37 ℃温育10 min。取出酶标板迅速加入50 μl终止液,在450 nm波长处测定各孔的OD值。以吸光度OD值为纵坐标(Y),相应的α-ASMA标准品浓度为横坐标(X)获得相应曲线,根据OD值由标准曲线换算出浓度。浓度≥30 U判定为阳性,浓度<20 U判定为阴性,浓度20~30 U判定为可疑。
1.3.4 IFA法检测AFA和ASMA:AFA和ASMA试剂均为欧蒙(德国)医学实验诊断公司生产的Hep-2细胞生物薄片。选择Hep-2细胞、猴肝、大鼠肾、大鼠胃作基质的生物薄片,将待测血清稀释与基质常温孵育30 min,PBS缓冲液浸洗5 min,加异硫氰酸荧光素标记的抗体常温孵育30 min,PBS缓冲液浸洗5 min后封片,用荧光显微镜观察结果。
2 结果
2.1 一般情况及临床表现AIH-Ⅰ型组的平均年龄为(59.26±10.24)岁,AIH-Ⅱ型组为(66.54±8.21)岁,AIH-Ⅲ型组为(63.38±12.92)岁。AIH患者中女性多于男性(女男比例3.28∶1),大多隐袭性起病,临床症状及体征各异。常见症状包括乏力、恶心、呕吐、上腹部不适或疼痛、关节痛、肌痛、皮疹等。部分患者无明显临床症状及体征,只有在生化检查出肝功能异常后才发现。少数患者表现为急性、亚急性甚至暴发性起病。
2.2 AFA-ELISA、AFA-IFA和ASMA-IFA检测AIH患者结果统计IFA≥1∶320、ELISA≥30 U检测例数,AFA-ELISA检测AIH-Ⅰ型的阳性例数与AFA-IFA、ASMA-IFA比较,差异均无统计学意义(χ2=0.25,P=0.62;χ2=1.22,P=0.27);检测AIH-Ⅱ型的阳性例数与AFA-IFA比较,差异无统计学意义(χ2=0.24,P=0.62),但与ASMA-IFA比较,差异有统计学意义(χ2=5.0,P=0.03);检测AIH-Ⅲ型的阳性例数与AFA-IFA、ASMA-IFA比较,差异均无统计学意义(χ2=0.69,P=0.41;χ2=2.17,P=0.14);检测健康献血者的阳性例数与AFA-IFA、ASMA-IFA比较,差异均无统计学意义(χ2=0.34,P=0.56;χ2=0.20,P=0.65,见表1)。
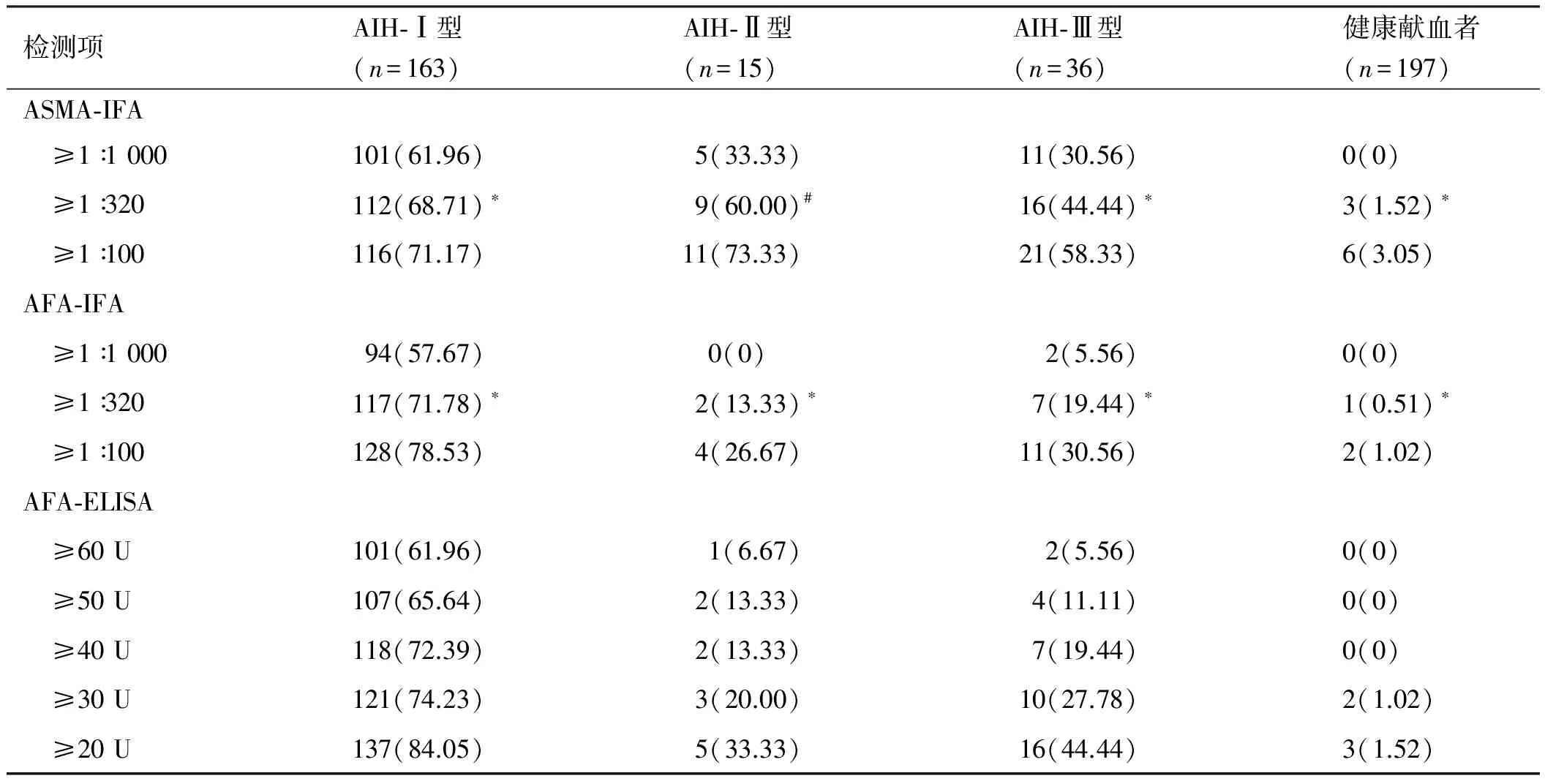
表1 AFA-ELISA、AFA-IFA和ASMA-IFA检测AIH患者结果[例数(%)]
注:以IFA≥1∶320、ELISA≥30 U分析同型AIH患者:*P>0.05、#P<0.05。
2.3 AFA-ELISA与AFA-IFA、ASMA-IFA检测AIH-Ⅰ患者结果相关性分析通过SPSS 19.0相关性分析,AFA-ELISA与不同滴度ASMA-IFA的相关性为:r=0.52,0.95%CI:0.17~0.81,P<0.05(见表2)。AFA-ELISA与不同滴度的AFA-IFA的相关性为:r=0.97,0.95%CI:0.93~0.99,P<0.001(见表3)。AFA-ELISA检测AIH-Ⅰ型与不同滴度的AFA-IFA、ASMA-IFA都有相关性,但与AFA-IFA的相关性更好(r=0.97vs0.52)。
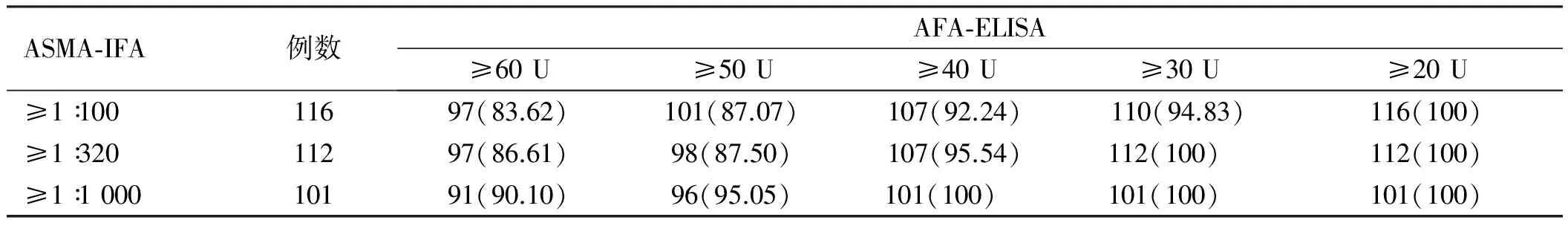
表2 AFA-ELISA对ASMA-IFA阳性AIH-I型患者检测结果 [例数(%)]
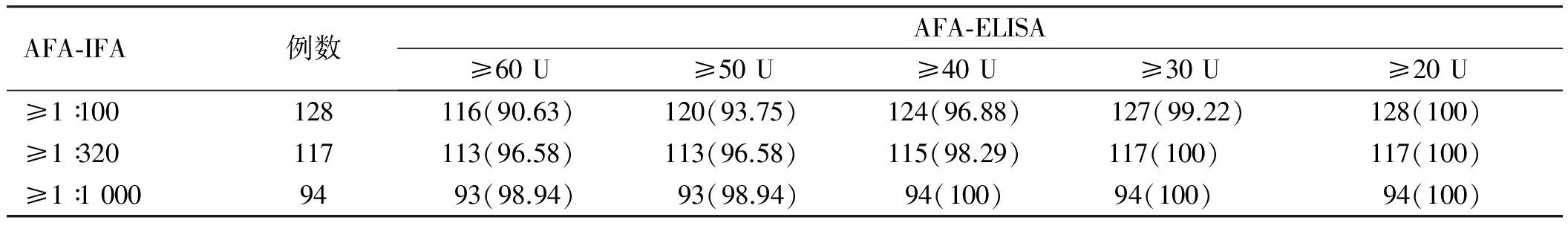
表3 AFA-ELISA对AFA-IFA阳性AIH-I型患者检测结果[例数(%)]
2.4 AFA-ELISA、AFA-IFA和ASMA-IFA检测AIH-Ⅰ型的性能评估将全部AIH作为统计对象,AFA-ELISA检出的真阳性数为124例、真阴性数为37例;AFA-IFA检出的真阳性数为116例、真阴性数为40例;ASMA-IFA检出的真阳性数为105例、真阴性数为31例。AFA-ELISA 与AFA-IFA相比,检测AIH-Ⅰ型有稍高的敏感性(76.07%vs71.17%)和略低的特异性(72.55%vs78.43%);AFA-ELISA与ASMA-IFA相比,检测AIH-Ⅰ型有更高的敏感性和特异性(76.07%vs64.42%,72.55%vs60.78%);AFA-ELISA检测AIH-Ⅰ型的约登指数与AFA-IFA相近(0.49vs0.50),比ASMA-IFA高(0.49vs0.25,见表4)。
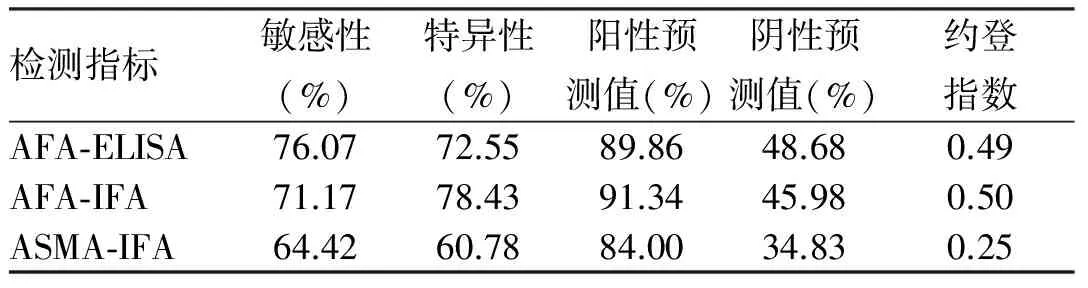
表4 AFA-ELISA、AFA-IFA和ASMA-IFA检测AIH-Ⅰ型的性能评估
2.5 AFA-ELISA检测AIH-Ⅰ型的ROC曲线运用SPSS 19.0统计软件绘制受试者工作曲线,以检测结果的1-特异性为横坐标,敏感性为纵坐标绘制曲线,曲线下面积为0.86,当浓度为54.06 U/ml时检测AFA-ELISA的敏感性、特异性最好(见图1)。
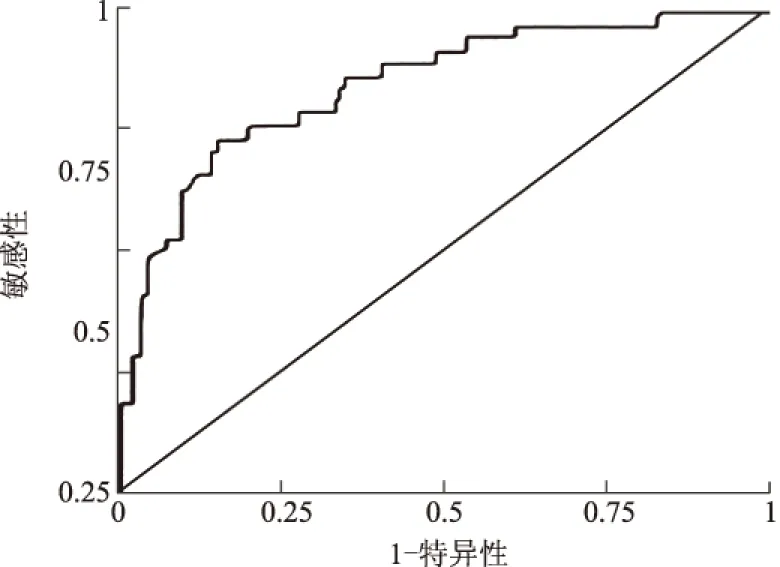
图1 AFA-ELISA检测AIH-Ⅰ型的ROC曲线
3 讨论
随着临床实践经验的积累和对AIH-Ⅰ型认识的提高,人们逐渐认识到AIH-Ⅰ型相关性自身抗体在AIH-Ⅰ型的诊断与分型中的重要作用[9]。AIH-Ⅰ型自身抗体的临床意义不仅体现在疾病诊断上,某些自身抗体在反映疾病活动度、监测病程、评价疗效和预后判断等方面也有重要参考指标[10-11]。
我国2010年自身免疫性肝病研讨会纪要对AIH诊断的结论:ANA或ASMA≥1∶40计1分,ANA或ASMA≥1:80计2分,≥6分为可能诊断为AIH,≥7分为确定诊断AIH[12]。我们的研究显示AFA-ELISA检测AIH与不同滴度的AFA-IFA、ASMA-IFA都有相关性,但与AFA-IFA的相关性更好(r=0.97vs0.52)。
ASMA是传统的用于AIH-Ⅰ型诊断的重要指标,ASMA可以识别包括微管、中间丝和微丝在内的多种细胞骨架成分,有文献[13]显示ASMA滴度越高,诊断AIH-Ⅰ型的敏感性越好,高滴度的ASMA对AIH-Ⅰ型诊断具有更好的灵敏度。平滑肌亚结构是微丝结构蛋白,以两种形式存在,即单体和多聚体,多聚体形成肌动蛋白丝,称为纤维状肌动蛋白(F-actin),近年使用AFA筛查AIH-Ⅰ型得到广泛的应用[14]。AFA是AIH-Ⅰ型相关荧光模型针对的主要靶抗原,根据IFA典型的AFA荧光模型诊断AIH-Ⅰ型,可获得比ASMA更佳的特异性和敏感性[15]。Grunwald等[16]研究得出ASMA对AIH-Ⅰ型检测的敏感性为16%,而AFA对AIH-Ⅰ型诊断的灵敏度为71%。以IFA≥1∶320、ELISA≥30 U为阳性判断标准,我们的研究结果显示除AFA-ELISA与ASMA-IFA检测AIH-Ⅱ型的阳性例数比较,差异有统计学意义外,AFA-ELISA与AFA-IFA、ASMA-IFA比较,检测其他AIH各型患者例数差异均无统计学意义。
临床上最常用的IFA被认为是检测自身抗体的金标准[17],然而AFA的操作及结果识别需要有一定经验的操作者,这可能导致AFA的检测质量下降。ELISA法由于其易实现自动化且不需要操作者的高技能水平,被越来越多地用来检测AFA。本文采用IFA和ELISA两种方法检测自身免疫疾病患者血清AFA,以IFA法作为金标准研究ELISA法检测AFA的性能,并探讨两者之间的相关性,发现AFA-ELISA检测AIH型与不同滴度的AFA-IFA、ASMA-IFA都有相关性,但与AFA-IFA的相关性更好(r=0.97vs0.52)。由于AFA-ELISA的检测方法简单易行,适合无IFA操作经验的人员开展工作,值得推广。
目前我国临床实验室检测AIH 自身抗体的质量不高,检测方法亟待规范[4-5],从我国154家实验室检测ASMA的统计结果可知IFA法检测ASMA的阳性符合率为57.3%,阴性符合率为96.8%[18],这个结果不是太理想,临床急需敏感性更高检测AIH-Ⅰ型的自身抗体。目前由于AIH-Ⅰ型的发病机制尚不清楚,自身抗体是病理损伤的结果还是原因尚无定论,所以自身抗体AFA检测只能作为AIH-Ⅰ型诊断的参考依据[19]。我们的研究显示AFA-ELISA 与AFA-IFA相比,检测AIH-Ⅰ型有稍高的敏感性(76.07%vs71.17%)和略低的特异性(72.55%vs78.43%);AFA-ELISA与ASMA-IFA相比,检测AIH-Ⅰ型有更高的敏感性和特异性(76.07%vs64.42%,72.55%vs60.78%);AFA-ELISA 检测AIH-Ⅰ型的约登指数与AFA-IFA相近(0.49vs0.50),比ASMA-IFA高(0.49vs0.25),AFA-ELISA检测AIH-Ⅰ型的ROC面积为0.86,按照ROC曲线评价标准(AUC在0.7~0.9时有较高的准确性),AFA-ELISA检测AIH-Ⅰ型的方法有可行性。
总之,AFA-ELISA检测AIH-Ⅰ型的敏感性和特异性比ASMA-IFA好,AFA-ELISA检测AIH-Ⅰ型与AFA-IFA的敏感性和特异性相近,但前者不需要操作者的高技能水平,因此,AFA-ELISA可作为AIH-Ⅰ型的较好筛查方法,值得推广应用。
[1]Sebode M, Lohse AW. Future perspective: immunomodulatory therapy for autoimmune hepatitis [J]. Dig Dis, 2014, 32(5): 502-506.
[2]Hadzic N, Hierro L. Autoimmune liver disease: novelties in management [J]. Clin Res Hepatol Gastroenterol, 2014, 38(3): 273-276.
[3]Cui X, Zhang X, Yin Q, et al. F-actin cytoskeleton reorganization is associated with hepatic stellate cell activation [J]. Mol Med Rep, 2014, 9(5): 1641-1647.
[4]Li LJ, Zhang SL, Li YZ. Analysis of external quality assessment of autoantibodies testing from 102 laboratories in 2009 in China [J]. Chin J Lab Med, 2012, 35(3): 265-270. 李丽君, 张蜀澜, 李永哲. 2009年我国102家医院实验室自身抗体检测室间质量评价分析[J]. 中华检验医学杂志, 2012, 35(3): 265-270.
[5]Hu CJ, Li YZ. Pay attention to the detection standardization and rational application of autoimmune liver disease relevant autoantibodies [J]. Chin J Lab Med, 2014, 37(2): 81-83. 胡朝军, 李永哲. 重视自身免疫性肝病相关自身抗体的规范检测与合理应用[J]. 中华检验医学杂志, 2014, 37(2): 81-83.
[6]Johnson PJ, McFarlane IG. Meeting report: international autoimmune hepatitis group [J]. Hepatology, 1993, 18(4): 998-1005.
[7]Alvarez F, Berg PA, Bianchi FB, et al. International autoimmune hepatitis group report: review of criteria for diagnosis of autoimmune hepatitis [J]. J Hepatol, 1999, 31(5): 929-938.
[8]Hennes EM, Zeniya M, czaja AJ, et al. Simplified criteria for the diagnosis of autoimmune hepatitis [J]. Hepatology, 2008, 48(1): 169-176.
[9]Czaja AJ. Diagnosis and management of autoimmune hepatitis [J]. Clin Liver Dis, 2015, 19(1): 57-79.
[10]Roep BO, Buckner J, Sawcer S, et al. The problems and promises of research into human immunology and autoimmune disease [J]. Nat Med, 2012, 18(1): 48-53.
[11]Bogdanos DP, Mieli-Vergani G, Vergani D. Autoantibodies and their antigens in autoimmune hepatitis [J]. Semin Liver Dis, 2009, 29(3): 241-253.
[12]Duan WJ, Zhang J, Jia JD, et al. Symposium on autoimmune liver disease [J]. Chin J Intern Med, 2010, 49(4): 339-341. 段维佳, 张炬, 贾继东, 等. 自身免疫性肝病研讨会纪要[J]. 中华内科杂志, 2010, 49(4): 339-341.
[13]Czaja AJ. Challenges in the diagnosis and management of autoimmune hepatitis [J]. Can J Gastroenterol, 2013, 27(9): 531-539.
[14]Villalta D, Bizzaro N, Da Re M, et al. Diagnostic accuracy of four different immunological methods for the detection of anti-AFA autoantibodies in type 1 autoimmune hepatitis and other liver-related disorders [J]. Autoimmunity, 2008, 41(1): 105-110.
[15]Jaskowski TD, Konnick EQ, Ashwood ER, et al. Prevalence of IgG autoantibody against AFA in patients suspected of having autoimmune or acute viral hepatitis [J]. J Clin Lab Anal, 2007, 21(4): 249-253.
[16]Grunwald D, Kothari D, Malik R. Noninvasive markers in the assessment and management of autoimmune liver diseases [J]. Eur J Gastroenterol Hepatol, 2014, 26(10): 1065-1072.
[17]Jeon YL, Kim MH, Lee WI, et al. Comparison of indirect immunofluorescence and line immunoassay for autoantibody detection [J]. Clin Exp Rheumatol, 2013, 31(1): 84-90.
[18]Deng CW, Hu CJ, Bai YN, et al. A multi-center comparison of smooth muscle autoantibodies and mitochondrial autoantibodies in 154 laboratories of China [J]. Chin J Lab Med, 2014, 37(2): 127-131. 邓垂文, 胡朝军, 白依娜, 等. 中国154家实验室检测抗平滑肌抗体和抗线粒体抗体的比对分析[J]. 中华检验医学杂志, 2014, 37(2): 127-131.
[19]Conrad K, Roggenbuck D, Reinhold D, et al. Autoantibody diagnostics in clinical practice [J]. Autoimmun Rev, 2012, 11(3): 207-211.
(责任编辑:王全楚)
Evaluation on anti-filamentous actin antibodies with the enzyme-linked immunosorbent assay in autoimmune hepatitis type I patients
LIU Ling1, HUANG Jie1, PENG Xiaoming1, XIAO Mingzhong2, LI Xiaodong2
1. Department of Clinical Laboratory; 2. Department of Liver Diseases, Hubei Provincial Hospital of TCM, Wuhan 430061, China
Objective To evaluate anti-filamentous actin antibodies (AFA) with the enzyme-linked immunosorbent assay (ELISA) in autoimmune hepatitis type I (AIH-Ⅰ) patients. Methods Two hundred and fourteen consecutive untreated AIH patients (163 cases of AIH-Ⅰ, 15 cases of AIH-Ⅱ, 36 cases of AIH-Ⅲ) and 197 blood donors (controls) from Dec. 2010 to Dec. 2014 were collected. AFA was detected with ELISA, detecting AFA and anti-smooth muscle antibodies (ASMA) with indirect immunofluorescence assay (IFA) were compared. The results were statistically analyzed with SPSS 19.0. Results There was significant difference in AIH-Ⅱ patients between AFA-ELISA and ASMA-IFA (P=0.03);there was no any significant difference in other AIH patients between AFA-ELISA and AFA-IFA or ASMA-IFA (IFA≥1∶320, ELISA≥30 U). AFA-ELISA was both correlated with different titers of AFA-IFA and ASMA-IFA, but the correlation was better in AFA-IFA than ASMA-IFA for AIH-Ⅰ patients (r=0.97vs0.52). In prospective analysis, AFA-ELISA showed a similar sensitivity, specificity and Youden index but operation easier than AFA-IFA. A superior sensitivity (76.07%vs64.42%), superior specificity (72.55%vs60.78%) and superior Youden index (0.49vs0.25) compared with ASMA-IFA. The area under the curve ofROCof AFA-ELISA was 0.86, and when the concentration was 54.06 U/ml, the detection sensitivity and specificity were the best. Conclusion AFA-ELISA is a useful diagnostic method in AIH-Ⅰ patients, which is easier operated than AFA-IFA, and superior sensitivity and specificity than ASMA-IFA.
Autoimmune hepatitis; Anti-filamentous actin antibody; Anti-smooth muscle antibody; Enzyme-linked immunosorbent assay; Indirect immunofluorescence assay

10.3969/j.issn.1006-5709.2016.06.016
国家中医临床研究基地业务建设科研专项课题基金(JDZX2012051)
刘玲,硕士,研究方向:肝病致病机理及临床诊断学
李晓东,主任医师,教授,研究方向:肝病。E-mail: deng13098855103@163.com
R575.1
A
1006-5709(2016)06-0658-05
2015-05-17

