缺氧条件下RhoA/Rho激酶及eNOS在血管内皮细胞表达的研究
金洪国,周敏,金美玉,寇雪莲,何松彬,唐维国(温州医科大学附属舟山医院 神经内科,浙江 舟山 316021)
缺氧条件下RhoA/Rho激酶及eNOS在血管内皮细胞表达的研究
金洪国,周敏,金美玉,寇雪莲,何松彬,唐维国
(温州医科大学附属舟山医院 神经内科,浙江 舟山 316021)
[摘 要]目的:建立稳定的体外细胞缺氧模型,探讨人体脐静脉内皮细胞(HUVEC)在缺氧条件下RhoA蛋白和Rho激酶对其内皮细胞内皮型一氧化氮合酶(eNOS)表达的影响。方法:利用jetPEI-HUVEC、siRNA分别转染SH-SY5Y细胞、HEK293细胞和HUVEC后制备体外细胞缺氧模型,通过细胞裂解对相关蛋白进行免疫印迹分析。结果:常氧条件下RhoA蛋白在HUVEC中表达水平较低,但在缺氧条件下培育5 h后表达增加,同时缺氧3 h后Rho激酶表达增加,5 h后达高峰,而eNOS的表达恰恰相反。缺氧条件下,活化型RhoA蛋白下调eNOS的表达,而siRNA使RhoA蛋白表达减少从而上调eNOS的表达;Rho结合域抑制Rho激酶活性而上调eNOS的表达。结论:RhoA蛋白和Rho激酶的表达及活化抑制内皮细胞中eNOS的表达,因此可以通过某些药物如他汀类或Rho激酶抑制剂,抑制RhoA蛋白和Rho激酶的活性,从而增加eNOS的表达水平,对心脑血管疾病产生保护作用。
[关键词]Rho激酶;内皮型一氧化氮合酶;内皮细胞;RhoA;siRNA
近年的研究提示小G蛋白RhoA在血管的各种细胞功能调控中起着重要的作用。ROCK2是RhoA的下游效应分子之一,是一种丝氨酸/苏氨酸蛋白激酶,与RhoA-GTP结合时即可被激活[1]。Rho激酶调节应力纤维形成,介导平滑肌细胞收缩、增殖和迁移[2]。最近有研究发现Rho激酶参与脑和冠状动脉痉挛[3-4]、高血压病[5]、血管炎症与重塑[6],以及动脉粥样硬化[7]的发生。在血管内皮细胞,L-精氨酸在内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)氧化催化作用下生成一氧化氮(NO)。NO不仅可以维持血管的正常状态和完整性,在调节血管张力和脑血流量方面也起着重要作用[8-9]。因此,提高eNOS表达,提升NO水平对脑血管疾病产生有益的影响[8,10-11]。Rho激酶可以下调eNOS的表达,影响NO的生成[12-13]。RhoA/Rho激酶调节eNOS表达的相关机制尚未见报道。本研究通过分子生物学方法,揭示缺氧条件下RhoA/Rho激酶调节eNOS在血管内皮细胞表达的相关机制。
1 材料和方法
1.1材料 SH-SY5Y细胞和HEK293细胞[美国典型培养物细胞库(American Type Culture)]培养在含有10%胎牛血清(FBS),100 U/mL青霉素和100 µg/mL链霉素的Dulbecco改良的Eagle氏培养基中。3种人体脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)细胞系(Kurabo公司,日本大阪)培育在Hu-media EB2(Kurabo公司)媒介质液中,内添2% FBS、10 ng/mL的人表皮生长因子、1 µg/mL氢化可的松、5 ng/mL人成纤维细胞生长因子β、10 µg/mL肝素、50 µg/mL庆大霉素和50 ng/mL两性霉素B。将细胞培育在37 ℃、5% CO2的培养箱中直到缺氧。
1.2试剂 Myc抗体、RhoA抗体、抗α-微管蛋白抗体、抗兔IgG-HRP(美国Santa Cruz公司);抗Rho/ ROCK2抗体、抗ROKβ/ROCK1抗体和抗eNOS抗体(美国Palo Alto公司);活化型RhoA的表达载体(pEFBOS-HA-RhoG14V)、完整的Rho激酶(pEF-BOS-Myc/Rho激酶)、活化型Rho激酶(CAT)、Rho结合域(RB)(日本名古屋大学Kozo Kaibuchi教授提供);转染试剂jetPEI-HUVEC(法国伊尔基希大学提供)。
1.3方法
1.3.1细胞转染:①DNA转染:转染前1 d,把计数1.5×105的HUVEC铺板在35 mm的细胞培养基中;对于每孔细胞,使用100 µL的0.9%氯化钠溶液稀释6 µg DNA;对于每孔细胞,使用100 µL 0.9%氯化钠溶液稀释12 µL转染试剂jetPEITM-HUVEC;混合稀释的DNA和稀释的jetPEITM-HUVEC充分混匀形成转染复合物;直接将复合物加入到每孔中,摇动培养板轻轻混匀;在37 ℃、5% CO2中保温4 h后更换生长培养基,再温育24 h。②siRNA转染:转染前1 d,把计数3×105的HUVEC铺板在35 mm的细胞培养基中;对于每孔细胞,使用175 µL的OptiMEM稀释375 pmol siRNA;对于每孔细胞,使用17 µL的OptiMEM稀释8 µL脂质体;混合稀释的siRNA和稀释的脂质体充分混匀形成转染复合物;直接将复合物加入到每孔中,摇动培养板轻轻混匀;在37 ℃、5% CO2中保温4 h,然后在500 µL含2% FBS的培养基中再温育24 h。
1.3.2建立缺氧模型[14]:缺氧诱导前24 h,将转染后的细胞接种在37 ℃、5% CO2、35 mm的培养基中。24 h后培养基换成厌氧培养基,将细胞置于37 ℃,N295%、CO25%的可控厌氧室中,厌氧室中的O2浓度用氧传感器监测且维持在低于1%。
1.3.3免疫印迹:在规定的时间内使细胞缺氧后,用冰冷的PBS洗涤细胞,转移至冰冷的含蛋白酶抑制剂(1 mmol/L苯甲基磺酰氟,10 µg/mL抑肽酶,10 µg/mL亮抑蛋白肽酶)的细胞裂解液(1%乙基苯基聚乙二醇,50 mmol/L三羟甲基氨基甲烷,pH=7.4,10%甘油,150 mmol/L 0.9%氯化钠溶液,1 mmol/L的EDTA,pH=8.0)中,进行免疫印迹[15]。用蛋白质测定试剂盒(美国加州海格立斯,Bio-Rad公司)检测裂解液中蛋白含量,细胞裂解液用样品缓冲液混合。取1 µg细胞总蛋白行聚丙烯酰胺凝胶电泳,然后转移到硝酸纤维素膜上,封闭后加入RhoA抗体(1∶1 000)、ROCK2抗体、抗eNOS抗体(1∶1 000)、抗α-微管蛋白抗体(1∶1 000)、或抗Myc抗体(1∶1 000)孵育;放置一定时间后弃一抗,洗膜后加入抗兔IgG-HRP(1∶5 000);一定时间后弃二抗,洗膜后加入显色液,用NIH图像处理系统分析目标带的分子量和净光密度值[12,14]。
1.4统计学处理方法 采用SPSS16.0统计软件进行统计学处理。计量资料用±s表示,组间比较用单因素方差分析进行分析;计数资料用Fisher精确概率法检验。P<0.05为差异有统计学意义。
2 结果
2.1缺氧对RhoA蛋白的影响 将人体不同组织来源的细胞系暴露于缺氧环境中,人表皮细胞系HEK293、神经元细胞系SH-SY5Y和人内皮细胞系HUVEC在常氧条件下培育24 h后置于厌氧室,把培养基换成厌氧培养基。在规定的时间内使细胞缺氧后,裂解细胞,进行免疫印迹。结果发现在常氧条件下HEK293细胞和SH-SY5Y细胞中可以检测到RhoA蛋白(见图1A),而HUVEC中RhoA蛋白表达水平较低;随着缺氧时间的延长,前两者RhoA蛋白表达逐渐减少(见图1A),而后者的表达逐渐增加(见图1B),作为基数对照[12]的α-微管蛋白表达水平在缺氧24 h后也无明显变化(见图1A)。对HUVEC中的RhoA蛋白用NIH图像处理系统进行分析,结果发现在相同的时间点RhoA蛋白表达水平比内参多,且RhoA蛋白的表达在缺氧5 h后显著增加(见图1C)。缺氧条件下不同组织来源的细胞RhoA蛋白表达模式不同,内皮细胞系与其他2个细胞系相比表现出不同的特点。
2.2缺氧对Rho激酶的影响 RhoA的下游效应分子之一ROCK2是一种丝氨酸/苏氨酸激酶[15],与RhoAGTP结合后即可被激活[16]。缺氧时HUVEC中RhoA蛋白表达水平增加,缺氧3 h后检测到Rho激酶(图1B),5 h后显著增加(见图1C)。ROCKs的另一种亚型ROKβ/ROCK1,在缺氧条件下也具有类似的表达模式。
2.3缺氧对eNOS的影响 eNOS的表达能调节血管内皮功能,因此在缺氧条件下也对其进行了研究。eNOS表达在缺氧3 h后才会发生改变,随着时间的延长逐渐下降(见图1C),与既往研究发现缺氧诱导eNOS蛋白表达水平下降的结果一致[13]。

图1 缺氧对不同来源细胞RhoA蛋白的影响
2.4缺氧条件下RhoA蛋白对eNOS的影响 用空载体(对照组)或活化型RhoA(RhoAG14V)的表达载体转染HUVEC。转染24 h后,将细胞置于常氧或缺氧条件下5 h,裂解细胞并进行免疫印迹,蛋白质表达水平以α-微管蛋白作为内参。缺氧条件下eNOS蛋白水平低于常氧条件(见图2A),与在图1B和1C中的结果相似。已有研究结果发现在哺乳动物细胞中,RhoAG14V可以激活Rho激酶[17]。在缺氧条件下,与用空载体转染的对照组细胞相比,用RhoAG14V表达载体转染的细胞eNOS表达水平明显下降(见图2A)。与对照组比,常氧条件下2组差异没有统计学意义(P>0.05),但用RhoAG14V表达载体转染的细胞eNOS表达水平也呈现下降趋势。
2.5RhoA蛋白对eNOS的影响 用非特异性siRNA(对照组)或RhoA siRNA转染HUVEC,24 h后将细胞在常氧或缺氧条件下培育5 h,然后用相同的方法进行免疫印迹。RhoA siRNA的转染可以明显抑制细胞中RhoA蛋白表达[18]。在缺氧条件下内皮细胞系eNOS的表达水平要比在常氧条件下低(见图2B),与对照组相比,在缺氧条件下抑制RhoA蛋白表达可以明显上调eNOS的表达(见图2B)。在常氧条件下2组差异无统计学意义(P>0.05),但抑制RhoA蛋白表达后eNOS蛋白表达水平呈现上升趋势。

图2 缺氧条件下RhoA蛋白对eNOS的影响
2.6缺氧条件下Rho激酶对eNOS的影响 通过阻止Rho激酶与RhoA结合而抑制内源性Rho激酶的活性(见图3A)。用图2的方法将细胞置于常氧或缺氧条件下5 h,Rho激酶表达载体转染的细胞,无论缺氧与否均可检测到Rho激酶(见图3B)。常氧条件下内源性Rho激酶几乎检测不到,而在缺氧条件下可以检测到(见图3B)。在缺氧和常氧条件下Rho结合域(RB)表达时eNOS表达水平明显增加(见图3C)。在常氧条件下,表达活性型Rho激酶(CAT)的细胞eNOS的表达呈现下降趋势,而在缺氧条件下,与对照组相比eNOS的表达明显下降(见图3C)。在常氧条件下表达Rho激酶的细胞中,eNOS蛋白表达与对照组类似,而在缺氧条件下呈现出下降趋势。
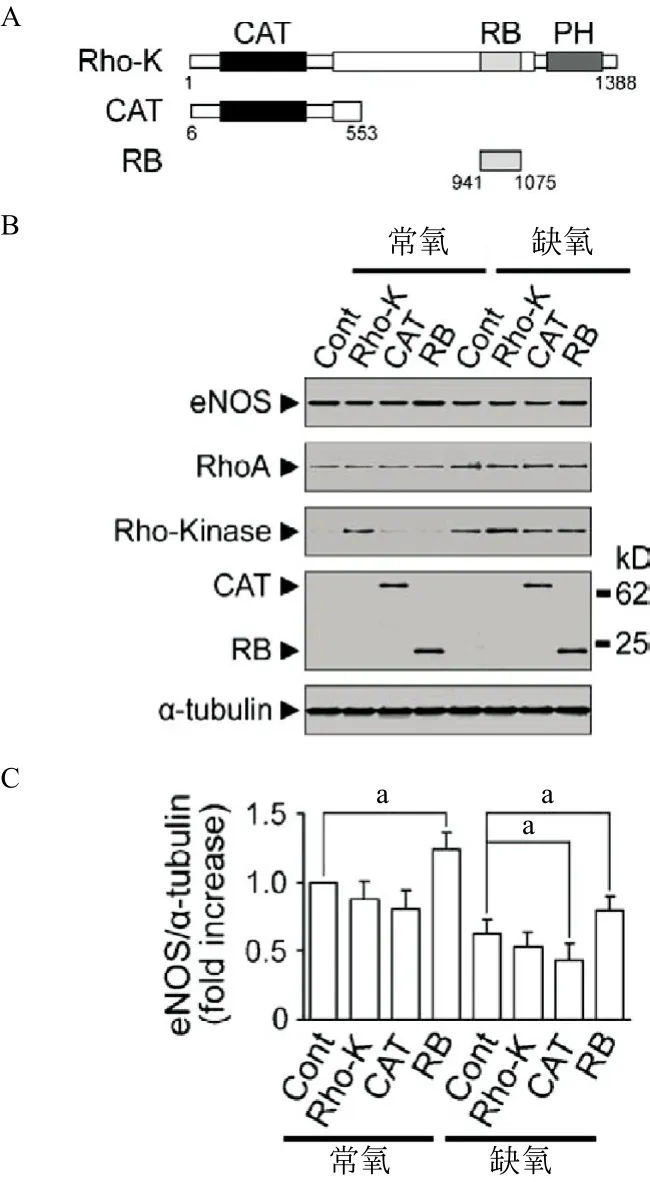
图3 Rho激酶一级结构示意图及Rho激酶对eNOS的影响
3 讨论
目前的研究结果表明,缺氧可以诱导内皮细胞系RhoA蛋白和Rho激酶水平上调从而抑制eNOS的表达,具体机制可能是由于在缺氧条件下,细胞能量耗竭,抑制需要ATP的泛素-蛋白酶体途径,从而抑制RhoA蛋白和Rho激酶的降解,增加一氧化氮合酶的活性,抑制血管收缩[19-20]。本研究中,定量分析结果发现,eNOS表达在缺氧5 h后显著减少。内皮细胞系RhoA/Rho激酶与eNOS的表达对缺氧的反应呈现相反的趋势。在缺氧条件下RhoA蛋白的表达对eNOS的表达起着负调控作用,在内皮细胞系缺氧诱导RhoA蛋白表达增加而eNOS表达减少,两者间有相互关联。在缺氧条件下,内皮细胞系RhoA蛋白的活性和表达可能会抑制eNOS表达。缺氧可以增加内源性RhoA蛋白的水平,且不受外源性RhoAG14V表达的影响。在常氧条件下无法检测到RhoA的下游效应分子Rho激酶,而在缺氧条件下Rho激酶与RhoA具有协同作用。
据报道,HMG-CoA还原酶抑制剂他汀类药物,通过抑制eNOS的mRNA表达,使RhoA蛋白的异戊二烯化作用受到抑制,在缺氧条件下减少eNOS的表达水平和活性[21]。与他汀类药物类似,在缺氧条件下Rho激酶抑制剂逆转eNOS表达[13]。Rho激酶抑制剂法舒地尔增加eNOS表达,从而增加eNOS活性和NO的生成[12,22]。既然RhoA蛋白和Rho激酶的表达及活化可以抑制内皮细胞eNOS的表达,那么可以尝试着通过某些药物下调RhoA蛋白和Rho激酶的活性,从而上调eNOS的表达水平,对心脑血管疾病产生保护作用。
参考文献:
[1]FEHÉR A,LAJKÓ D B. Signals fly when kinases meet Rhoof-plants (ROP) small G-proteins[J]. Plant Sci,2015,237: 93-107.
[2]AMIN E,DUBEY B N,ZHANG S C,et al. Rho-kinase: regulation,(dys)function,and inhibition[J]. Biol Chem,2013,394(11): 1399-1410.
[3]SATOH S,TAKAYASU M,KAWASAKI K,et al. Antivasospastic effects of hydroxyfasudil,a Rho-kinase inhibitor,after subarachnoid hemorrhage[J]. J Pharmacol Sci,2012,118 (1): 92-98.
[4]NARAOKA M,MUNAKATA A,MATSUDA N,et al. Suppression of the Rho/Rho-kinase pathway and prevention of cerebral vasospasm by combination treatment with statin and fasudil after subarachnoid hemorrhage in rabbit[J]. Transl Stroke Res,2013,4(3): 368-374.
[5]LOIRAND G,PACAUD P. Involvement of Rho GTPases and their regulators in the pathogenesis of hypertension[J]. Small GTPases,2014,5(4): 1-10.
[6]SHIMOKAWA H,SATOH K. 2015 ATVB Plenary Lecture: translational research on rho-kinase in cardiovascular medicine[J]. Arterioscler Thromb Vasc Biol,2015,35(8): 1756-1769.
[7]DONG M,JIANG X,LIAO J K,et al. Elevated rho-kinase activity as a marker indicating atherosclerosis and inflammation burden in polyvascular disease patients with concomitant coronary and peripheral arterial disease[J]. Clin Cardiol,2013,36(6): 347-351.
[8]LE GAL L,ALONSO F,MAZZOLAI L,et al. Interplay between connexin40 and nitric oxide signaling during hypertension[J]. Hypertension,2015,65(4): 910-915.
[9]LIU H,LI J,ZHAO F,et al. Nitric oxide synthase in hypoxic or ischemic brain injury[J]. Rev Neurosci,2015,26(1): 105-117.
[10]GARCIA-BONILLA L,MOORE J M,RACCHUMI G,et al. Inducible nitric oxide synthase in neutrophils and endothelium contributes to ischemic brain injury in mice[J]. J Immunol,2014,193(5): 2531-2537.
[11]WRAY D W,WITMAN M A,IVES S J,et al. Progressive handgrip exercise: evidence of nitric oxide-dependent vasodilation and blood flow regulation in humans[J]. Am J Physiol Heart Circ Physiol,2011,300(3): H1101-1107.
[12]FENG Y,LOGRASSO P V,DEFERT O,et al. Rho kinase (ROCK) inhibitors and their therapeutic potential[J]. J Med Chem,2016,59(6): 2269-2300.
[13]NODA K,GODO S,SAITO H,et al. Opposing roles of nitric oxide and rho-kinase in lipid metabolism in mice[J]. Tohoku J Exp Med,2015,235(3): 171-183.
[14]KANEKO Y,TAJIRI N,SHOJO H,et al. Oxygen-glucosedeprived rat primary neural cells exhibit DJ-1 translocation into healthy mitochondria: a potent stroke therapeutic target [J]. CNS Neurosci Ther,2014,20(3): 275-281.
[15]ALVAREZ-CASTELAO B,CASTAÑO J G. Synphilin-1 inhibits alpha-synuclein degradation by the proteasome[J]. Cell Mol Life Sci,2011,68(15): 2643-2654.
[16]LIAO Y C,LIU P Y,LIN H F,et al. Two functional polymorphisms of ROCK2 enhance arterial stiffening through inhibiting its activity and expression[J]. J Mol Cell Cardiol,2015,79: 180-186.
[17]GUAN R,XU X,CHEN M,et al. Advances in the studies of roles of Rho/Rho-kinase in diseases and the development of its inhibitors[J]. Eur J Med Chem,2013,70: 613-622.
[18]ABRAHAM S,SCARCIA M,BAGSHAW R D,et al. A Rac/Cdc42 exchange factor complex promotes formation of lateral filopodia and blood vessel lumen morphogenesis [J]. Nat Commun,2015,6: 7286.
[19]DENNIFF M,TURRELL H E,VANEZIS A,et al. The timeof-day variation in vascular smooth muscle contractility depends on a nitric oxide signalling pathway[J]. J Mol Cell Cardiol,2014,66: 133-140.
[20]ODAGIRI K,WATANABE H. Effects of the Rho-kinase inhibitor,fasudil,on pulmonary hypertension[J]. Circ J,2015,79(6): 1213-1214.
[21]DI LORENZO A,LIN M I,MURATA T,et al. eNOS-derived nitric oxide regulates endothelial barrier function through VE-cadherin and Rho GTPases [J]. J Cell Sci,2013,126(Pt24): 5541-5552.
[22]顾玲佳,倪连松. 法舒地尔对高糖培养肾小管上皮细胞增殖和纤维化的影响[J]. 温州医科大学学报,2014,44(10):723-726.
(本文编辑:吴彬)
Study on the expression of RhoA/Rho-kinase and eNOS in vascular endothelial cells under hypoxic condi-tion
JIN Hongguo,ZHOU Min,JIN Meiyu,KOU Xuelian,HE Songbin,TANG Weiguo. Department of Neurology,Zhoushan Hospital Affiliated to Wenzhou Medical University,Zhoushan,316021
Abstract:Objective: To establish stable hypoxic model in vitro and to explore the effect of RhoA protein/ Rho-kinase in human umbilical vein endothelial cell,(HUVEC) on eNOS expression of its endothelial cell under hypoxic condition. Methods: SH-SY5Y cells,HEK293 cells and HUVEC were respectively transfected using jet-PEI-HUVEC and siRNA to prepare cellular hypoxic model,the Western blotting analysis was preformed for the related proteins through cellular lysis. Results: RhoA protein levels in HUVEC were low under normoxic conditions,but were significantly increased after 5 h of hypoxia. Endothelial Rho-kinase expression was not detected until 3 h of hypoxia; such expression remained significantly increased after 5 h. On the other hand,endothelial eNOS expression was similar after 3 h of hypoxia,but was significantly decreased after 5 h. The hypoxiainduced decrease in eNOS expression was significantly enhanced by expression of the constitutively active form of RhoA and significantly inhibited by suppression of RhoA expression by small interfering RNA. The hypoxiainduced decrease in eNOS expression was significantly inhibited when endogenous Rho-kinase activation was inhibited by Rho-binding domain expression. Conclusion: Expression and activation of RhoA and Rho-kinase inhibit eNOS expression in endothelial cells,attempts to down-regulate RhoA and Rho-kinase by multiple drugs,such as statins or Rho-kinase inhibitors,might provide endothelial and cardiovascular benefits through upregulation of eNOS.
Key words:Rho-kinase; eNOS; endothelial cell; RhoA; siRNA
通信作者:唐维国,主任医师,Email:tangweiguo2003@163. com。
作者简介:金洪国(1974-),男,吉林延边人,副主任医师,博士。
基金项目:浙江省医药卫生一般研究计划项目(2015KYA227)。
收稿日期:2016-01-15
[中图分类号]R743.9
[文献标志码]A
DOI:10.3969/j.issn.2095-9400.2016.05.002

