微生物红外鉴定仪在结冷胶高产菌株选育中的应用探索
汪 钊,徐 力,魏 春(浙江工业大学生物工程学院,浙江杭州310014)
微生物红外鉴定仪在结冷胶高产菌株选育中的应用探索
汪钊,徐力,魏春
(浙江工业大学生物工程学院,浙江杭州310014)
摘要:利用利福平等抗生素对结冷胶生产菌株Sphingomonas elodea WZW002进行诱变处理,同时根据傅立叶红外光谱(FTIR)原理,对微生物红外鉴定谱图进行归一化和基线校正的处理,对比特征峰的吸收强度以及朗伯比尔定律分析糖组分,建立了高效筛选结冷胶高产菌株的方法。筛选得到一株结冷胶高产菌株,产量为17.21 g/L,较原始菌株提高5.8%。
关键词:结冷胶;FTIR;筛选;多糖
结冷胶是由革兰氏阴性菌少动鞘氨醇单胞菌(Sphingomonas elodea ATCC31461)在有氧条件下发酵生产的一种新型胞外多糖(Exopolysaccharide,EPS)[1],它以独有的流变特性,广泛的pH适用性以及使用安全性,在食品、医药、化工等领域具有广阔的应用前景。结冷胶具有极好的热稳定,耐酸碱及其他独特的理化性质,其出色的增稠性、假塑流变性、凝胶性、稳定性使其应用领域广泛,应用价值逐步提高[2-3]。菌株是发酵工业生产中最为关键的一环,目前结冷胶生产中缺乏优良的发酵菌株,国内外的研究主要集中于对现有高产结冷胶菌株进行遗传改造,如物理诱变、化学诱变、分子生物学技术改造等得到高产菌株,提高结冷胶的产量是目前一大研究重点。
1991年,Naumann等在Nature杂志中指出傅立叶变换红外光谱法具有判别、分类和鉴别微生物的能力[4]。随后关于傅立叶变换红外光谱法在微生物中的应用也相继开展[5-8]。FTIR技术以未损伤细胞的FTIR光谱的特殊指纹区为基础,光谱反映的是整个细胞组成分子的振动特征,也就是蛋白质、核酸等物质的特征,因此可以区分生化信息上的差别。根据微生物红外光谱原理,本文结合已有文献报道,建立了结冷胶高产菌株的筛选方法,提高高产菌株筛选效率。
1 材料和方法
1.1供试菌株
Sphingomonas sp.WZW002。
1.2主要仪器
红外光谱分析仪,Tensor27德国布鲁克公司;数字黏度计,NDJ-8LN上海精科。
1.3培养基
1.3.1种子培养基
蛋白胨10 g/L,牛肉膏5 g/L,NaCl 5 g/L,pH 7.0~7.2,121℃灭菌20 min。
1.3.2发酵培养基
蔗糖40 g/L,豆饼粉6.0 g/L,KH2P042.0 g/L,MgSO40.8 g/L,CaCO31.0 g/L,pH 7.0~7.2,121℃灭菌20 min。
1.4微生物红外光谱样品处理方法
菌株诱变采用抗生素筛选方法,利用不同浓度利福平诱变筛选结冷胶生产菌株。采集诱变后菌种单菌落,制备悬浊液,用生理盐水洗涤3次,去除培养基中的琼脂及菌落附带的杂质,吸取一定量转移至样品板。点样分析板置于干燥箱内,40℃恒温常压干燥制备菌膜。菌膜应该呈现干燥而且保持均匀的状态以待分析。
1.5分析方法
1.5.1红外光谱分析方法

表1 不同波长扫描下的消光系数[9]
利用傅立叶红外光谱对菌种进行鉴定,主要采用的是定性分析方法,包括主成分分析方法以及聚类分析方法,该种方法能够反映菌种的生化信息,但是不能够精确反映菌种各物质之间成分的区别及含量。有研究表明各物质在不同波长下的吸收值与物质浓度以及物质在该波长下的消光系数有密切联系[10]。根据朗伯-比尔定律推出:
A(v)=ε1(v)Cpd+ε2(v)CCad+ε3(v)CNad+ε1(v)CLd
A(v)表示在波数v下的吸收值;ε(v)表示在波数v下的消光系数;Cp、CCa、CNa、CL分别表示蛋白质、糖类、核酸、脂质的浓度。
1.5.2发酵液黏度测定[11-12]
NDJ-8SN型旋转式黏度计,室温条件下用4#转子在12 r/min条件下测定。
1.5.3结冷胶含量测定[13-14]
将去除菌体和杂质后的上清液用2倍体积的95%乙醇提取结冷胶,经过滤后取沉淀物60℃烘干至恒重后测定干重。产胶率为结冷胶干重与发酵液体积的比值,单位g/L。
2 结果与讨论
2.1各类菌株红外扫描谱图比较
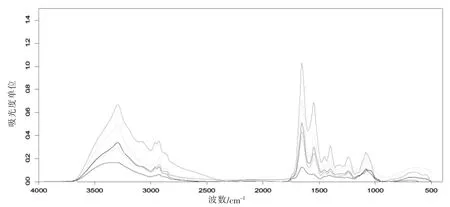
图1 不同菌种红外扫描图谱
各类菌种在蛋白质、脂肪酸、多糖等特定位点都具有很强的吸收值,但吸收强度显差异,通过这些差异进而可以分析各菌株的生理状况。各类菌种利用在2 800~3 000 cm-1细胞膜上脂肪酸的特征吸收强弱区分依次为大肠杆菌、金黄色的葡萄球菌、酵母菌、Sphingomonas sp.WZW002、乳酸菌。谱图一般采取两种技术处理手段:基线校正,以避免基线偏移导致的光谱差异;归一化,以消除样品量不同带来的光谱差异。通过基线校正和归一化处理可以对比各菌株之间的相对吸收大小。不仅可以比较不同菌株之间的差异,同类诱变菌株亦可以通过红外扫描图谱区分差异。
2.2菌株重复性扫描图谱
红外光谱处理微生物具有高度的灵敏性、便捷性,图2分别是3次红外光谱处理原始菌株结果拆分图。图中可以看出:波数2 930附近有显示脂肪酸的—CH3的对称、反对称伸缩运动产生的吸收峰;波数1 540和1 655处的谱带主要来自蛋白质酰胺II带和酰胺I带;1 100波数下多糖特征峰吸收强度最大。对3次平行数据进行比对,谱图具有很高的重合度,保证了红外光谱处理微生物的可重复性。

图2 原始菌株红外扫描重复性图谱
2.3结冷胶产量对多糖特征峰的影响
波数900~1 200是多糖类物质的典型吸收带,菌体中多糖的含量直接影响到红外吸收的强弱。在检测的菌悬液中添加微量的结冷胶成品,对比菌株吸收图谱图3(a),可以观察到高含量多糖对谱图的影响作用。图3(b)中,添加结冷胶成品的试样,多糖吸收特征峰明显加强,但是脂肪酸吸收峰以及蛋白质吸收峰明显减弱。初步分析是由于结冷胶的凝胶以及增稠作用,对菌体起到了包埋的作用,使菌膜不能够充分得到分析,红外的反射受到影响。
利用不同蔗糖质量分数(4%、2%、1%、0.5%、0.25%)的培养基培养菌体可以得到产胶量相对有差异的菌体生理状态,蔗糖浓度对结冷胶产量有影响是通过实验证实的。4%的高糖平板培养菌体吸收峰明显高于其他蔗糖梯度,其生理状况比较活跃,在蛋白质及脂肪酸吸收峰上也明显高于其他梯度平板。蔗糖浓度较低,区分度就相对较差,如2%与1%梯度平板,很难区分多糖吸收条带上的强弱。造成该种现象一方面是由于菌体代谢比较接近,另一方面是由于红外光谱仪器存在一定误差。对于该种情况,就需要用到上述所提定量区分法加以甄别。图3~4充分说明高产菌株可以通过观察菌株在特征峰上的吸收值加以区分。
2.4高产菌株的获得及摇瓶发酵验证
利用红外光谱对菌株进行测定,图5为筛选中典型的菌株谱图。表2中是各菌株在特定波数下的吸收值,与原始菌株相比吸收强度有明显波动。通过吸收强度比较,H46号菌株在多糖吸收条带上吸收强度比原始菌株有所提高,是提高结冷胶产量的潜在菌株,Z12、Z36、H04号菌株在多糖吸收条带上明显弱于原始菌株。综合分析上述菌株,采用朗伯比尔定律进行组分对比,同时对潜在菌株进行摇瓶发酵验证,得到H46号菌株糖组分相对含量亦高于原始菌株,发酵摇瓶实验也验证该菌株结冷胶产量比原始菌株提高5.8%。通过表3对比Z36和H04发现,在1 080波数下,Z36吸收值低于H04,但是具体糖组分分析过程中Z36高于H04,同时符合摇瓶发酵结冷胶产量Z36高于H04。出现该种情况的原因可能是红外谱图处理样品具有高精密性,样品试样不均匀或者杂质带入都会影响分析结果,故需要糖组分分析以保证分析的准确性。
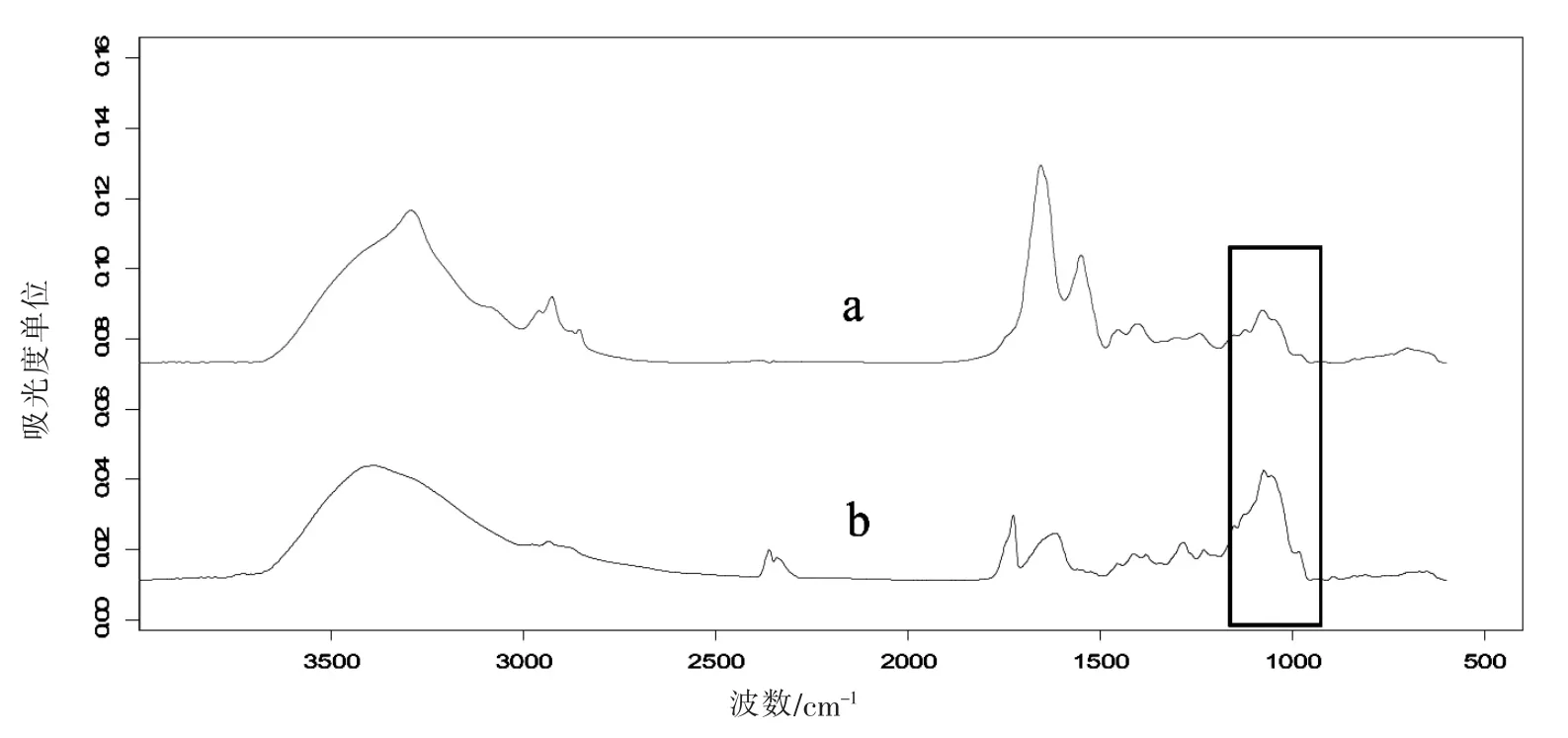
图3 结冷胶对多糖特征峰的影响
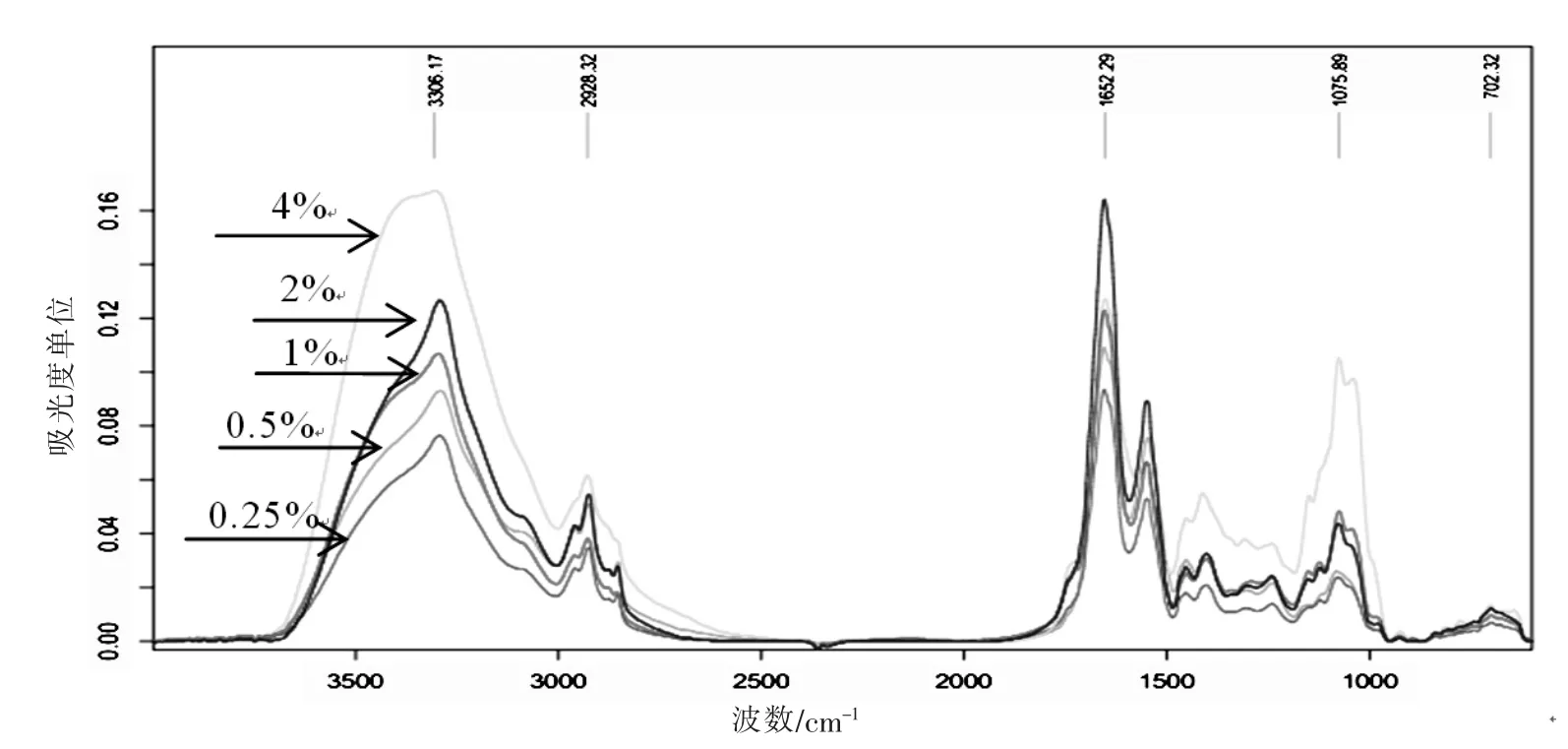
图4 不同蔗糖浓度培养条件下菌体红外扫描图谱

图5 筛选得到结冷胶菌株红外扫描图谱
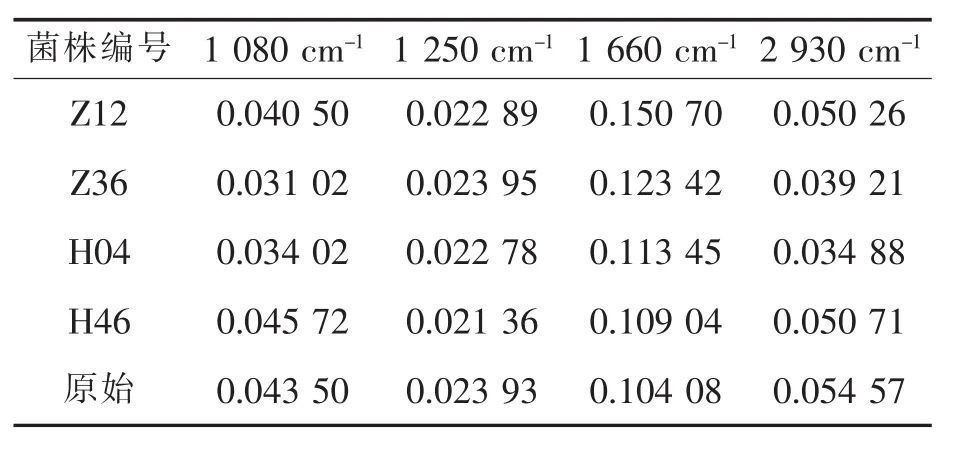
表2 结冷胶菌株在不同特征峰下吸收值

表3 不同结冷胶菌株糖组分对应含量与产量对比
2.5高产菌株的传代稳定性实验
表4为高产菌株H46传代发酵实验结果,在产胶量以及黏度上波动都不大,具有很好的传代性,可作为性能稳定的产结冷胶发酵菌株。
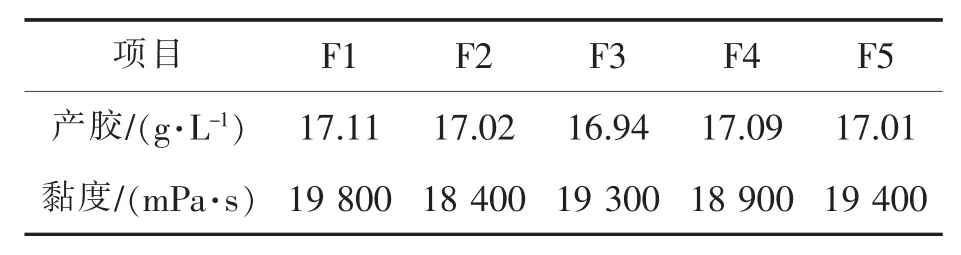
表4 高产菌株的传代稳定性实验
3 结 论
采用传统的醇沉烘干测干重的检测方法筛选结冷胶高产菌株,不仅周期长、效率低,同时投入相对较大,不能真正达到高效筛选结冷胶高产菌株的目的。傅立叶微生物红外鉴定仪(FTIR)目前主要运用在菌株鉴定和分类上,FTIR技术以未损伤细胞的FTIR光谱的特殊指纹区为基础,光谱反映的是整个细胞组成分子的振动特征,也就是蛋白质、核酸等物质的特征,因此可以区分生化信息上的差别。本文根据FTIR技术原理对诱变菌株的生化信息进行测定,从而推断菌株的生理状况,结合朗伯-比尔定律对各成分进行分析比对,探索建立高通量筛选高产结冷胶菌株的方法。利用该方法筛选得到一株结冷胶高产菌株,产量为17.21 g/L,较原始菌株提高5.8%。
参考文献:
[1]BANIK R M,KANARI B,UPADHYAY S N,Exopolysaccharide of gellan family:prospects and potential[J]. World journal of microbiology and biotechnology,2000,16(5):407-414.
[2]GIAVASIS I,HARVEY L M,MCNEIL B,gellan gum[J].Critical reviews in biotechnology,2000,20(3):177-211.
[3]DONER L W. Rapid purification of commercial gellan gum to highly soluble and gellable monovalent cation salts[J]. Carbohydrate polymers,1997,32(3/4):245-247.
[4]NAUMANN D,HELM D,LABISCHINSKI H,Microbiological characterization by FTIR spectroscopy[J]Nature,1991,351(6321):81-82.
[5]慈云祥,藏凯赛,高体玉.几种微生物的红外光谱研究[J].高等学校化学学报,2002,23(6):1047-1049.
[6]聂明,罗江兰,包衍,等.镰刀菌的傅里叶变换红外光谱鉴别[J].光谱学与光谱分析,2007,27(8):519-522.
[7]SANTOS C,FRAGA ME,KOZAKIEWICZ Z,et,al. Fourier transform infrared as a powerful technique for the identification and characterization of filamentous fungi and yeasts[J]. Research in microbiology,2010,161(2):168-175.
[8]WAGNER H,DUNKER S,LIU Z,et,al. Subcommunity FTIR-spectroscopy to determine physiological cell states[J]. Current opinion in biotechnology,2013,24(1):88-94.
[9]GRUBE M,ZAGREBA E,GROMOZOVA E,et al. Comparative investigation of the macromolecular composition of mycelia forms Thielavia terrestris by infrared spectroscopy[J]. Vibrational spectroscopy,1999,19(2):301-306.
[10]SHENG Guoping,YU Hanqing,WANG Chengming. FTIR -spectral analysis of two photosynthetic H-2-producing strains and their extracellular polymeric substances[J]. Applied microbiology and biotechnology,2006,73(1):204-210.
[11]陈亚敏.结冷胶发酵生产工艺技术优化研究[D].杭州:浙江大学.
[12]JAY A J,COLQUHOUN I J,RIDOUT M J,et al. Analysis of structure and function of gellans with different substitution patterns[J]. Carbohydrate polymers,1998,35(3/4):179-188.
[13]GIAVASIS I,HARVEY L M,MCNEIL B. The effect of agitation and aeration on the synthesis and molecular weight of gellan in batch cultures of Sphingomonas paucimobilis[J]. Enzyme and microbial technology,2006,38(1/2):101-108.
[14]WILLOUGHBY L E,KASSPIS S. The influence of sucrose upon the gelation of gellangum in large deformation compression analysis[J]. Food science and technology,1994(8):227-233.
(责任编辑:朱小惠)
Application of FTIR in screening of high-yield gellan gum producing strains
WANG Zhao,XU Li,WEI Chun
(College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:A gellan gum producing strain Sphingomonas sp.WZW002 was mutated by rifampicin. Based on infrared spectrum(FTIR)identification,and lambert beer law analysis,a high-throughput screening method was established. A mutant strain with high productivity was screened and the yield of gellan gum reached 17.21 g/L,which increased by 5.8%comparing with the wild type strain.
Keywords:gellan gum;FTIR;screen;polysoccharide
作者简介:汪钊(1960—),男,安徽歙县人,教授,研究方向为酶技术及应用、发酵工程,E-mail:hzwangzhao@163.com.通信作者:汪钊教授,E-mail:hzwangzhao@163.com.
收稿日期:2015-04-16
中图分类号:Q93
文献标志码:A
文章编号:1674-2214(2016)02-0065-05