老黄酶和甲酸脱氢酶催化柠檬醛不对称还原生成香茅醛的条件优化
应向贤,胡宝军,周宇杭,高 亮,孟淑敏(浙江工业大学生物工程学院,浙江杭州310014)
老黄酶和甲酸脱氢酶催化柠檬醛不对称还原生成香茅醛的条件优化
应向贤,胡宝军,周宇杭,高亮,孟淑敏
(浙江工业大学生物工程学院,浙江杭州310014)
摘要:源自酿酒酵母的老黄酶基因oye2和源自假丝酵母的甲酸脱氢酶基因fdhcb分别成功地在大肠杆菌BL21(DE3)中过量表达。重组表达的老黄酶OYE2和甲酸脱氢酶FDHCB经Ni-NTA亲和层析获得相应的纯酶。以这两种纯酶构建不对称还原柠檬醛生成香茅醛的催化体系,并优化了其反应条件。优化后的反应体系含有25 mmol/L柠檬醛,100 mmol/L甲酸钠,0.42 mg/mL老黄酶OYE2,0.2 U/mL甲酸脱氢酶FDHCB,0.5 mmol/L NAD+以及50 mmol/L PIPES缓冲液(pH 7.0)。在pH 7.0和30℃下反应10 h,香茅醛得率达92.0%,与没有甲酸脱氢酶辅助辅酶循环时的得率(9.8%)相比,香茅醛得率提高了约9.4倍。
关键词:老黄酶;甲酸脱氢酶;柠檬醛;香茅醛;不对称还原;辅酶循环
L-薄荷醇具有新鲜并带有刺激性甜味,还有强烈的清凉作用,工业价值巨大[10],而(R)-香茅醛是L-薄荷醇的工业生产中的关键中间产物之一。日本高砂公司以月桂烯为底物,合成(R)-香茅醛,再异构化成L-胡异薄荷醇,再进一步加氢得到高纯度的L-薄荷醇。该化学法工业化合成L-薄荷醇已应用多年,但仍然存在催化剂昂贵、得率不高等问题。鉴于此,开发化学法的替代工艺具有较高的应用价值。老黄酶催化柠檬醛的不对称还原可生成香茅醛。柠檬醛有顺式(Z)和反式(E)两种立体构型,在老黄酶的催化下,它们的产物分别是(R)-香茅醛和(S)-香茅醛[11]。当前,老黄酶催化不对称合成香茅醛仍具有诸多难点,如酶活力较低、底物耐受性差、产物光学纯度不高等。
本文以源自酿酒酵母的老黄酶OYE2作为催化剂,以Candida boidinii ATCC32195的甲酸脱氢酶FDHCB作为辅酶循环驱动力,构建酶法不对称还原柠檬醛生成香茅醛的催化体系(图1)。在此基础上,为了提高香茅醛得率对反应体系的各因素如pH、温度、辅底物浓度、双酶比例、辅酶浓度以及底物浓度等进行了优化。

图1 OYE2与FDHCB催化柠檬醛生成香茅醛示意图
1 材料与方法
1.1材料
1.1.1菌株和载体
酿酒酵母为实验室保藏菌株;宿主菌Escherichia coli BL21(DE3)是实验室已有资源;大肠杆菌Trans-T1克隆宿主菌和载体pEASYE1购自于北京全式金(TransGen Biotech)生物技术有限公司;FDHCB,甲酸脱氢酶基因来自于C. boidinii ATCC32195,是由Slusarczyk等对原始基因进行Cys23Ser和Cys262Ala改造,得到的更稳定的突变子[12],该基因由上海旭冠生物科技有限公司合成,载体为pET-28b,插入克隆位点为Nde I和Xho I。
1)要对现有的计算机软件进行改造,确保原有和单机运行的软件可以在网络环境下顺利运行,并借助网络传输提供必要条件的文件;
1.1.2试剂
TransStart Taq DNA聚合酶和dNTPs均购自北京全式金生物技术有限公司;用于基因组提取、质粒提取、DNA胶回收和PCR产物纯化的试剂盒均购自大连TaKaRa公司;辅酶NAD+购自上海申能博彩公司。
1.1.3引物
根据酿酒酵母基因组中老黄酶基因oye2设计PCR扩增老黄酶基因的引物为:上游引物:5′-ATGCCATTTGTTAAGGACTTTA-3′,下游引物:5′-TTAATTTTTGTCCCAACCGA-3′。引物由上海桑尼生物科技有限公司合成。
1.1.4培养基
LB培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,用NaOH调节pH至7.0~7.5。固体培养基添加20 g/L的琼脂粉,121℃灭菌20 min。
LB/Amp培养基:灭菌后的LB培养基加入氨苄青霉素(Amp)至终浓度100 μg/mL。
LB/Kan培养基:灭菌后的LB培养基加入卡纳霉素(Kan)至终浓度100 μg/mL。
1.2方法
1.2.1老黄酶基因oye2的克隆
老黄酶基因oye2以酿酒酵母基因组DNA为模板,扩增条件为:94℃预变性10 min;94℃变性30 s,56℃复性30 s,72℃延伸2 min,反应循环数为35;72℃后延伸10 min。扩增后用0.8%的琼脂糖凝胶电泳检测并回收。纯化后的PCR产物与载体pEASY-E1相连,连接产物转入50 μL Trans-T1感受态细胞中,具体操作参照pEASY-E1Expression Kit说明书。利用菌落PCR方法检测并确定阳性克隆子,取鉴定正确的克隆子送至上海桑尼生物科技有限公司测序。将测序所得的基因与GenBank中对应的基因序列进行比对分析,将含有正确片段的质粒命名为pEASY-E1-oye2。
1.2.2老黄酶OYE2和甲酸脱氢酶FDHCB的表达和纯化
酿酒酵母老黄酶OYE2的表达和分离纯化,参见蜡样芽孢杆菌烯醇还原酶的表达和分离纯化流程[9]。
除了筛选基因重组菌的抗性平板中所用的抗生素是Kan外,甲酸脱氢酶FDHCB的表达和纯化流程与上述流程一致。
1.2.3催化体系及气相色谱检测条件
标准的催化体系总体积1 mL,分别包括20 mmol/L柠檬醛,0.5 mmol/L NAD+,100 mmol/L甲酸钠,0.42 mg/mL OYE2,0.2 U/mL FDHCB,以及50 mmol/L PIPES缓冲液(pH 7.0)。不对称还原反应的优化在转速为200 r/min水浴摇床上进行。
底物柠檬醛和产物香茅醛的气相色谱(Agilent 6890N)检测条件如下:手性柱BGB-174,30 m×250 μm×0.25 μm;检测器:FID,250℃;载气:N2,33 mL/min;空气流量:300 mL/min;氢气流量,30 mL/min;分流比:1:30;进样量:1 μL;进样口温度:250℃;柱温条件:40℃保持1 min,4 ℃/min升温至120℃,保持1 min,20℃/min升温至180℃,保持3 min。在上述色谱条件下,(Z)-柠檬醛、(E)-柠檬醛、(S)-香茅醛、(R)-香茅醛出峰时间分别为24.90、25.49、22.55和22.61 min。
2 结果与讨论
2.1老黄酶OYE2和甲酸脱氢酶FDHCB的表达和纯化
以酿酒酵母的基因组为模板成功克隆得到老黄酶基因oye2,所获得的老黄酶基因oye2通过TA克隆与载体pEASY-E1相连得到重组质粒pEASY-E1-oye2。将得到的重组质粒导入宿主菌E. coli BL21(DE3)感受态细胞中获得重组菌E. coli BL21/pEASY-E1-oye2。对重组菌E. coli BL21/ pEASY-E1-oye2和E. coli BL21/pEASY-E1-fdhcb加入IPTG诱导剂分别进行低温诱导表达。离心收集过量表达目的蛋白老黄酶OYE2和甲酸脱氢酶FDHCB的菌体,经超声破碎和离心去除细胞碎片后获得粗酶液。粗酶液经Ni-NTA亲和层析分离纯化分别获得了纯度较高的目的蛋白老黄酶OYE2和甲酸脱氢酶FDHCB,经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测均为单一条带。重组OYE2 与FDHCB均为可溶性蛋白,其分子量分别为40.5 kD和39.0 kD,与理论相符(图2)。
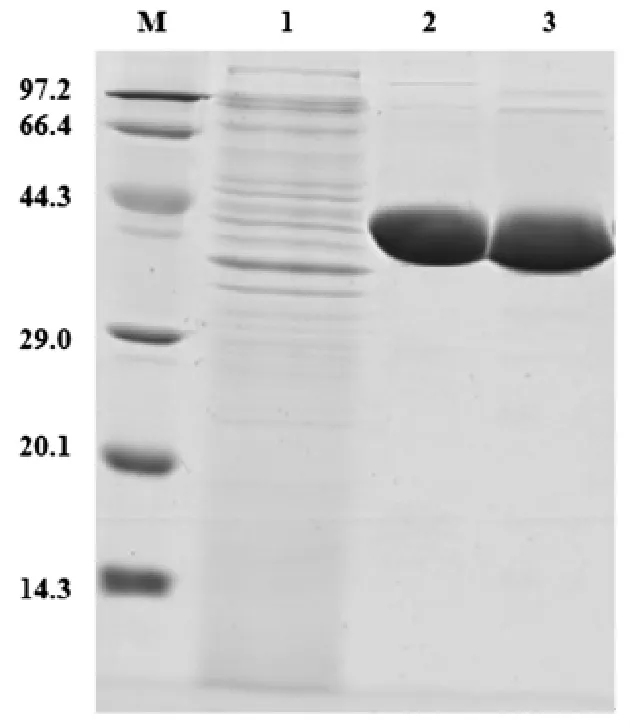
M—Protein marker;1—未诱导菌液;2—纯化后OYE2;3—纯化后FDHCB图2 纯化后OYE2与FDHCB的SDS-PAGE分析
2.2最适温度和最适pH
当催化反应温度为30℃时,产物香茅醛的得率达到最高,为68.3%;而当反应温度超过30℃之后,产物的得率开始逐渐地降低;当温度达到50℃时,得率只有9.1%(图3)。在pH范围6.0~9.0内考察了不同pH对香茅醛得率的影响。结果表明当PIPES缓冲液的pH为7.0时香茅醛得率最高(图4)。

图3 温度对香茅醛得率的影响

图4 pH对香茅醛得率的影响
2.3 FDHCB添加量对香茅醛得率的影响
考察了不同甲酸脱氢酶FDHCB添加量(0.005~0.2 U/mL)对香茅醛得率的影响。当不加FDHCB时,催化反应的得率只有9.8%,随着时间的增加香茅醛得率没有明显增加。而当逐渐提高FDHCB的添加量时,香茅醛的得率也在不断增加,当含量达到0.1 U/mL时,催化3 h后得率为68.3%,继续延长反应时间至10 h,最终香茅醛得率达到91.2%(图5)。
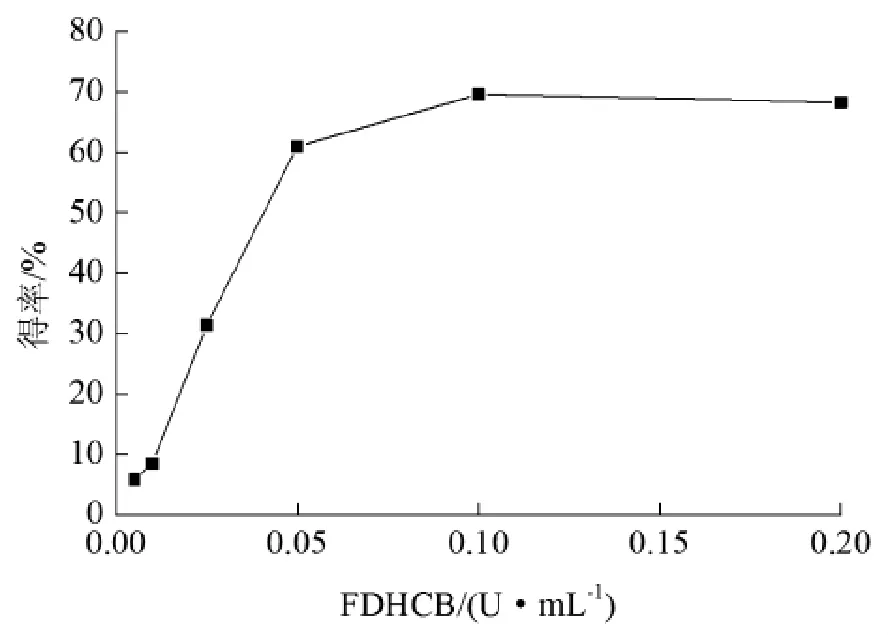
图5 FDHCB添加量对香茅醛得率的影响
2.4辅底物浓度对香茅醛得率的影响
考察了辅底物甲酸钠浓度(10~200 mmol/L)对香茅醛得率的影响。在浓度低于20 mmol/L时,得率只有24.3%(图6)。当甲酸钠浓度为100 mmol/L时,香茅醛得率达到最大。浓度继续增大,香茅醛得率几乎保持不变,因此辅底物浓度选定为100 mmol/L。
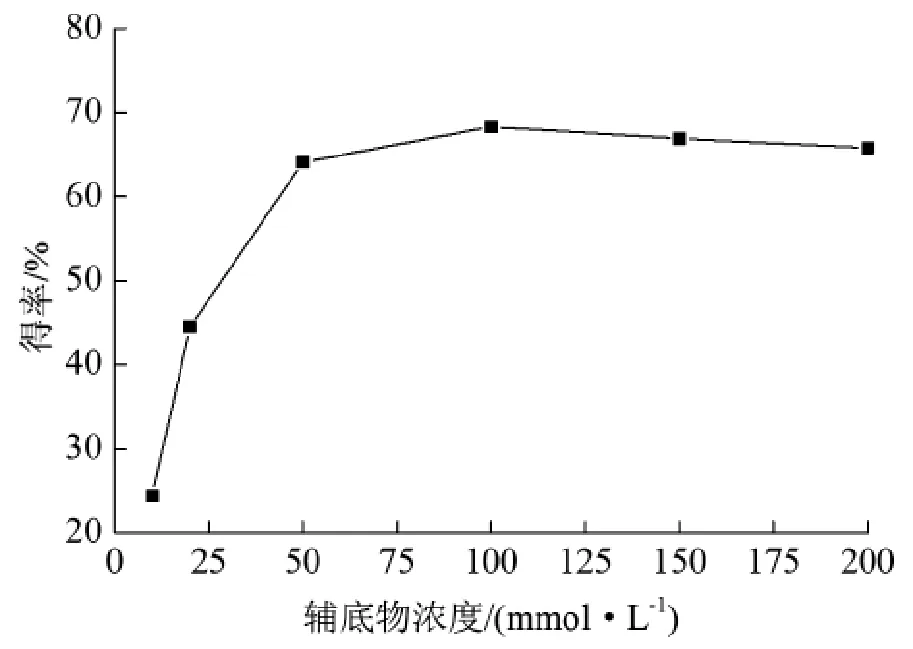
图6 辅底物浓度对香茅醛得率的影响
2.6底物浓度对香茅醛得率的影响
考察了底物浓度(20~40 mmol/L)对香茅醛得率的影响。适当地延长反应时间有助于提高香茅醛
2.5辅酶NAD+浓度对香茅醛得率的影响

图7 NAD+浓度对香茅醛得率的影响
当NAD+浓度为0.05 mmol/L时,反应3 h后香茅醛得率达到53.4%。随着浓度的增加,在0.05~0.5 mmol/L范围以内,香茅醛得率有明显增高,在0.5~1.0 mmol/L范围内,香茅醛得率的增幅相对较小(图7)。综合考虑辅酶成本和催化效果,辅酶NAD+浓度选定为0.5 mmol/L。得率,因而设定反应时间为10 h,考察底物浓度对香茅醛得率的影响。当柠檬醛浓度为20~30 mmol/L时,柠檬醛浓度对香茅醛得率的影响比较小,香茅醛得率为88.5%~92.0%;而当底物浓度为35%时,香茅醛得率为53.8%;当底物浓度继续增加达到40 mmol/L时,得率仅为10.4%(图8)。在上述反应中(R)-香茅醛e.e.值并不高,只有40%~50%。
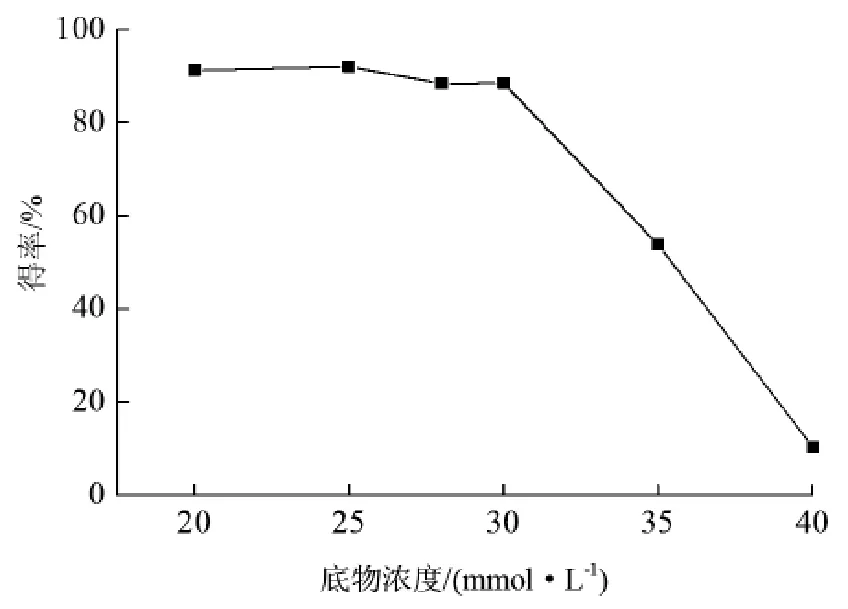
图8 底物浓度对香茅醛得率的影响
3 结 论
柠檬醛含有C=C和C=O双键,并且整细胞中普遍存在羰基还原酶,因而整细胞法催化不对称还原柠檬醛往往导致形成不需要的副产物。本研究利用源自酿酒酵母的重组老黄酶OYE2和重组甲酸脱氢酶FDHCB构建酶法不对称还原柠檬醛生成香茅醛的体系,反应过程中未检测到作为副产物的醇,有效地避免了副产物的产生。老黄酶催化的柠檬醛不对称还原反应往往适用底物浓度较低(<10 mmol/L),本研究优化了不对称还原柠檬醛生成香茅醛的各影响因素后,适用底物浓度提高至25 mmol/L,香茅醛得率为92.0%;当柠檬醛浓度提高至30 mmol/L时,香茅醛得率也能达到88.5%。本研究中柠檬醛不对称还原反应的产物(R)-香茅醛e.e.值并不理想,后续可通过调节柠檬醛顺反构型的比例以及老黄酶的分子改造来进一步提高产物中(R)-香茅醛的比例。
参考文献:
[1]TOOGOOD H S,SCRUTTON N S. New developments in‘ene’-reductase catalysed biological hydrogenations[J]. Current opinion in chemical biology,2014,19:107-115.
[2]STUERMER R,HAUER B,HALL M,et al. Asymmetric bioreduction of activated C=C bonds using enoate reductases from the old yellow enzyme family[J]. Current opinion in chemical biology,2007,11(2):203-213.
[3]BOUGIOUKOU D J,STEWART J D. Opposite stereochemical courses for enzyme -mediated alkene reductions of an enantiomeric substrate pair[J]. Journal of the American chemical society,2008,130(24):7655-7658.
[4]STUECKLER C,HALL M,EHAMMER H,et al. Stereocomplementary bioreduction of α,β-unsaturated dicarboxylic acids and dimethyl esters using enoate reductases:enzyme-and substratebased stereocontrol[J]. Organic letters,2007,9(26):5409-5411. [5]FITZPATRICK T B,AMRHEIN N,MACHEROUX P. Characterization of YqjM,an old yellow enzyme homolog from Bacillus subtilis involved in the oxidative stress response[J]. Journal of biological chemistry,2003,278(22):19891-19897.
[6]CHAPARRO -RIGGERS J F,ROGERS T A,VAZQUEZ -FIGUEROA E,et al. Comparison of three enoate reductases and their potential use for biotransformations[J]. Advanced synthesis and catalysis,2007,349(8/9):1521-1531.
[7]MEAH Y,MASSEY V. Old yellow enzyme:stepwise reduction of nitro -olefins and catalysis of aci -nitro tautomerization[J]. Proceedings of the national academy of sciences,2000,97(20):10733-10738.
[8]TOOGOOD H S,FRYSZKOWSKA A,HARE V,et al. Structure-based insight into the asymmetric bioreduction of the C=C double bond of α,β-unsaturated nitroalkenes by pentaerythritol tetranitrate reductase[J]. Advanced synthesis and catalysis,2008,350(17):2789-2803.
[9]应向贤,李国四,范雅君,等.蜡样芽孢杆菌烯醇还原酶的克隆、表达和酶学性质研究[J].发酵科技通讯,2015,44(1):4-8.
[10]魏代娣.薄荷醇的合成及旋光异构体的拆分[J].精细化工,1990,7(6):3-6.
[11]MÜLLER A,HAUER B,ROSCHE B. Asymmetric alkene reduction by yeast old yellow enzymes and by a novel Zymomonas mobilis reductase[J]. Biotechnology and bioengineering,2007,98(1):22-29.
[12]SLUSARCZYK H,FELBER S,KULA M R,et al. Stabilization of NAD -dependent formate dehydrogenase from Candida boidinii by site-directed mutagenesis of cysteine residues[J]. European journal of biochemistry,2000,267(5):1280-1289.
(责任编辑:朱小惠)
Optim ization of asymmetric reduction of citral for the synthesis of citronellal using old yellow enzyme and form ate dehydrogenase
YING Xiangxian,HU Baojun,ZHOU Yuhang,GAO Liang,MENG Shumin
(College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:The genes oye2 encoding old yellow enzyme 2 from Saccharomyces cerevisiae and fdhcb encoding formate dehydrogenase from Candida boidinii were overexpressed as a soluble form in Escherichia coli BL21(DE3),respectively. Both recombinant enzymes OYE2 and FDHCB were purified to homogeneity using Ni-NTA affinity chromatography. In this study,OYE2-catalyzed asymmetric reduction of citral was coupled with FDHCB-driven coenzyme regeneration,and its reaction conditions were optimized. The optimized reaction mixture contained 25 mmol/L citral,100 mmol/L sodium formate,0.42 mg/mL OYE2,0.2 U/mL FDHCB and 0.5 mmol/L NAD+in 50 mmol/L PIPES buffer(pH 7.0). After 10 h of reaction at 30℃and pH 7.0,the yield of citronellal reached up to 92.0%,which was around 9.4 times higher than the citronellal yield of 9.8%without FDHCB-driven coenzyme regeneration.
Keywords:old yellow enzyme;formate dehydrogenase;citral;citronellal;asymmetric reduction;coenzyme regeneration
作者简介:应向贤(1975—),男,浙江永康人,副教授,博士,研究方向为生物催化,E-mail:yingxx@zjut.edu.cn.通信作者:应向贤副教授,E-mail:yingxx@zjut.edu.cn.
基金项目:浙江省自然科学基金资助项目(LY12B06011)
收稿日期:2015-10-26
中图分类号:TQ02
文献标志码:A
文章编号:1674-2214(2016)02-0070-05