β受体阻滞剂对非小细胞肺癌患者放疗后生存率影响的研究
陕西省肿瘤医院放疗一科(西安710061) 王天昶 王锋刚 张彦兵 吴 磊 张永彤 冯 杏
β受体阻滞剂对非小细胞肺癌患者放疗后生存率影响的研究
陕西省肿瘤医院放疗一科(西安710061)王天昶王锋刚张彦兵吴磊张永彤冯杏
摘要目的:探讨β受体阻滞剂对非小细胞肺癌患者生存率方面的作用。方法: 收集接受根治性放疗的非小细胞肺癌患者256例。应用Kaplan-Meier 法推算服用β受体阻滞剂组患者与未服用组患者的生存率,用Log-rank检验进行组间生存率的比较,并对服用β受体阻滞剂是否影响非小细胞肺癌患者放疗后生存率采用Cox回归模型分别进行单因素及多因素的分析。结果:服用β受体阻滞剂组患者的无远处转移生存率、无瘤生存率及总生存率均高于未服用组,且具有统计学意义。单因素与多因素Cox比例风险模型分析中均发现服用β受体阻滞剂与提高无远处转移生存率,无瘤生存率及总生存率等呈正相关性。结论:β受体阻滞剂是改善非小细胞肺癌患者根治性放疗疗效的独立预后因素,可提高非小细胞肺癌患者放疗后生存率。
主题词肺肿瘤/放射疗法β受体阻滞剂预后
肺癌是最常见的恶性肿瘤之一,其中非小细胞肺癌(NSCLC)占80%~85%,大部分患者就诊时已属中晚期,预后较差[1]。近年有文献报道,β受体阻滞剂在肺癌、乳腺癌、恶性黑色素瘤、前列腺癌等肿瘤中可能具有降低复发率、提高总生存率以及延长疾病无进展生存时间的作用[2-5]。本研究通过回顾性分析我院2006年1月至2011年6月收治的256例接受根治性放疗的非小细胞肺癌患者,对服用β受体阻滞剂是否影响非小细胞肺癌患者放疗后生存率进行探讨。
资料和方法
1一般资料本次收集的非小细胞肺癌患者256例,患者均满足以下条件:经支气管镜或穿刺活检,病例确诊为非小细胞肺癌;接受过根治性放疗,即放疗剂量大于60Gy;未接受肺癌手术治疗。排除:确诊时即发现肝脏转移的患者;合并有其他原发肿瘤的患者;伴有严重肺心病或肺气肿的患者;确诊时年龄超过80岁的患者。经过上述筛除,剩余患者197例。β受体阻滞剂组中,72例均诊断为高血压病,其余14例为心脏及冠脉系统疾病。最常见的两种β受体阻滞剂组分别为美托洛尔(53例)及阿替洛尔(25例),其余为比索洛尔(1例)、普萘洛尔(6例)及索他洛尔(1例)。
2方法对上述病例进行逐一电话随访,详细询问患者发病前有无高血压或心脏病史,在放疗前及放疗期间是否服用β受体阻滞剂,以及所服用β受体阻滞剂的具体名称及时间。将患者分为两组,即服用组与未服用组。分别统计两组各病例的肿瘤局部无进展生存时间,无远处转移生存时间,无瘤生存时间及总生存时间。
3统计学方法 采用Pearson卡方检验或Fisher确切概率法检验两组特征因素是否一致。采用SPSS 11.5 统计软件进行统计处理, 用Kaplan-Meier 法推算两组肿瘤局部无进展生存率(LPRFS),无远处转移生存率(DMFS),无瘤生存率(DFS)及总生存率(OS)。并用Log-rank检验进行组间生存率的比较。对服用β受体阻滞剂是否影响非小细胞肺癌患者放疗后生存率采用Cox回归模型分别进行单因素及多因素的分析。所有单因素分析结果显示可能影响生存率的其他混杂因素,在多因素分析中也被包含在内,结果以95%置信区间内的危险比表示。当P值小于0.05时,认为该因素对生存率有影响(检验水准为0.05)。
结果
最终符合入组条件的病例一共为197例,服用β受体阻滞剂组为86例,未服用组为111例。两组病例特征因素分别进行统计汇总。所有197例患者中,男性92例,女性105例,年龄38岁-81岁,中位年龄64岁,按照国际抗癌联盟(UICC)第7版肺癌临床分期标准,Ⅰ期6例,Ⅱ期9例,Ⅲ期182例。两组间比较,服用β受体阻滞剂组的平均年龄高于未服用组(P<0.01),一般状况(KPS评分)较差(P=0.04),高血压患病率较高(P<0.01),服用阿司匹林患者比率较大(P<0.01),同期接受化疗比率较高(P= 0.03),接受放疗剂量较高(P<0.01)。而其他特征因素如性别比例、临床分期是否达到Ⅲ期、病理类型为鳞癌或非鳞癌、是否合并慢性阻塞性肺疾病等在两组间并无明显差别。所有病例中位随访时间为49个月。
1单因素分析使用Kaplan-Meier法分别计算服用组及未服用组的肿瘤局部无进展生存率(LRPFS)、无远处转移生存率(DMFS)、无瘤生存率(DFS)及总生存率(OS),并绘制相应生存曲线,并对两组间的生存曲线进行log-rank检验。服用β受体阻滞剂组的DMFS、DFS、OS均高于未服用组,且具有显著统计学差异(P<0.01),结果见图1~3。在使用单因素Cox比例风险模型对不同临床因素进行分析发现,服用β受体阻滞剂组与提高DMFS、DFS、OS等相关,但与LPRFS不具有相关性。其他协变因素分析中,同期合并化疗、一般状况(KPS评分)等因素与OS具有显著地相关性,年龄、疾病分期等因素与DMFS、DFS相关,其中疾病分期还与OS具有显著相关性,见表1。
2多因素分析通过调整年龄、KPS评分、临床分期、病理分型、同期合并化疗、放疗剂量、合并高血压病、合并慢性阻塞性肺疾病、服用阿司匹林等临床因素进行多因素分析,见表2。服用β受体阻滞剂组仍旧与提高DMFS、DFS、OS相关,但与提高LPRFS无相关性。在对其他临床因素进行分析时发现,仅有高分期、低KPS评分、未合并化疗等因素与降低生存率相关,其他因素均与生存率无相关性。
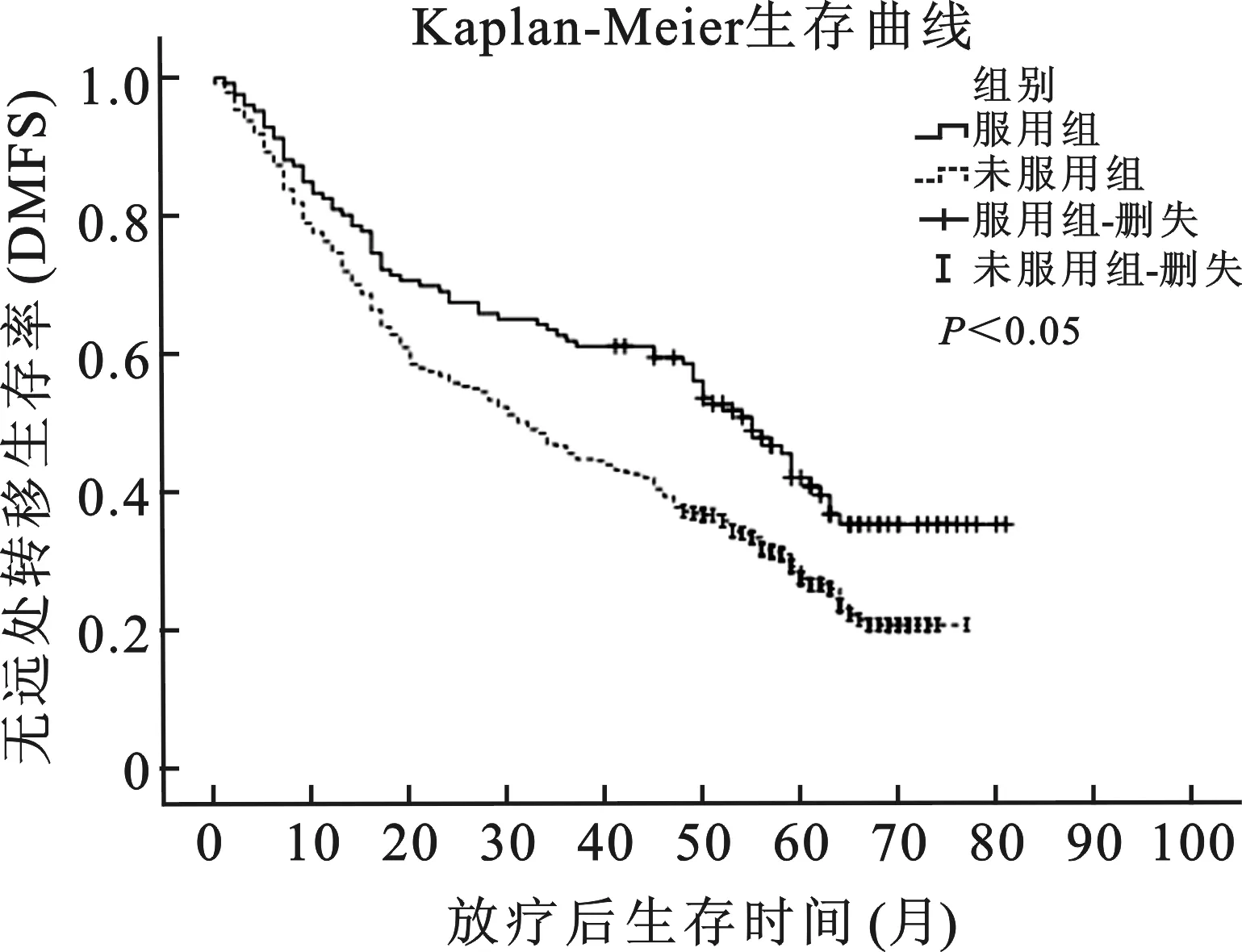
图1 服用β受体阻滞剂组与未服用组无远处转移率曲线

图2服用β受体阻滞剂组与未服用组无瘤生存率曲线
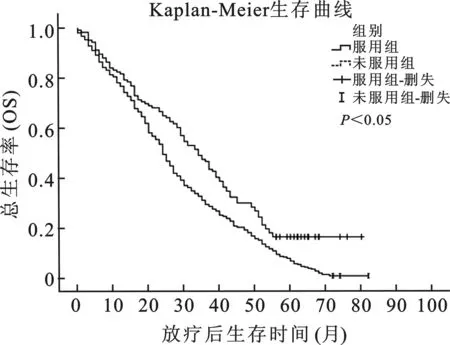
图3服用β受体阻滞剂组与未服用组总生存率曲线
讨论
本研究主要目的是评价在非小细胞肺癌并接受根治性放疗的患者中,β受体阻滞剂在降低远处转移及提高生存率方面是否具有正相关性。通过研究发现,β受体阻滞剂虽然在降低LRPFS方面无作用,但可显著改善DMFS、DFS及OS。即便在多因素分析中对疾病分期、病理分型、KPS评分、是否合并化疗等因素进行校正之后,β受体阻滞剂在降低远处转移及提高生存率方面仍具有明显的正相关性。
上述结果可与国外一些关于肺癌转移机制的非临床研究结果相互印证。Al-Wadei HA等学者进行的体外研究发现,烟碱可以通过共同调节烟碱受体和β肾上腺素能受体,进而促进非小细胞肺癌细胞增殖,而普萘洛尔正是通过对抗该机制,从而达到抑制肿瘤细胞增殖的目的[6]。而在其他一些研究中发现,β肾上

表1 服用β受体阻滞剂影响非小细胞肺癌放疗后生存率的单因素分析

表2 服用β受体阻滞剂影响非小细胞肺癌放疗后生存率的多因素分析
腺素能受体信号通路在肿瘤进展演变中具有促进正常细胞癌变、肿瘤细胞增殖、细胞外基质受侵、肿瘤血管增生、基质内金属蛋白酶活化、炎症因子及其他化学因子高表达的作用。上述机制在肺癌、前列腺癌、结肠癌、乳腺癌以及卵巢癌中已经得到充分证实[7-8]。Al-Wadei HAN等学者通过建立小鼠模型研究发现,心理应激因素可通过烟碱受体上调β肾上腺素能受体信号通路从而促进非小细胞肺癌进展,而γ氨基丁酸可有效对抗该机制[9]。正是基于上述基础研究,我们推测β受体阻滞剂有可能通过下调β肾上腺素能受体信号通路在人体中可以起到抑制肿瘤进展、转移的作用。
本回顾性研究虽然在数据上证明β受体阻滞剂可显著改善DMFS、DFS及OS,但不可否认,该研究还是存在一定的局限性。首先,有关服用β受体阻滞剂的持续时间及具体剂量本研究并没有完整数据,而治疗前后服药时间长短是否会对研究结论产生影响,影响的严重程度就不得而知。其次,在分组时,由于病例数量的限制,只是分为服用组和未服用组,而服用组中并没有根据不同种类的β受体阻滞剂再次进行亚组分析,这也可能会对研究结论产生一定影响。第三,前面讨论内容中所提及的有关β受体阻滞剂影响肺癌进展的非临床研究均是针对肺腺癌,而本研究中肺癌病例包含所有非小细胞肺癌的病理类型。但尽管如此,我们还是通过统计分析得出结论,β受体阻滞剂与所有非小细胞肺癌的生存率有相关性。这可能提示β受体阻滞剂并不是针对特定的病理类型,才会显示出其在抑制肿瘤转移方面的作用。最后,由于临床实际及医学伦理等原因,我们目前还不能将β受体阻滞剂作为抗肿瘤药物用于肺癌患者,所以只能进行相关回顾性研究,而其中不同患者可能还会合并服用其他药物,如血管紧张素转换酶抑制剂、血管紧张素2受体拮抗剂等,这不可避免会对统计分析造成一定干扰。而要想达到较好的组间一致性,只有在更大量的病例基础上或是在日后的前瞻性研究中得以实现。
总而言之,本回顾性研究证明β受体阻滞剂作为独立因素可提高非小细胞肺癌患者放疗后DMFS、DFS以及OS,但不提高LPRFS。该结论与前期非临床研究证明β受体阻滞剂通过影响β肾上腺素能受体信号通路进而抑制肿瘤转移相互印证。但其是否可作为抗肿瘤药物应用于非小细胞肺癌患者,以及使用的时间及剂量等仍需要前瞻性研究去进一步探索。
参考文献
[1] 张航.多西紫杉醇治疗老年晚期非小细胞肺癌54例临床研究[J].陕西医学杂志,2015,44(1):92-93.
[2]Korpanty G, Smyth E, Carney DN. Update on anti-angiogenic therapy in nonsmall cell lung cancer: are we making progress[J]. Thorac Dis, 2011, 3: 19-29.
[3]Antoni MH, Lutgendorf SK, Cole SW. The influence of bio-behavioural factors on tumour biology-pathways and mechanisms[J]. Nat Rev Cancer, 2006,6: 240-248.
[4]Levi B, Benish M, Goldfarb Y,etal. Continuous stress disrupts immunostimulatory effects of IL-12[J]. Brain Behav Immun, 2011,25: 727-735.
[5]Moreno-Smith M, Lutgendorf SK, Sood AK,etal. Impact of stress on cancer metastasis[J]. Future Oncol, 2010,6: 1863-1881.
[6]Al-Wadei HAN, Ullah MF, Al-Wadei MH. Intercepting neoplastic progression in lung malignancies via the beta adrenergic (β-AR) pathway: Implications for anticancer drug targets[J]. Pharmacol Res,2012, 66: 33-40.
[7]Schuller HM, Porter B, Riechert A. Beta-adrenergic modulation of NNK-induced lung carcinogenesis in hamsters[J]. Cancer Res Clin Oncol, 2000,126: 624-630.
[8]Lutgendorf SK, Sood AK, Antoni MH. Host factors and cancer progression: Biobehavioral signaling pathways and interventions[J]. Clin Oncol, 2010, 28: 4094-4099.
[9]Al-Wadei HAN, Plummer HK, Ullah MF,etal. Social stress promotes and γ-aminobutyric acid inhibits tumor growth in mouse models of non-small cell lung cancer[J]. Cancer Prev Res (Phila) ,2011,5: 189-196.
(收稿:2015-04-03)
Effect of beta-blockers to the survival outcomes of the patients with non-small-cell lung cancer treated with definitive radiation therapy
1st Department of Radiation Oncology, Shaanxi Tumor Hospital(Xi’an 710061)
Wang TianchangWang FenggangZhang Yanbinet al
ABSTRACTObjective: To find out the role of beta-blockers to the survival outcomes of the patients with non-small-cell lung cancer treated with definitive radiation therapy. Methods: Collect the clinical data of 256 patients with non-small-cell lung cancer (NSCLC) who received definitive radio therapy. A Cox proportional hazard model was utilized to determine the association between beta-blockers intake and distant metastasis-free survival (DMFS), disease-free survival (DFS), and overall survival (OS). Results: Patients taking beta-blockers had improved DMFS , DFS ,and OS , compared with patients not taking beta-blockers. In univariate analysis and multivariate analysis, beta-blockers intake was associated with a significantly better DMFS, DFS, and OS.Conclusions: Beta-blockers use is associated with improved DMFS, DFS, and OS in the patients with non-small-cell lung cancer treated with definitive radiation therapy.
KEY WORDSLung neoplasms/radiotherapyBeta-blockersPrognosis
【中图分类号】R543
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.02.043

