β-榄香烯对肺腺癌细胞增殖作用的影响*
西安交通大学医学院附属西安市中心医院(西安 710003)
李建英△ 鱼 军 苗 宇 王娟红 杜旭升 王 波 张惠民 刘 安 王一理△▲
β-榄香烯对肺腺癌细胞增殖作用的影响*
西安交通大学医学院附属西安市中心医院(西安 710003)
李建英△鱼军苗宇王娟红杜旭升王波张惠民刘安王一理△▲
摘要目的:探讨β-榄香烯对肺腺癌细胞的抗肿瘤作用及其机制。方法:使用RT-PCR和Western blot法检测β-榄香烯对肿瘤细胞中P53 mRNA和蛋白表达的影响;同时使用差速离心法提取外泌体,利用电镜和Western blot 法进行分析。通过转染P53 siRNA构建P53下调细胞株。对BABL/c裸鼠肿瘤模型皮下注射A549细胞,探索体内环境下β-榄香烯对肿瘤生长的影响。结果:①通过siRNA技术构建P53下调细胞株,观察到β-榄香烯对A549细胞的作用依赖于P53的表达;②A549细胞源性的外泌体能够抑制肺癌细胞的增殖;③体内实验证实β-榄香烯通过上调P53表达和外泌体的释放实现抑制肿瘤生长的作用。结论:β-榄香烯通过调控P53的表达和外泌体的释放来影响肺癌细胞的增殖。
主题词肺肿瘤 榄香烯 细胞增殖外泌体
榄香烯(1-甲基-1-乙烯基-2,4-二异丙烯基环己烷)是一种从中草药姜黄中分离出来的具有抗肿瘤作用的药物,分为α-、β-以及γ-榄香烯3种。β-榄香烯作为主要的抗肿瘤成分,在体内外实验中已被证明具有抗肿瘤作用并且其副作用少[1],因此具有更好的前景。初步研究提示β-榄香烯通过引起G2-M期阻滞以及下调Bcl-2 和Bcl-xl实现细胞凋亡,从而达到抑制肿瘤细胞增殖的目的[2-3]。但目前β-榄香烯的抗肿瘤机制尚不清楚,β-榄香烯的抗肿瘤作用是否还存在其他调控途径也不清楚。本研究中我们发现β-榄香烯能够上调P53的表达,同时增加外泌体的释放,从而阐明了P53在β-榄香烯抗肺癌细胞增殖及促进凋亡中的具体作用。
材料与方法
1材料人肺腺癌细胞A549和H460 购自ATCC;10%胎牛血清、RPMI 1640培养基、脂质体2000购自GIBCO公司;RIPA裂解液购自碧云天生物技术公司;BALB/c雄性裸鼠购自西安交通大学实验动物中心。
2细胞培养人肺腺癌细胞A549和H460 (ATCC,Rockville,MD)在含有10%胎牛血清(Gibco BRL, Gaithersburg, MD)、100 IU/ml青霉素以及100 g/ml链霉素的RPMI 1640培养基(Gibco BRL, Gaithersburg, MD)中培养。细胞在37℃、含有5% CO2和 95% 空气的培养箱中孵育。
3RT-PCR使用试剂盒(Invitrogen,Carlsbad,CA)在A549细胞中提取总RNA,之后将2 μg的总RNA加入反转录体系中,参照说明完成实时聚合酶链反应。引物序列:P53[4]:5’-ATTCTGGGACAGCCAAGCT-3’、5’-TAGTTGTAGTG-GATGGTGGTA-3’;GAPDH:5’-CAAGCTCATTTCCTGGTATGAC-3’、5’-CAGTGAGGGTCTCTCTCTTCCT-3’。GAPDH作为实验的内参。相关基因的表达水平使用GAPDH mRNA和2-△△CT法进行计算。
4Western blot免疫印迹法用于检测肺癌A549细胞P53和外泌体的表达水平。用RIPA裂解液(Beyotime, Nantong,China)在A549细胞中提取总蛋白及外泌体。将等量的蛋白质加入到12%的SDS-PAGE,之后用电泳的方法对蛋白进行分离。一抗为兔单克隆和多克隆抗体,HRP连接的羊抗兔抗体作为二抗。通过ELC显色法将结合的抗体进行显色。β-actin作为内参用于计算其他蛋白质的表达水平。所有实验重复至少3次。
5外泌体分离用系列离心步骤对外泌体进行分离。将培养过细胞的培养基进行收集,在300×g环境下离心5 min,1200×g环境下离心15 min除去细胞碎片。弃去上层液体后在7000×g环境下离心50 min,用PBS洗涤后在100000×g环境下离心60 min。用PBS对沉淀进行重悬,在100 000×g环境下离心60 min。最后将PBS重悬收集到的外泌体,保存在-80℃环境中。用于电子显微镜观察的外泌体保存在-4℃环境中。
6电镜观察对经过离心收集到的来源于A549细胞的外泌体加入EM网格中,再加入1%戊二醛。使用乙酸双氧铀和甲基纤维素的混合物进行背景染色。去除多余的液体后,80kV、JEOL 1200电子显微镜进行观察并记录。
7用siRNA技术沉默基因表达用脂质体2000作为转染试剂,对A549细胞转染P53 siRNA(siP53)或对照siRNA。P53 siRNA序列为5’-GATCCCCGACTCC-AGTGGTAATCTACT-TCAA
GAGAGTAGATTACCACTGGAGTCTTTTTGGA
AA-3’和 5’-AG-CTTTTC-CAAAAAGACTCCAGTGGTAATCTACTCTCTTGAAGTAGATT-A
CCACTGG-AGTCGGG-3’[5]。
8体内实验使用裸鼠皮下移植瘤进行体内实验。于西安交通大学实验动物中心购买BALB/c雄鼠,按规定进行饲养,西安交通大学伦理委员会已批准审核并批准本实验。按2×107/0.1ml的密度将A549细胞接种于裸鼠后背左侧。每两天用游标卡尺测量肿瘤大小,用公式(长×宽2/2)计算肿瘤体积。当肿瘤体积达到80~100 mm3时,将裸鼠随机分成两组:二甲基亚砜(DMSO)与β-榄香烯组。对DMSO组裸鼠的肿瘤注射单纯的DMSO,对β-榄香烯组裸鼠的肿瘤注射经过20 μl DMSO稀释的20 μg或者40 μgβ-榄香烯,每两天进行一次干预。每天测量一次肿瘤体积,持续20 d。实验结束后,使用CO2将裸鼠处死,利用RT-PCR试验进行相关分析。
9统计学方法采用SPSS13.0软件进行统计分析,资料以均数±标准误表示。使用Dunnett法检验不同组间的统计学差异。P<0.05为差异具有统计学意义。
结果
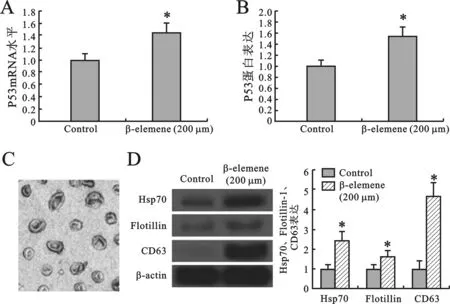
1β-榄香烯在A549细胞中上调P53的表达见图1。经β-榄香烯干预,A549细胞中的P53 mRNA 和蛋白水平的表达均增加(图1A)。这些结果提示β-榄香烯能够上调A549细胞中的P53表达。进一步用Western blot法对肿瘤源性的外泌体进行了量化检测(图1B)。对培养过A549细胞的培养基进行系列离心后,提取出外泌体,用乙酸双氧铀和甲基纤维素的混合物进行背景染色,电镜下观察,发现外泌体呈“杯状”(图1C)。Western blot显示经β-榄香烯处理A549细胞后,外泌体的标志物CD63、flotillin-1以及Hsp70表达增加(图1D),提示β-榄香烯能够促进外泌体的分泌,经β-榄香烯处理的A549细胞分泌出的外泌体的形态也并未发生变化。
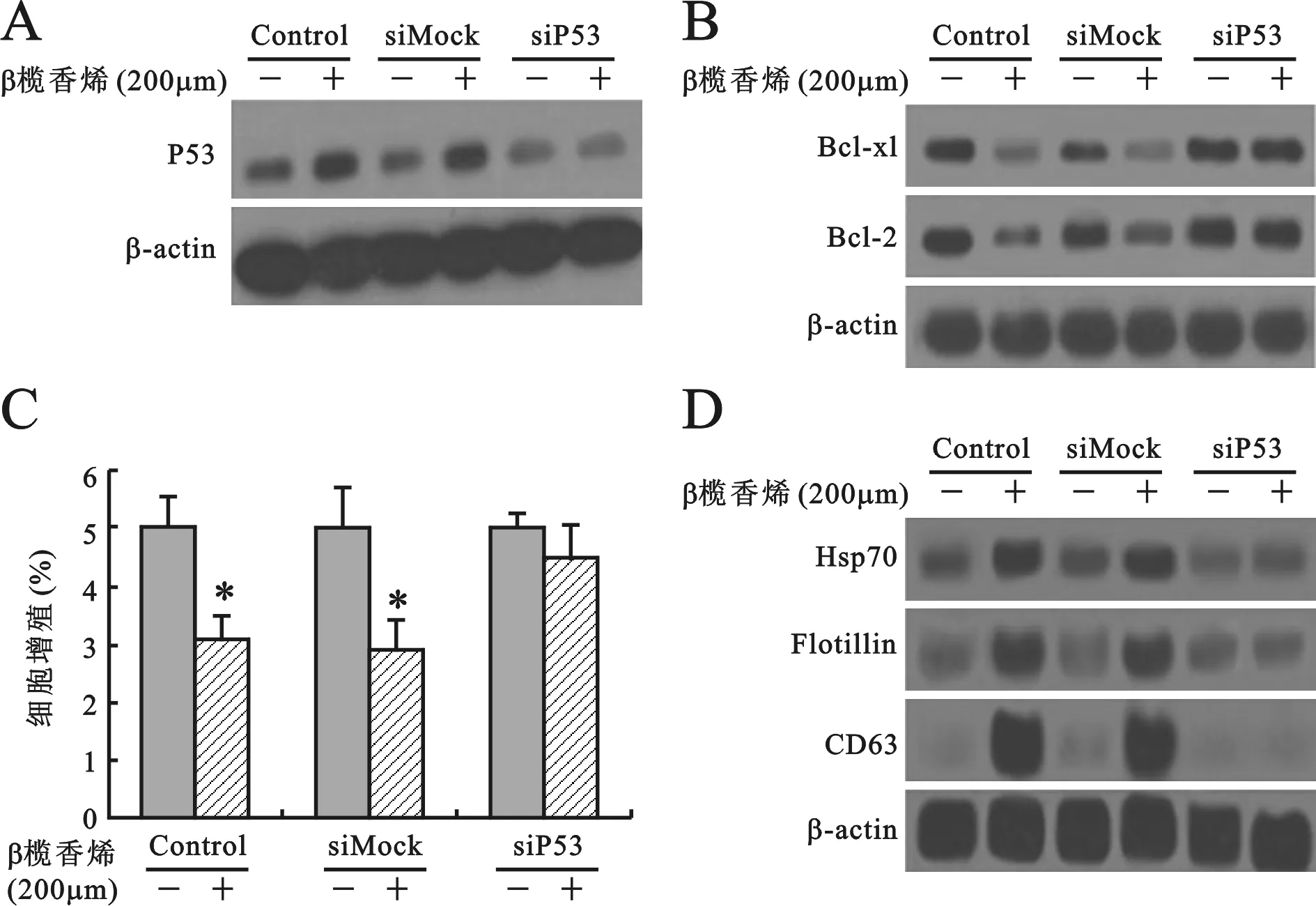
2β-榄香烯对肺癌细胞的作用依赖于P53表达 见图2。对A549细胞进行siRNA干预,获得siP53转染组。siP53转染组与对照组相比,P53蛋白表达水平显著下降(图2A)。siP53转染组与对照组相比,细胞增殖增加(图2B)。Western blot显示在siP53转染细胞中,凋亡相关蛋白Bcl-2 和Bcl-xl表达变化不明显(图2C)。Western blot法检测了外泌体的释放,显示在siP53转染细胞中显著下降(图2D)。结果提示β-榄香烯在siP53转染细胞中不能发挥抗肿瘤作用。
(Dunnett检验,与对照组相比*P<0.05)
(Dunnett检验,与对照组相比*P<0.05)
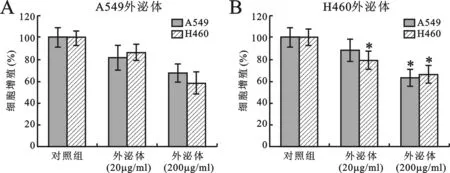
3肿瘤源性外泌体对A549细胞增殖的影响见图3。 使用MTT法检测外泌体对A549细胞增殖的影响,结果提示A549细胞源性的外泌体能够显著抑制A549和H460细胞的生长(图3A),H460细胞源性的外泌体同样能够显著抑制A549和H460细胞的生长(图3B)。
(对照组相比*P<0.05)
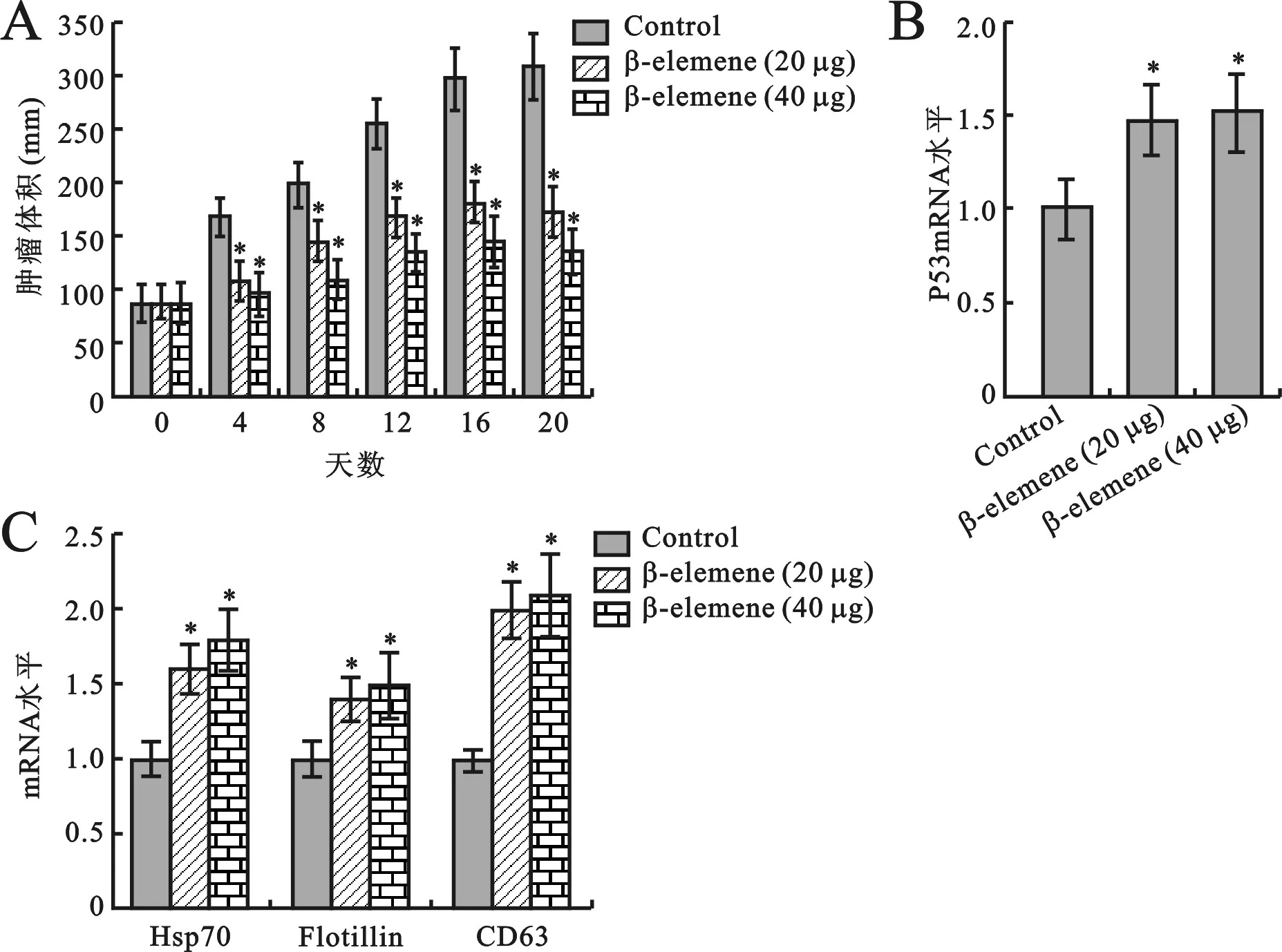
4β-榄香烯在体内抑制肿瘤的生长见图4。使用A549细胞构建BABL/c裸鼠皮下移植瘤模型。肿瘤构建成功后,用20 μg或者40 μg的β-榄香烯注射入肿瘤,每两天进行一次。观察β-榄香烯能够显著抑制裸鼠体内肿瘤的生长(图4A)。P53、Hsp70, flotillin和CD36的mRNA表达水平经β-榄香烯干预后显著上调(图4B和4C)。结果提示P53信号通路和外泌体均与β-榄香烯的抗肿瘤生长有关。
(对照组相比*P<0.05)
讨论
肺癌是是当今最常见的恶性肿瘤,也是引起死亡的主要原因之一。手术、放疗以及化疗是目前肺癌患者的主要治疗方法[6]。尽管目前在一些治疗手段上取得了一些进展,但治疗效果仍不能够满意。近期β-榄香烯已被批准用于肺癌的治疗,前期研究也发现β-榄香烯在体内外均具有抗肿瘤作用,然而其具体抗肿瘤机制仍不清楚。
众所周知,β-榄香烯能够促进P53表达的上调,而P53的表达上调又与肿瘤抑制相关[7],本课题前期实验证实,β-榄香烯的干预能够显著降低A549细胞的增殖,同时β-榄香烯能够显著下调Bcl-2 和Bcl-xl的表达,但对Bax 和Bak的表达影响较少。已有研究证实,抗肿瘤药物可以通过P53依赖或者非依赖途径引起细胞凋亡[8]。然而P53途经在β-榄香烯诱导肺癌细胞凋亡中的作用仍不清楚,为了探索P53在β-榄香烯作用中是否发挥作用,我们用siRNA构造siP53转染组,进行后续的研究。在siP53转染组,Bcl-2 和Bcl-xl的表达变化很少,提示β-榄香烯是通过P53依赖途径诱导A549细胞凋亡。
我们发现β-榄香烯能够上调肿瘤源性的外泌体的表达。一些研究已经发现肿瘤细胞能够分泌外泌体样微泡,其中包含多种蛋白,例如CD63、热休克蛋白、flotillin-1以及MHCⅠ类分子[9],而肿瘤源性的外泌体在肿瘤发展过程中又起了重要的作用。目前的研究结果显示β-榄香烯能够通过P53依赖途径上调外泌体的分泌。因此,我们推测β-榄香烯主要通过两种途径来调节肿瘤细胞生长。一种是β-榄香烯通过上调P53和下调Bcl-2 和Bcl-xl以激活凋亡相关途径,另一种是外泌体依赖途径。为了探索肿瘤源性外泌体的生物学功能,对培养经β-榄香烯干预过的A549细胞的培养基进行一系列离心分离,提取出外泌体,电镜观察发现A549细胞源性的外泌体有典型的磷脂双分子层结构,直径在30~100 nm。进一步探索A549细胞源性的外泌体是否能够影响肺癌细胞的增殖,发现A549细胞源性的外泌体可以抑制肺癌细胞的增殖。然而,有些文献报道BT-474源性的外泌体促进了BT-474的增殖[10],这些证据提示肿瘤源性的外泌体有抗肿瘤及促进肿瘤的双重作用,而出现这些有争议的结果可能是因为外泌体、应答细胞及环境三因素之间复杂的作用关系所致[11]。
本研究中仍存在一些局限性,本研究中,体外研究使用剂量为200 μM的β-榄香烯,体内的研究中则将计量为20 μg的β-榄香烯溶解于20 μl的DMSO中用于研究,而以上β-榄香烯的剂量是否可以直接用于人体仍需进一步探讨。
参考文献
[1]苗久旺,张钦德.姜黄素诱导肿瘤细胞凋亡的信号途径研究进展[J].陕西中医,2014,35(12):1692-1694.
[2]谢恬,李铖璐,王淑,等.榄香烯脂质体系列靶向抗癌天然药物基础研究进展[J].中国中西医结合杂志,2014,34(4):507-512.
[3]高红军,秦海峰.榄香烯治疗非小细胞肺癌的作用机制研究进展[J].现代医学生物进展,2010,10(21):4149-4151.
[4]Tu K,Zheng X,Zhou Z,etal.Recombinant human adenovirus-p53 injection induced apoptosis in hepatocellular carcinoma cell lines mediated by p53-Fbxw7 pathway, which controls c-Myc and cyclin E[J].PloS one 2013,8(7):e68574.
[5]Shen C,Buck AK, Liu X,etal.Gene silencing by adenovirus-delivered siRNA[J].FEBS Lett,2003,539(1-3):111-114.
[6]刘又宁.呼吸内科学高级教程[M].北京:人民军医出版社,2012:390-415.
[7]Meek DW.Regulation of the p53 response and its relationship to cancer[J].Biochem J. 2015,469(3):325-46.
[8]Mak AS.p53 in cell invasion,podosomes, and invadopodia[J].Cell Adh Migr,2014,8(3):205-214.
[9]Zhang X,Yuan X,Shi H,etal.Exosomes in cancer:small particle,big player[J]. J Hematol Oncol,2015,8:83.
[10]Ciravolo V, Huber V, Ghedini GC,etal. Potential role of HER2-overexpressing exosomes in countering trastuzumab-based therapy[J].J Cell Physiol,227(2):658-667.
[11]Zhao L, Liu W, Xiao J,etal.The role of exosomes and exosomal shuttle microRNA in tumorigenesis and drug resistance[J]. Cancer Lett,2015,56(2):339-346.
(收稿:2015-06-08)
【中图分类号】R734.2
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.02.003
*陕西省自然科学基金资助项目(2012JC2-06)
△西安交通大学基础医学院肿瘤研究所
▲通讯作者

