航天诱变黔草1号高羊茅内生真菌分布特点及分离培养研究
杨鼎元,杨春燕,罗 充,吴佳海,,曾庆飞
(1.贵州师范大学 生命科学学院,贵州 贵阳 550003; 2.贵州草业研究所,贵州 贵阳 550006)
航天诱变黔草1号高羊茅内生真菌分布特点及分离培养研究
杨鼎元1,杨春燕2,罗充1,吴佳海1,2,曾庆飞2
(1.贵州师范大学 生命科学学院,贵州 贵阳550003; 2.贵州草业研究所,贵州 贵阳550006)
摘要:为探明内生真菌在航天诱变材料黔草1号高羊茅中的分布情况和种类,利用光学显微镜进行镜检观察,对被侵染的航天诱变材料高羊茅展开内生真菌分离培养研究。结果发现,内生真菌的菌丝体普遍存在于试验材料的叶片、叶鞘、茎节间,内生真菌侵染率大小为:茎节>叶鞘>叶片,侵染差异在航诱材料与对照间(未经航天诱变的原始材料黔草1号)差异不显著(P>0.05);对分离条件优化后,发现从试验材料中分离的内生真菌在pH 7.5,25℃黑暗培养的条件下以添加高羊茅煎煮液的马铃薯琼脂糖培养基PSA的培养效果最佳;在pH 7.5,25℃紫外光照/黑暗交替培养的条件下以添加高羊茅煎煮液的水琼脂培养基WSA的促孢效果最佳。
关键词:航天诱变;高羊茅;内生真菌;侵染检测;分离培养
内生真菌(Endophytic)是一类在植物组织内部完成部分或全部生活史,并且在这个过程中不会引起宿主组织表现出明显病变的微生物类群[1],目前,国内外禾本科植物的内生真菌研究主要是在Epichloё属和Neotyphodium属真菌中展开,而这两属真菌被统称为Epichloёendophytes[2],它们在与宿主植株长期的生活中形成了一种互利共生的关系,禾本科内生真菌与宿主间的互利关系主要表现在2个方面:一方面内生真菌寄居在宿主的细胞间隙营寄生生活,另一方面内生真菌可以通过分泌各类激素等来促进宿主的生长,亦可分泌生物碱来保护宿主免遭昆虫、牲畜的采食,进而达成内生真菌与宿主互惠互利的共生关系[3-4]。内生真菌作为一种极具开发价值的新型微生物资源日益受到重视,继美国、新西兰之后,阿根廷、西班牙、意大利等国[5-9]也陆续展开了以内生真菌为侧重的研究,并被广泛应用于牧草、草坪草的改良以及水土保持等领域,目前,国外已培育出具有抗病虫害,但对家畜无毒的多年生黑麦草(Loliumperenne)、高羊茅(Festucaarundinacea)等牧草-内生真菌共生体新品种[10];美国的部分机场通过使用内生真菌所分泌的次生代谢产物获得抗鸟采食特性的新型草坪草种“Avanex”,极大的降低了飞机在起飞、降落等过程中因飞鸟撞击或引擎吸入而导致的安全隐患及经济损失[11]。
以贵州草业研究所选育的国审高羊茅品种黔草1号经“实践八号”育种卫星搭载处理后返地栽培的航空诱变材料为研究对象,并以未搭载黔草1号为对照,分析航空诱变对内生真菌在高羊茅中的分布是否产生影响,并开展内生真菌的分离培养研究,旨在探明高羊茅航天诱变材料的内生真菌分布情况、建立优化内生真菌的分离培养体系、分离培养出具有科研价值和研究意义的内生真菌种类,为培育优质内生真菌-高羊茅共生体新品系提供参考。
1材料和方法
1.1试验材料
1.1.1供试材料分别在2013年10月和2014年5月采集黔草1号(对照)高羊茅及其航天诱变材料(经试验表明[12]该航诱材料属节水型变异)各134份。挑选健康植株的叶片、叶鞘、茎节,放入无菌保鲜袋冷藏保存。
1.1.2试剂苯酚,乳酸,甘油,苯胺蓝,孟加拉红,氢氧化钠,蒸馏水;75%乙醇,次氯酸钠(2%有效氯),马铃薯,琼脂,蔗糖,麦芽浸膏,蛋白胨。
1.2试验方法
1.2.1内生真菌镜检参考文献[13]的内生真菌染色镜检方法进行。
1.2.2分离培养基参考文献[14-15]的方法配制马铃薯琼脂培养基(PDA)、水琼脂培养基(WA)、麦芽浸膏培养基(MEA);高羊茅煎煮液:取新鲜高羊茅20 g切成5 cm小段,加入1 000 mL蒸馏水,煮沸20 min,煎煮液以双层纱布过滤,再以蒸馏水补至1 000 mL。配制PDA和WA时以高羊茅煎煮液代替蒸馏水使用,以制作高羊茅煎液马铃薯琼脂糖培养基(PSA)和高羊茅煎液水琼脂培养基(WSA)。
1.2.3温度对内生真菌生长的影响用接种环(直径为5 cm,下同)将分离纯化的内生真菌接种至自然pH的PDA平板,分别在8种温度梯度(13、16、19、22、25、28、31、34℃)下黑暗培养,每周测量菌落直径。
1.2.4酸碱度对内生真菌生长的影响用接种环将分离纯化的内生真菌接种至PDA平板,分别在pH 3.5、5.5、7.5、9.5、11.5梯度25℃黑暗培养,每周测量菌落直径。
1.2.5培养基对内生真菌生长的影响用接种环将分离纯化的内生真菌接种至PDA、MEA、WA、PSA、WSA等5种pH 7.5的培养基中25℃下黑暗培养,每周测量菌落直径。
1.2.6光照条件和培养基对内生真菌产孢量的影响用接种环将分离纯化的内生真菌接种至PDA、MEA、WA、PSA、WSA等5种pH 7.5培养基中,25℃下24 h光照培养、黑暗培养、12 h光照/12 h黑暗交替培养,培养试验结束后进行孢子量的测定。
1.2.7内生真菌显微形态参考文献[16]的方法,挑取菌落边缘菌丝,制作水浸片在光学显微镜下观察记录分生孢子及分生孢子梗的形态。
1.3数据处理
采用SPSS 19.0软件对试验结果进行分析。
2结果与分析
2.1内生真菌侵染情况
在试验组和对照组高羊茅的叶片、叶鞘、茎节中均观测到内生真菌菌丝体,且形态(分布)特征较为一致。贴着细胞壁生长,多数平行于宿主细胞的长轴,单行排列在细胞间隙中,粗细比较均匀几乎没有分叉,局部偶见弯曲,不穿透宿主细胞。内生真菌在叶片中沿着海绵组织的延长方向生长,且多在气孔附近;在叶片和叶鞘中则较为稀疏,叶鞘中菌丝体沿着叶脉平行的方向排列,纵向生长;茎节间菌丝体靠近维管束,呈不规则的排列,且分布比较密集,常形成致密网状(图1)。

图1 高羊茅中的内生真菌(40×10)Fig.1 Entophytic fungi of Festuca arundinacea(40×10)
通过对试验材料的叶片、叶鞘、茎节等组织的镜检观察统计,发现内生真菌对茎节的侵染最多,在叶鞘的侵染较多,在叶片中的侵染最少(表1),在不同部位两两之间均达到显著差异(P<0.05)。
收集于2个时期(5月和10月)的试验材料,5月采集的样品的叶片、叶鞘和茎节的内生真菌侵染率更高(同10月收集的样品相比)。经过方差分析(表2),发现内生真菌的侵染率,在两个时期的试验材料的不同部位间均差异显著(P<0.05)。
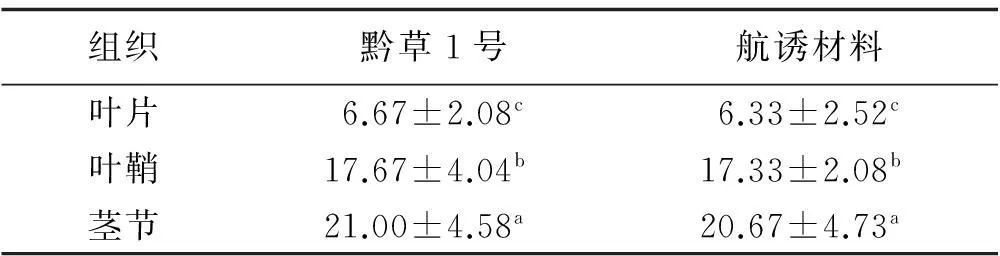
表1 内生真菌在航天诱变高羊茅不同组织的侵染
注:同列数据不同小写字母表示差异显著(P<0.05),下同
2.2内生真菌分离培养
2.2.1分离条件优化为达到最佳的内生真菌分离效果,对分离材料的表面消毒时间进行优化(表3),75%乙醇和2% NaClO对试验材料不同组织的消毒时间不同,分离内生真菌的分离率亦会有差异,但随着灭菌时间的增加,其内生真菌分离率呈现出先增加后减少的趋势。
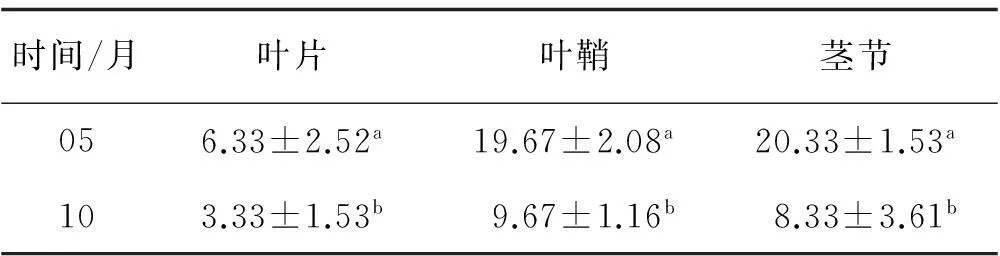
表2 不同时间采集高羊茅的内生真菌侵染
2.2.2温度和酸碱度对内生真菌的影响在最优的分离条件下,以镜检到内生真菌侵染的植株为材料,采用PDA培养基,自然pH进行内生真菌分离培养,待分离的内生真菌菌株经纯化后展开内生真菌的温度优化培养研究(表3)。
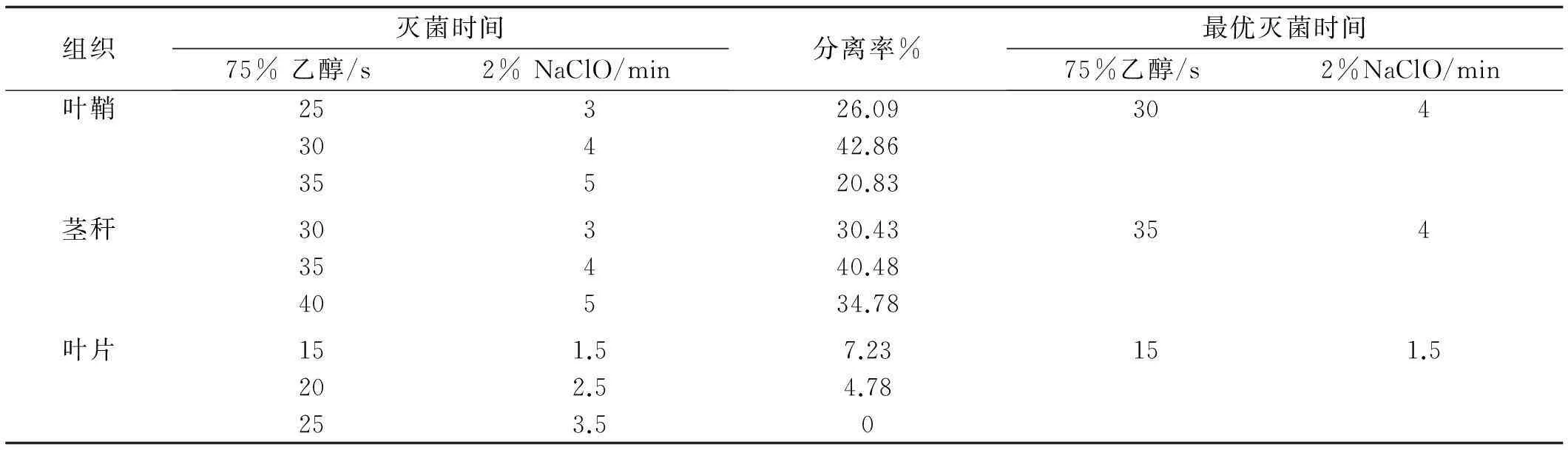
表3 航天诱变高羊茅中不同组织的内生真菌分离结果
分离到的内生真菌在13~34℃均可以生长,但在22~28℃生长情况较佳,菌落生长量由高到低的温度条件依次为:25℃>22℃>28℃>19℃>16℃>31℃>13℃>34℃,其中,在25℃的温度条件下培养3周后菌落直径显著高于其他温度梯度下的菌落直径(P<0.05),为最适生长温度(表4)。在相同温度条件下,菌落直径均随时间而增长,且各温度条件下不同时期(1~3周)间菌落直径差异显著(P<0.05)。
在25℃的最适温度条件下,展开内生真菌的pH优化培养研究,结果发现分离的内生真菌在pH5.5~9.5可以生长较好,当培养菌株的pH为3.5时,在培养的第1周完全观察不到菌株的生长,但在培养的第2周即开始生长,表现出分离的内生真菌具有一定的耐酸性;当培养菌株的pH 11.5时,菌株生长缓慢且在培养的前两周几乎不生长;当培养菌株的pH 7.5时,所培养的菌落直径显著(P<0.05)高于其他pH梯度下的菌落直径,为最适生长pH(表5)。
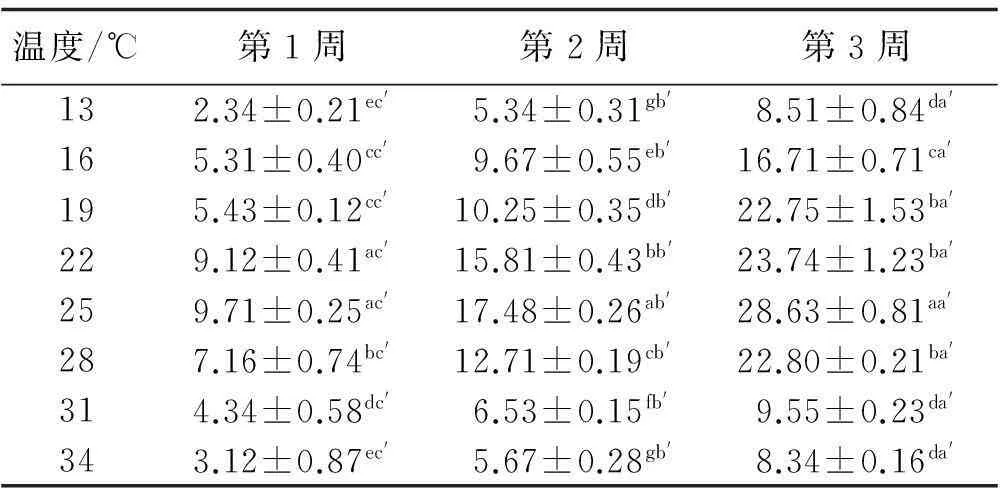
表4 不同温度下菌落直径
注:同列数字不同字母a、b、c,同行数字不同字母a′、b′、c′,均表示差异显著(P<0.05),下同
2.2.3培养基种类对内生真菌生长和产孢量的影响在25℃和pH 7.5条件下,采用PDA、MEA、WA、PSA、WSA等5种培养基对内生真菌培养3周,均能使分离菌株生长,菌落的生长量从高到低为:PSA>PDA>MEA>WSA>WA,其中,WA水培养基的菌株培养效果最差;添加高羊茅煎煮液的马铃薯琼脂糖培养基PSA在3周培养试验中,所生长的菌株直径均显著(P<0.05)大于其他种类的培养基,为培养分离菌株的最适培养基(表6)。
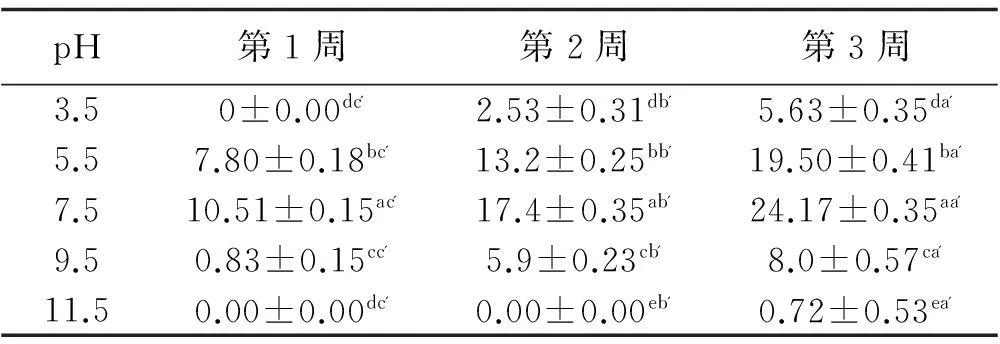
表5 不同pH下菌落直径
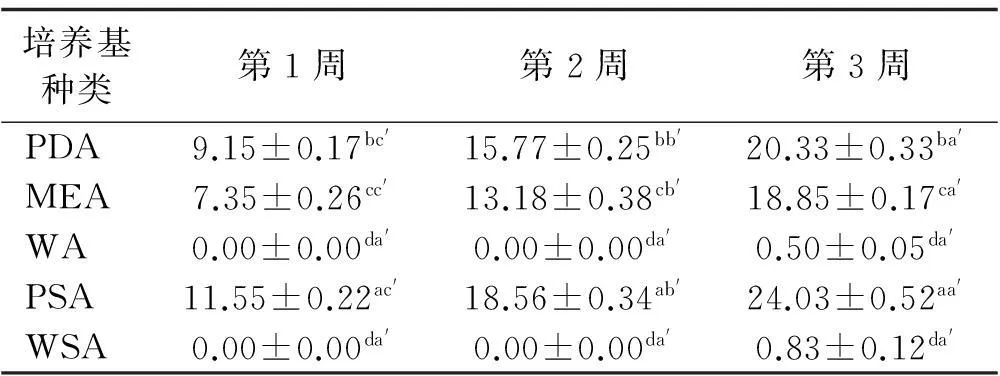
表6 不同培养基下培养菌落直径
以紫外光照条件和PDA、MEA、WA、PSA、WSA等5种培养基进行内生真菌的促孢优化培养,WSA,WA和MEA都可以诱导分离菌株产孢,其中WSA和
WA在全黑暗培养和全紫外光照射条件下均产孢,而在紫外光照/黑暗交替培养条件下,WA和WSA产孢量同全黑暗培养和全紫外光照射条件下相比增多,MEA培养基亦开始产孢(表7)。
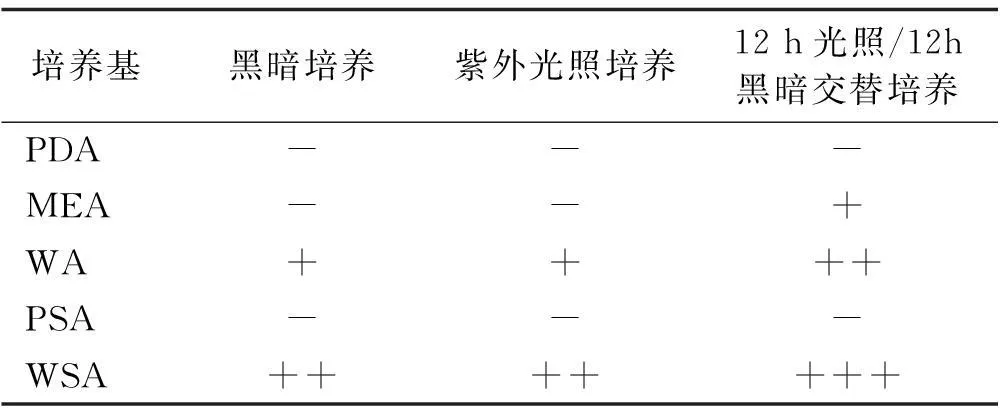
表7 不同光照条件下的促孢结果
注:+++产孢较多,++产孢多,+产孢少,-不产孢
2.2.4从不同材料中分离培养的内生真菌以最佳培养条件对前期镜检到内生真菌侵染最多的高羊茅组织(茎节)进行分离培养。结果表明从150个黔草1号高羊茅的茎节组织块中分离到了33个菌落,分离率达22.00%,从150个高羊茅航天诱变材料的茎节组织块中分离到了29个菌落,分离率达19.33%。经促孢培养,从黔草1号分离的菌落有24.24%产孢,航诱材料分离的菌落有27.58%产孢,部分菌落及孢子形态见图2、3。
3讨论
研究发现在高羊茅黔草1号及其航天诱变材料的茎节、叶鞘和叶片中普遍存在内生真菌,从镜检的结果分析对照组和试验组中的内生真菌侵染率差异不显著(P>0.05),且这些内生真菌的分布特点类似。在茎节中菌丝不规则分布在茎组织细胞间隙,叶鞘中的菌丝纵向与叶轴平行,在叶片中的菌丝体分布于叶肉细胞间隙并靠近气孔,这与Latch[1],Schardl[17-18]和ZHAO等[19]报道的Epichloё内生真菌的菌丝体主要分布在茎节、叶鞘、叶片等组织中,且在茎节、叶鞘中分布较多,叶片中分布较少[13,17,19]的结论一致。此外,研究通过显微镜镜检发现,内生真菌在5月的春夏季对比于同年10月,内生真菌对相同宿主的侵染后的镜检观察率更高,达极显著差异(P<0.01),有研究报道春夏季节内生真菌的活性更高[20-21],春夏时节对比其他季节内生真菌比较活跃,故而对于内生真菌的相关研究应尽量在这个时间展开。
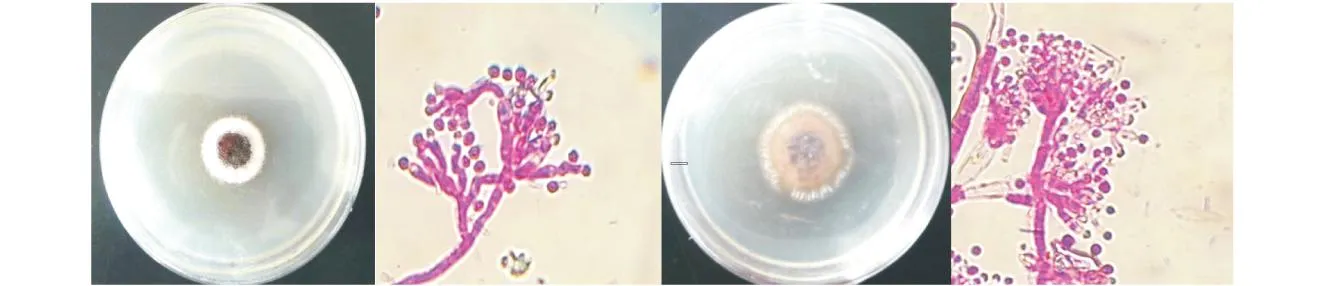
图2 高羊茅黔草1号分离菌株及其孢子形态(40×10)Fig.2 Cultivation of endophytic fungi colony and spores of QianCaoNO.1
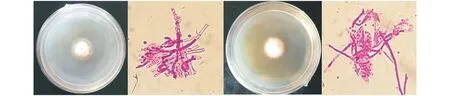
图3 航天诱变高羊茅分离菌株及其孢子形态(40×10)Fig.3 Cultivation of entophytic fungi colony and spores of aerospace mutation
对分离的内生真菌培养研究后发现,这些内生真菌适合黑暗培养且在低于13℃和高于32℃时生长缓慢,其最适生长温度为25℃,这与分离寄主高羊茅的适宜生长温度符合,且与其他国内外研究者的结论相似[1,22-23];在pH 5.5~9.5的PDA培养基上均可生长,培养的最佳pH 7.5,说明这些内生真菌具备一定的酸耐受能力;相同生长条件下,这些内生真菌在PDA的改良培养基PSA上的生长情况最好,可能的原因是后者所添加的高羊茅煎煮液具备某种促进内生真菌生长的物质。同时,这些内生真菌在12 h光照/12 h黑暗交替培养条件下的WA、WSA培养基上的产孢量高于其他3种,而添加了高羊茅煎煮液的WSA培养基的产孢量又比WA培养基高,一方面有研究报道这是处于富营养时菌株优先营养生长,当生长环境下营养匮乏时菌株优先形成孢子[15,24],因此,菌株生长状况良好的PDA,PSA和MEA培养基进行促孢实验时效果较差;另一方面可能是由于紫外光改变和破坏结构突变,改变了细胞的遗传转录特性作用,这种紫外灯(交替)照射处理给人工培养在单纯且均一环境下菌株一定的环境胁迫,协同WA(WSA)培养基一同抑制了菌丝体的营养生长,故而促进了菌株的繁殖,大量产孢[25-26]。
试验从黔草1号高羊茅及其航天诱变材料中均分离到内生真菌菌株,这些菌株的培养性状表现出一定的差异。从黔草1号中分离到的菌株中央平坦,正面多呈灰、褐色,背面为棕色,气生菌丝毡状或絮状,边缘整齐或辐射状(图2);从航天诱变材料中分离到的菌株中央凸起,正面多白色,背面为褐色,气生菌丝毡状或絮状,边缘辐射状(图3)。此外,这些菌株的孢子形态较为一致,将其初步鉴定为麦角菌科香柱菌属[27-28],但体外培养的内生真菌菌落形态具有极大的多样性[1,13],因此在进一步研究前应该通过分子技术对其进行更为客观的鉴定。
参考文献:
[1]Latch G C M,Christensen M J.Ryegrass endophyte,incidence and control[J].New Zealand Journal of Agricultural Research,1982,25:443-448.
[2]王志伟,纪燕玲,陈永敢.禾本科植物内生真菌资源及其物种多样性[J].生态学报,2010,30(17):4771-4781.
[3]李晓帅,湛 妲,孙鑫博,等.禾草内生真菌研究进展[J].草原与草坪,2012(6):82-89.
[4]牛燕芬,李扬苹,罗富成,等.植物内生真菌对寄主生长及抗逆性的增效机理研究进展[J].草原与草坪,2015,35(2):91-96.
[5]Jillian L,Walsh,Matthew H,etal.Fusarium:two endophytic novel species from tropical grasses of northern Australia[J].Fungal Diversity,2010,44(1):149-159.
[6]Leopoldo J,Iannone,James F White,etal.Diversity and distribution of Neotyphodium-infected grasses in Argentina.[J].Mycol Progess,2011(10):9-19.
[7]Zabalgogeazcoa L,Aldana B R V,Ciudad A G,etal.Fungal endophytes in grasses from semi-arid permanent grasslands of western Spain[J].Grass and Forage Science,2003(58):94-97.
[8]Romani M,Piano E,Pecetti L.Collection and preliminary evaluation of native turfgrass accessions Italy[J].Genetic Resources and Crop Evolution,2002(49):341-348.
[9]李振东,陈秀蓉,李鹏.紫花针茅内生细菌的分离与鉴定[J].草原与草坪,2011,31(1):8-12.
[10]李秀璋,姚祥,李春杰,等.禾草内生真菌作为生防因子的潜力分析[J].植物生态学报,2015,39(6):621-634.
[11]Pennell C G L,Rolston M P.Novel uses of grass endophyte technology[C].Lanzhou:Proceedings of the 8th International Symposium on Fungal Endophyte of Grasses,2012:211-214.
[12]李娟,吴佳海.高羊茅航天诱变新品系光合日变化及水分利用效率研究[J].农技服务,2015(8):4-5.
[13]Chun jie Li,Zhibiao Nan,Fei Li.Biological and physiological characteristics of Neotyphodium gansuense symbiotic with Achnatherum inebrians[J].Microbiological Research,2008,163(4):431-440.
[14]柳莉,李秀璋,郭长辉,等.不同培养基对禾草内生真菌Epichloё生长与产孢的影响[J].草业科学,2015,32( 6):859-869.
[15]王静,任安芝,谢凤行,等.几种诱导黑麦草LoliumperenneL.内生真菌产孢的方法[J].菌物学报,2005,24(4):590-596.
[16]Kang Y,Ji Y L,Sun X H,etal.Taxonomy of Neotyphodium endophytes of Chinese native Roegneria plants[J].Mycologia,2009,101(2):211-219.
[17]Schardl C L.Epichlo festucae and related mutualistic symbionts of grasses[J].Fungal Genetics & Biology Fg & B,2001,33(2):69-82.
[18]Schardl C L,Phillips T D.Protective grass endophytes where are they from and where are they going[J].Plant Disease,1997,81(5):430-438.
[19]ZHAO Xiao-jing,WANG Ping,LI Xiu-zhang,etal.Distribution characteristics of Epichloё endophyte in gramineous grasses[J].Pratacultural Science,2015,32(8):1206-1215.
[20]徐瑞,南志标,周雁飞,等.披碱草内生真菌共生体中麦角生物碱的组织分布与季节动态[J].草业学报,2012(6):84-92.
[21]相延英,明乾良,李文超,等.三尖杉内生真菌的季节动态和组织分布研究[J].药学实践杂志,2013(4):267-270.
[22]Christensen M J,Latch G C M,Tapper B A.Variation within isolates of Acremonium endophytes from perennial ryegrasses[J].Mycological Research,1991,95(8):918-923.
[23]Moy M,Belanger F,Duncan R,etal.Identification of epiphyllous mycelial nets on leaves of grasses infected by Clavicipitaceous endophytes[J].Symbiosis,2000(20):91-302.
[24]Gazis R,Chaverri P.Diversity of fungal endophytes in leaves and stems of wild rubber trees(Hevea brasiliens is in Peru[J].fungal Ecol,2011(3):240-254.
[25]郭春秋,罗永兰,张志元.几种真菌的诱导产孢试验[J].海南大学学报(自然科学版),2003(21):74-77.
[26]Guo L D,Hyde K D,Liew E C Y.Identification of endophytic fungi from Livistona chinensis based on morphology and rDNA sequences[J].New Phytologist,2000,147(3):617-630.
[27]魏景超.真菌鉴定手册[M].上海:科学技术出版社,1979.
[28]P Kirk,P Cannon,D Minter,etal.Dictionary of the Fungi[M].UK:Eghan and CBS,2008.
Distribution characteristics of entophytic fungi in tall fescue with aerospace mutation and its cultivation research
YANG Ding-yuan1,YANG Chun-yan2,LUO Chong1,WU Jia-hai2,ZENG Qing-fei2
(1.GuizhouNormalUniversity,GuiyangGuizhou,Guiyang550006,China;2.GuizhouIntituteofPrataculture,Guiyang550003,China)
Abstract:For clarifying the distribution and types of entophytic fungi in tall fescue (Qiancao NO.1) with aerospace mutation,the study firstly observed by optical microscopy and then conducted isolated culture to entophytic fungi of the tall fescue. The results showed that mycelium of entophytic fungi were widespread existed in the leaf,leaf sheath and pith internode ,the rank of entophytic fungi infection rate was pith > leaf sheath > leaf,but,there was no significant difference of infection rate between aerospace mutation sample and non- aerospace mutation sample (P>0.05);the optimal culture condition was pH 7.5,25 ℃ under light/dark alternate training and WSA media with tall fescue decoction liquid water.
Key words:aerospace mutation;tall fescue;entophytic fungi;infection detection;separation of culture
中图分类号:Q 948;S 54
文献标识码:A
文章编号:1009-5500(2016)02-0021-06
作者简介:杨鼎元(1989-),男,贵州赫章人,在读硕士研究生。
基金项目:贵州省科学技术基金“贵州高羊茅内生真菌资源及其多样性研究”(黔科合J字[2012]2202号);贵州师范大学研究生创新基金[研创2013(13)]资助
收稿日期:2015-12-23; 修回日期:2016-03-07
E-mail:yangdingyuanyy@163.com
吴佳海为通讯作者。

