生长调节剂对紫花苜蓿微扦插试管苗生长的影响
张 静,马晖玲
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
生长调节剂对紫花苜蓿微扦插试管苗生长的影响
张静,马晖玲
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
摘要:以紫花苜蓿品种甘农3号(G3)、和田(HT)、陇东(LD)为材料,研究不同种类和不同浓度的生长调节剂吲哚丁酸(IBA)、萘乙酸(NAA)、生根粉(ABT)对苜蓿微扦插试管苗生长的影响。结果表明,0.2 mg/L NAA处理下的G3紫花苜蓿试管苗生根率达100%,且具有较高的生根数(8),最大根长(17.5 cm),株高和叶片数也显著高于对照和其他处理(P<0.05);0.1 mg/L NAA处理下的和田紫花苜蓿试管苗的根系生长状况明显优于其他处理,生根率为100%,具有较高的生根数(7),最大根长(29.6 cm),株高和叶片数也显著高于对照和其他处理(P<0.05);0.2 mg/L NAA处理下的陇东紫花苜蓿试管苗的根系生长情况明显优于其他处理,生根率100%,并具有较高的生根数(7),最大根长(10.2 cm),株高和叶片数也显著高于对照和其他处理(P<0.05)。因此,在设置的浓度梯度下,甘农3号和陇东紫花苜蓿微扦插试管苗生长的最适生长调节剂及其浓度是0.2 mg/L NAA,适于和田紫花苜蓿的是0.1 mg/L NAA。
关键词:生长调节剂;紫花苜蓿;试管苗;微扦插
紫花苜蓿(Medicagosativa)为多年生豆科牧草,品质优良,营养价值高,适口性好,是重要的饲草植物。苜蓿还具有固氮,改良土壤品质,防风固沙,改善生态环境等重要的生态功能。因此,培育品质优良、生态适应性强的苜蓿新品种具有重要的经济价值和社会效益。而转基因技术是目前热门的育种育苗手段之一,它具有很强的针对性和目的性,通过转基因技术可准确获得所需的优良性状。但同时,由于外源基因的导入存在一定的偶然性,所以获得能表达所需性状的转基因再生苗的数量有限。
扦插作为一种无性繁殖手段,对苜蓿保优传代和加速繁殖,繁育良种具有重要意义[1],而微扦插是组织培养过程中获得大量再生苗的必要手段。通过转基因技术获得的转基因试管苗量较少,需要通过微扦插扩繁大批的转基因再生苗。影响试管苗微扦插繁殖效率的因素包括植物自身特性和外部因子。前者包括发育时期、生长部位及切口方式等,后者包括外源生长调节剂、培养基和环境因子(温度、湿度、光照等)。而外源植物生长调节物质通过促进插穗内部营养物质重新分配和内源激素的表达提高细胞内渗透压、吸水能力和酶活性,进而使细胞顺利进行脱分化和再分化,促进试管苗插穗生根[2]。
生长调节剂吲哚丁酸(IBA)、萘乙酸(NAA)、生根粉(ABT)已广泛应用于各类植物的扦插繁殖,外用生长调节剂能够促进根系发育,提高根冠比,增加枝条分蘖数[3]。如IBA可促进含笑插穗内部的生理生化变化的进程,特别是降低了过氧化物酶(POD)和酚类物质的含量,进而促进插穗生根[4];不同浓度的IBA对菊花“秀芳力”插穗生根的影响不同,其中1 500 mg/L处理区的生根效果最佳[5]。ABT1号500 mg/L处理可大大提高三倍体山杨扦插繁殖生根率和成活率[6];ABT生根粉也可用于桂花生根繁育,采用200 mg/L的处理效果最好[7];ABT生根粉用于新疆石榴嫩枝扦插育苗,1 000 mg/L生根粉处理下生根成活率最高,1 500 mg/L 生根粉处理下生根量最大[8]。香石竹在不同浓度的NAA处理下,生根成活情况不同,500 mg/L NAA处理下,生根成活率最高[9]。
通过研究不同浓度生长调节剂IBA,NAA和ABT对3个紫花苜蓿品种微扦插试管苗生长的影响,旨在获得3个紫花苜蓿品种试管苗微繁的最适浓度生长调节剂,为组织培养获得大量转基因试管苗提供参考。
1材料和方法
1.1供试材料
供试紫花苜蓿品种为甘农3号(G3)、和田(HT)、陇东(LD),紫花苜蓿品种的种子由北京克劳沃公司提供。
1.2试验方法
1.2.1试管苗插穗的获得选取品相优良、饱满有光泽的种子,自来水浸泡40 min,在超净工作台用75%的酒精和20%的NaCl消毒后接种于无菌MS培养基上,室温条件下培养,待幼苗生长至5 cm,选取生长健壮的幼苗,转移到新的无菌MS培养基中,每瓶5株,每个品种15瓶,转移过程尽量减少对叶和根的损伤[10]。幼苗生长至8~10 cm,于超净工作台上从幼苗各个生长点剪断获得试管苗插穗。
1.2.2不同浓度生长调节剂及测定指标培养基采用1/2MS+1%蔗糖+0.7%琼脂[11-13],其中分别添加IBA,NAA和ABT 3种外源生长调节剂,设置浓度梯度0.05、0.1、0.2、0.5、1.0、2.0 mg/L NAA,0.1、0.5、1.0、2.0、3.0 mg/L IBA,0.1、0.5、1.0、2.0、3.0 mg/L ABT,共16个处理,以不加任何生长调节剂的1/2 MS培养基为对照(CK),对照和处理均重复3次,每个重复接种4株。人工培养箱培养,培养条件在25 ℃、16 h光照,光强为1 600~2 000 lx,待培养8周后,测定其根数、最大根长、生根率、叶片数、株高5个指标[14]。各处理对应编号1~6为0.05、0.1、0.2、0.5、1.0、2.0 mg/L NAA,编号7~11为0.1、0.5、1.0、2.0、3.0 mg/L IBA,编号12~16为0.1、0.5、1.0、2.0、3.0 mg/L ABT。培养基均121℃高压灭菌26 min,接种工作均在超净工作台进行。
1.2.3数据处理采用SPSS 19.0统计软件对试验数据进行单因素方差分析,用Duncan法进行多重比较。
2结果与分析
2.1生长调节剂对G3紫花苜蓿微扦插试管苗生长状况的影响
2.1.1生长调节剂对G3紫花苜蓿微扦插试管苗根系影响不同浓度的NAA,IBA和ABT处理后,除3.0 mg/L ABT处理外,其他处理对G3生根有明显促进作用。其中,0.2 mg/L NAA处理的试管苗根系生长状况最佳,生根率达100%,植株高大健壮,根系发达,最大根长为17.5 cm,3.0 mg/L ABT处理最差,生根率为零,基部膨大形成黄绿色愈伤组织(表1)。

表1 不同浓度生长调节剂处理下的甘农3号试管苗根系生长状况
2.1.2生长调节剂对G3紫花苜蓿微扦插试管苗株高的影响0.2 mg/L NAA处理下的试管苗株高显著高于对照和其他处理(P<0.05)。0.05、2.0 mg/L NAA,1.0、3.0 mg/L IBA,1.0、2.0、3.0 mg/L ABT处理下的试管苗株高与对照无显著差异(P>0.05),其余处理下的试管苗株高均与对照差异显著(P<0.05)(图1)。
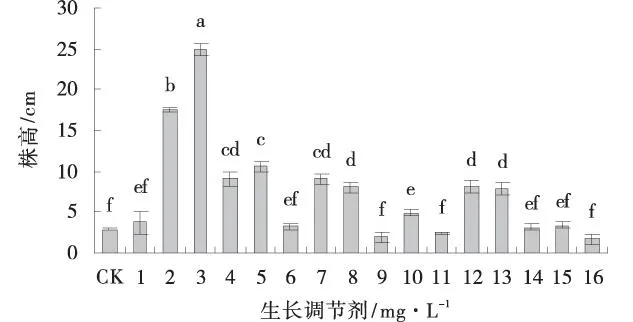
图1 不同浓度生长调节剂处理下的G3的试管苗株高Fig.1 The tube seedlings of plant height of Gannong no.3 alfalfa under different concentrations of growth regulators treatments注:不同小写字母表示差异显著(P<0.05),图2~6同
2.1.3生长调节剂对G3微扦插试管苗叶片数的影响0.2 mg/L NAA处理的试管苗叶片数显著高于对照和其他处理(P<0.05)。2.0 mg/L NAA,1.0、3.0 mg/L IBA,0.1、0.5 mg/L ABT处理的试管苗叶片数与对照无显著差异(P>0.05),其余处理叶片数2均显著高于对照(P<0.05)(图2)。
2.2生长调节剂对HT紫花苜蓿微扦插试管苗生长状况的影响
2.2.1生长调节剂对HT紫花苜蓿微扦插试管苗根系生长状况的影响试验设置的不同浓度生长调节剂对和田紫花苜蓿试管苗生根都具有促进作用,各浓度处理下的生根率都高于对照。其中,0.1 mg/L NAA和1.0 mg/L IBA处理下的试管苗生根率为100%,植株生长健壮,须根系发达,最大根长分别为29.6 cm和15.1 cm。3.0 mg/L ABT处理的试管苗根系生长状况最差,基部先膨大形成愈伤组织,再从膨大部分生出少量簇生根,最大根长为1.1 cm(表2)。

图2 不同浓度生长调节剂处理下的G3紫花苜蓿的试管苗叶片数Fig.2 The tube seedlings of leaf number of Gannong no.3 alfalfa under different concentrations of growth regulators treatments

处理根数/条·株-1最大根长/cm生根率/%生长状况CK32.333苗矮小,根细,发白,短165.058苗较矮,根较粗壮,发白或黄,较短2729.6100苗高大健壮,根较粗壮,发白或黄,长,须根发达346.892苗高大健壮,根较细,发白或黄,较短,须根发达462.892苗生长中等,根细,发白,短564.183苗生长中等,根细,发白或黄,较短633.742苗矮小,部分基部膨大,形成疏松愈伤组织,呈黄绿色7516.783苗较矮,根较粗壮,发白或黄,长,须根发达856.875苗生长中等,根细,发白或黄,较长9515.1100苗高大健壮,根较粗壮,发白或黄,长,须根发达10310.375苗生长中等,根较粗壮,发白,较长11313.858苗矮小,根较细,发白或黄,长,须根发达1252.883苗生长中等,根细,短,簇生状1362.375苗较矮,根细,短,簇生状1432.667苗较矮,根细,短,簇生状1541.683苗生长中等,根细,短,簇生状1681.142苗基本不生长,根细,短,簇生状
2.2.2生长调节剂对HT紫花苜蓿微扦插试管苗株高的影响0.1 mg/L NAA处理下的试管苗株高显著高于对照及其余处理(P<0.05),2.0 mg/L NAA和3.0 mg/L IBA处理下的试管苗株高与对照无显著差异(P>0.05),3.0 mg/L ABT处理下的试管苗株高显著低于对照(P<0.05)。可以看出,对HT紫花苜蓿试管苗株高的影响,0.1 mg/L NAA显著高于1.0 mg/LIBA(P<0.05)(图3)。

图3 不同生长调节剂处理下的和田紫花苜蓿的试管苗株高Fig.3 The tube seedlings of plant height of Hetian alfalfa under different concentrations of growth regulators treatments
2.2.3生长调节剂对HT紫花苜蓿微扦插试管苗叶片数的影响0.1 mg/L NAA处理的试管苗叶片数显著高于对照和其余处理(P<0.05),2.0 mg/L NAA及1.0,2.0和3.0 mg/L ABT处理的试管苗与对照无显著差异(P>0.05)。对HT紫花苜蓿试管苗叶片数的影响,0.1 mg/L NAA显著高于1.0 mg/L IBA(P<0.05)(图4)。
2.3生长调节剂对LD紫花苜蓿微扦插试管苗生长状况的影响
2.3.1生长调节剂对LD紫花苜蓿微扦插试管苗根系生长状况的影响陇东紫花苜蓿对照生根率为零,不同浓度的生长调节剂NAA,IBA和ABT处理,对LD紫花苜蓿生根都具有促进作用。其中,0.2 mg/L NAA和0.1 mg/L IBA处理的试管苗根系生长状况最佳,生根率100%,植株高大健壮,根系发达,最大根长达到10.2 cm和12.1 cm。0.5 mg/L ABT处理的试管苗根系生长状况最差,生根率仅为17%,试管苗基本不生长,生根数极少,最大根长为0.7 cm(表3)。

表3 不同浓度生长调节剂处理下的甘农3号紫花苜蓿试管苗根系生长状况
2.3.2生长调节剂对LD紫花苜蓿微扦插试管苗株高的影响0.2 mg/L NAA处理的试管苗株高显著高于对照和其余处理(P<0.05),2.0 mg/L NAA和0.5 mg/L ABT处理的试管苗株高显著低于对照(P<0.05),1.0 mg/L NAA及0.1、1.0、2 mg/L ABT处理下的试管苗株高与对照无显著性差异(P>0.05)。0.2 mg/L NAA处理的试管苗株高显著高于0.1 mg/L IBA(P<0.05)(图5)。

图5 不同浓度生长调节剂处理下的陇东紫花苜蓿的试管苗株高Fig.5 The tube seedlings of plant height of Longdong alfalfa under different concentrations of growth regulators treatments
2.3.3生长调节剂对LD紫花苜蓿微扦插试管苗叶片数的影响0.2 mg/L NAA处理下的试管苗叶片数显著高于对和其余处理(P<0.05),2.0 mg/L NAA处理的试管苗叶片数显著低于对照(P<0.05),0.1,1.0、2 mg/L ABT处理下的试管苗叶片数与对照无显著性差异(P>0.05)。同样,对LD紫花苜蓿试管苗叶片数的影响,0.2 mg/L NAA显著高于0.1 mg/L IBA(P<0.05)(图6)。
3讨论
试管苗微扦插繁殖能够保持植物特有的遗传性质,还能在短时间内获得大量试管成活苗,是组织培养过程植物微繁的重要手段。培养基中加入适宜的生长调节剂,能够提高试管苗插穗细胞渗透压、吸水力和酶活性,使细胞顺利完成脱分化和再分化,缩短生根时间、提高生根率和根系质量[15]。在适宜的生长调节剂浓度范围内,加入一定浓度的生长调节剂对苜蓿试管苗根系生长都有一定的促进作用,但对G3紫花苜蓿,3.0 mg/L ABT处理下无根系生成,基部只有黄绿色愈伤组织生成。孙时轩等[16]研究表明,植物本身对外源生长调节剂的使用相对苛刻,不同生长调节剂对不同植物都有一个适宜的浓度范围,超出范围则会出现一定的毒害作用。试验表明ABT浓度较高,超出G3紫花苜蓿最适的ABT浓度范围,抑制G3紫花苜蓿根系的生成。王珺等[17]研究发现,NAA浓度在0~0.5 mg/L时,甘农4号和盛世的生根率随着NAA浓度的增加有所增加,一旦超出这个范围后,2品种的生根率反而下降。高明星等[18]研究也发现,诱导根分化以0~0.5 mg/L NAA和0.5 mg/L IBA较好,高浓度的NAA有利于根的分化而抑制茎芽的形成。
试验中,试管苗基部先膨大出现一定数量的愈伤组织,然后从膨大的愈伤组织部分再生出根系。郭英超等[19]发现,外源生长调节剂的使用,改变了苜蓿扦插基部IAA和GA的分布,基部IAA的含量显著增加,而GA的含量相对减少,使内源激素重新达到一个平衡点,先脱分化促进愈伤组织的形成,进而促进根系的生成。生根率和株高、根长、根数以及叶片数不呈绝对的正比关系,但在适宜的浓度范围内呈现出一定的相关性,较高的生根率对应的试管苗生根性状也相对较优。张博等[20]的研究发现,最优生根率和最佳生根性状没有对应关系。对于这一现象的发生,可以在今后的试验中加强大田扦插繁殖和试管苗微扦插繁殖方面的比较研究,进一步探讨2个时期的扩繁在最佳生根性状和最优生根率两者间的相关性是否存在差异。

图6 不同浓度生长调节剂处理下的陇东苜蓿的试管苗叶片数Fig.6 The tube seedlings of leaf number of Longdong alfalfa under different concentrations of growth regulators treatments
试验参照以往苜蓿扦插繁殖常用的生长调节剂,采用NAA,IBA和ABT 3种外源生长调节剂进行单因素处理,3者之间没有组合处理,在后期的试验中,预采用连续水平的多因子组合试验,或许能得到更好的生长调节剂处理。
研究发现,适宜的生长调节剂可以提高苜蓿试管苗微扦插繁殖效率,在设置的浓度梯度下,0.2 mg/L NAA对G3紫花苜蓿试管苗生根的促进作用最佳,NAA对试管苗生长的促进作用优于ABT和IBA;0.1 mg/L NAA对和田紫花苜蓿试管苗生根的促进作用最佳,NAA、IBA对试管苗生长的促进作用优于ABT;0.2 mg/L NAA对陇东紫花苜蓿试管苗生根的促进作用最佳,NAA和IBA对试管苗生长的促进作用优于ABT。影响苜蓿试管苗微扦插繁殖效果最好的为萘乙酸(NAA),吲哚丁酸(IBA)次之,生根粉(ABT)最差,这与张树振等[2]研究的大田苜蓿扦插繁殖效率的影响结果一致。另外,在试验过程中发现,G3紫花苜蓿在第7 d开始生根,和田和陇东紫花苜蓿在第9 d开始生根,在最终的数据统计中,G3紫花苜蓿在各个性状的表现也比其他2个品种更优,推断该试验条件可能更适合G3试管苗的微扦插繁殖。
参考文献:
[1]耿华珠.中国苜蓿[M].北京:中国农业出版社,1995.
[2]张树振,金樑,周虹,等.生长调节剂和基质对紫花苜蓿扦插繁殖效率的影响[J].草业科学,2013(6):874-879.
[3]鄢燕,张新全,张新跃.植物生长调节剂在牧草及草坪草上的应用研究进展[J].草原与草坪,2003(3):7-11.
[4]刘玉艳,于凤鸣,于娟.IBA对含笑扦插生根影响初探[J].河北农业大学学报,2003(2):25-29.
[5]吴春花,郑成淑,李莲花,等.IBA和NAA对菊花“秀芳力”扦插生根的影响[J].延边大学农学学报,2001(1):54-57.
[6]陈开陆,罗定焱.NAA处理香石竹扦插生根效果研究[J].西昌农业高等专科学校学报,2001(2):10-11.
[7]刘雅琴,冀永敏,王创立,等.“三倍体”山杨扦插繁殖生根激素选择研究[J].山西林业科技,1992(3):41-43.
[8]沈元勤,方占莹,丁风刚,等.ABT生根粉不同浓度对桂花扦插成活率影响试验[J].湖北林业科技,2011(2):32-33.
[9]高航洋,张启香,胡恒康,等.天目杜鹃组培苗生根培养体系的优化[J].浙江农林大学学报,2011(6):982-985.
[10]史毅,马晖玲.三个苜蓿品种植株高频再生体系的研究[J].甘肃农业大学学报,2014(2):125-132.
[11]张万民,熊燕,王瑞清.ABT生根粉应用于新疆石榴嫩枝扦插育苗的研究[J].安徽农业科学,2009(9):4106-4107.
[12]王娟,师尚礼.不同苜蓿品种再生体系的差异性比较[J].草原与草坪,2010(3):66-69.
[13]张万军,王涛.紫花苜蓿愈伤成苗高频再生体系的建立及其影响因子的研究[J].中国农业科学,2002(12):1579-1583.
[14]段亚楠,卢福荣,茹艺,等.紫花苜蓿组织培养高频再生体系的建立[J].北方园艺,2013(15):127-129.
[15]王文英,翁和录,刑世岩.植物生长调节剂在扦插繁殖中的应用[J].林业实用技术,2002(7):9-10.
[16]孙时轩.造林学[M].北京:中国林业出版社,2000:153.
[17]王珺,柳小妮.植物激素对2个紫花苜蓿品种再生体系的影响[J].草原与草坪,2010(6):15-18.
[18]高明星,许智宏.紫云英叶片及叶肉原生质体的培养[J].实验生物学报,1985(4):379-388.
[19]郭英超,杜克久,贾哲.兴安圆柏扦插生根过程中相关内源激素特征分析[J].中国农学通报,2012(1):44-48.
[20]张博,兰再平,马可,等.不同激素处理和基质配方对楸树嫩枝扦插生根的影响[J].林业科学研究,2011(6):749-753.
Effects of growth regulator on micro-cuttage tube seedlings growth of alfalfa
ZHANG Jing,MA Hui-ling
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
Abstract:Taked Gannong No.3 (G3),Hetian (HT),Longdong (LD)alfalfa as the experimental material,the paper studied the effects of different kinds and concentration of growth regulator,including indolebutyric acid (IBA),naphthalene acetic acid (NAA),ABT (ABT) on growth of micro-cuttage tube seedlings of alfalfa.The results showed that under 0.2 mg/LNAA treament,tube seedlings of Gannong no.3 alfalfa had the high number of roots (8),maximum root length (17.5 cm), the highest rooting rate (100%) ,and plant height and leaf number was also significantly higher than that of the control (CK) and other treatment (P<0.05).Under 0.1 mg/LNAAtreatment,the root growth of tube seedlings of Hetian alfalfa was obviously superior to other treatments,the rooting rate was 100%,root number was higher (7)and root length was maximum (29.6 cm),plant height and leaf number was also significantly higher than that of the control (CK) and other treatment s(P<0.05).Under 0.2 mg/LNAA treatment,the root growth of Longdong alfalfa tube seedlings was obviously superior to other treaments,the rooting rate was 100%,the root number was higher (7) and the root length was maximum (10.2 cm),the plant height and leaf number was also significantly higher than that of the control (CK) and other treatments(P<0.05).Therefore, the optimal growth regulator and its concentration for Longdong and Gannong No.3 alfalfa and Hetian alfalfa in micro-cuttage tube seedlings growth was 0.2 mg/L NAA and 0.1 mg/L NAA,repectively.
Key words:growth regulator;alfalfa;tube seedlings;micro-cuttage
中图分类号:S 541.9
文献标识码:A
文章编号:1009-5500(2016)02-0076-07
作者简介:张静(1991-),女,甘肃定西人,在读硕士研究生。
基金项目:“十二五”农村领域国家科技计划“奶牛优质饲草品种选育与资源高效利用技术及模式研究”(2012BAD12B02-4)资助
收稿日期:2015-08-12; 修回日期:2015-10-20
E-mail:614675821@qq.com
马晖玲为通讯作者。

