胰管外引流与早期肠内营养在胰十二指肠切除术中的应用体会
郑振江, 张 抒, 蒲光春, 曹 扬, 肖渝清, 于 澜
(成都市第三人民医院, 成都 610031)
胰管外引流与早期肠内营养在胰十二指肠切除术中的应用体会
郑振江, 张 抒, 蒲光春, 曹 扬, 肖渝清, 于 澜
(成都市第三人民医院, 成都 610031)
目的:探讨胰管外引流与早期肠内营养在胰十二指肠切除术中的应用。方法: 回顾性分析2011年1月至2015年12月我院收治的58例行胰管外引流与早期肠内营养的胰十二指肠切除术患者,观察术后并发症发生情况及胃肠功能恢复时间。结果: 术后2例患者死亡,死亡率为3.4%。总的并发症发生率为53.4%,其中1例患者因腹腔出血行动脉栓塞术。术后肛门排气时间为3~7天,平均(4.5±0.9)天。术后第7天患者血清白蛋白水平与术前比较差异无统计学意义(P>0.05)。结论: 胰十二指肠切除术中使用胰管外引流和安置空肠造瘘管进行早期肠内营养,能减少术后并发症发生率,促进胃肠功能恢复,改善营养状况。
胰十二指肠切除术; 胰管外引流; 早期肠内营养; 胰瘘
胰十二指肠切除术是腹部外科最为复杂的手术之一,1935年Whipple首次报道使用该术式治疗壶腹部周围肿瘤[1]。经过近80年的发展和改良,胰十二指肠切除术已成为治疗胰头癌和壶腹部周围恶性肿瘤的经典术式,其术后并发症发生率、死亡率以及生存率已有很大的改观,国外大型医疗中心有连续150例胰十二指肠切除无死亡的报道[2]。与低死亡率相比,胰十二指肠切除术后并发症的发生率仍较高,为寻求减少术后并发症发生率的方法,我院自2011年1月至2015年12月对58例行胰十二指肠切除的患者采用胰管外引流与早期肠内营养,取得了满意的效果,现报道如下。
1 资料与方法
1.1 临床资料
本组共58例,男37例,女21例,年龄36~73岁,平均(53.5±9.4)岁。胰头癌36例,胆总管下段癌17例,十二指肠乳头癌5例。 术前血清白蛋白(40.1±2.9)g/L,总胆红素(196.1±71.5)mol/L。行标准胰十二指肠切除术48例,行保留幽门胰十二指肠切除术7例,行扩大胰十二指肠切除术3例。胰腺质地软18例,胰腺质地硬40例。根据胰管直径选择不同的胰肠吻合方式,如胰管直径≥3mm则采用胰腺空肠导管对粘膜吻合,如胰管直径<3mm则采用胰腺空肠端侧吻合。
1.2 手术方式
58例患者均采用胰、胆、胃的顺序(Child法)进行消化道重建,胰肠吻合方式按照以下两种方法:(1)胰腺空肠导管对粘膜吻合:用4- 0抗菌薇乔线距离胰腺断面0.5~1.0cm处将胰腺后缘组织与空肠对系膜缘浆肌层间断缝合,在胰管对应位置的空肠壁开一小孔,大小与胰管直径相当,将胰管与空肠粘膜后壁间断缝合,支撑管末端4~5cm范围内剪3~4个侧孔放入主胰管内,在距空肠断端0.5cm处打一小孔,胰管支撑管从此孔穿出,行双荷包缝合以固定和防漏,支撑管经左侧腹壁引出体外,胰管前壁与空肠粘膜间断缝合,最后胰腺前缘组织与空肠浆肌层间断缝合;(2)胰腺空肠端侧吻合:用4- 0抗菌薇乔线距离胰腺断面0.5~1.0cm处将胰腺后缘组织与空肠对系膜缘浆肌层间断缝合,将空肠对系膜缘打开与胰腺残端直径相当的孔,将空肠后壁全层与胰腺断端后缘间断缝合,支撑管末端4~5cm范围内剪3~4个侧孔放入主胰管内,在距空肠断端0.5cm处打一小孔,胰管支撑管从此孔穿出,行双荷包缝合以固定和防漏,支撑管经左侧腹壁引出体外,然后空肠前壁全层与胰腺断端前缘间断缝合,最后胰腺前缘组织与空肠浆肌层间断缝合。本组58例患者均在距胃空肠吻合口远端30cm处安置空肠造瘘管,经左侧腹壁引出体外。
1.3 术后治疗
术后常规抗炎、抑酸、生长抑素抑制胰腺分泌治疗,经中心静脉肠外营养支持(方案为输入“全营养混合液”,热量25kcal/kg·day-1,其中40%由脂肪供能,氮0.15g/kg·day-1,热氮比约为120kcal:1g,并添加常规剂量的矿物质与微量营养素)等。术后第一天经空肠造瘘管缓慢滴入温生理盐水500ml,术后第二天经空肠造瘘管缓慢滴入口服营养液(瑞代)500ml,约20滴/分钟,持续8~10小时,并将引流出的胰液经空肠造瘘管回输入肠道。肛门排气后开始肠内营养液(瑞代),并逐渐减少肠外和肠内营养的输入量,若无胃排空延迟,术后14天拔除空肠造瘘管;若有胃排空延迟,待胃排空延迟痊愈后拔除。若无胰瘘,胰管外引流管在术后2月拔除;若有胰瘘,待胰瘘痊愈后拔除。
1.4 观察指标及定义
记录术前检测的血生化、血淀粉酶和白蛋白。术后第1、3、7天检测的血生化、血淀粉酶、白蛋白和腹水淀粉酶。记录手术切除范围、手术时间、出血量。记录患者术后并发症发生情况,肛门排气时间以及住院时间。治愈出院标准:伤口愈合良好,拔除胃管、中心静脉管和腹腔引流管,恢复经口进食,不需输液,自主活动正常。胃排空延迟定义为术后持续胃肠减压超过10天,或术后14天尚不能恢复正常饮食[3];胰瘘定义为术后3天或3天以上,腹腔引流液淀粉酶活性大于血清淀粉酶活性正常上限的3倍,根据其严重程度分为A、B、C 3级:术后腹腔引流超过3天但未超过3周,无腹腔临床感染迹象,无需进行特殊治疗为A级;腹腔引流时间超过3周或者发生腹腔感染,需要进行治疗为B级;如果需要手术或介入治疗,或者出现其他严重不良反应为C级[4]。
1.5 统计学方法
采用SPSS16.0统计软件进行统计学分析,计量资料采用t检验,P<0.05表示差异有统计学意义。
2 结 果
全组58例患者, 平均手术时间为(427.3 ±92.5)分钟,平均出血量为(1 088.6 ±237.3) ml。2例患者分别于术后22天和6天死亡,其中一名患者术后第7天出现胃排空延迟,每天胃管引流量约800ml,在治疗10天后胃排空延迟症状无明显缓解,最终患者出现低蛋白血症,电解质紊乱,死于全身多器官功能衰竭;另一名患者术后第4天出现消化道大出血,考虑为胰腺断面出血,与患者家属沟通后,建议急诊胃镜介入或剖腹探查,但家属拒绝以上措施,选择内科保守治疗2天后死亡,术后死亡率为3.4%。发生术后并发症31例(胰瘘6例,出血8例,胃排空延迟7例,胆瘘1例,切口感染4例,肺部感染5例),总并发症发生率为53.4%(见表1)。胃排空延迟发生时间为术后6~14天,平均(9.2±2.6)天。其中一例患者因胰瘘于术后第7天发生腹腔大出血,急诊行选择性动脉造影检查,发现胃十二指肠动脉断端出血,行动脉栓塞止血成功。术后肛门排气时间为3~7天,平均(4.5±0.9)天。平均住院时间(23.7±11.0)天。
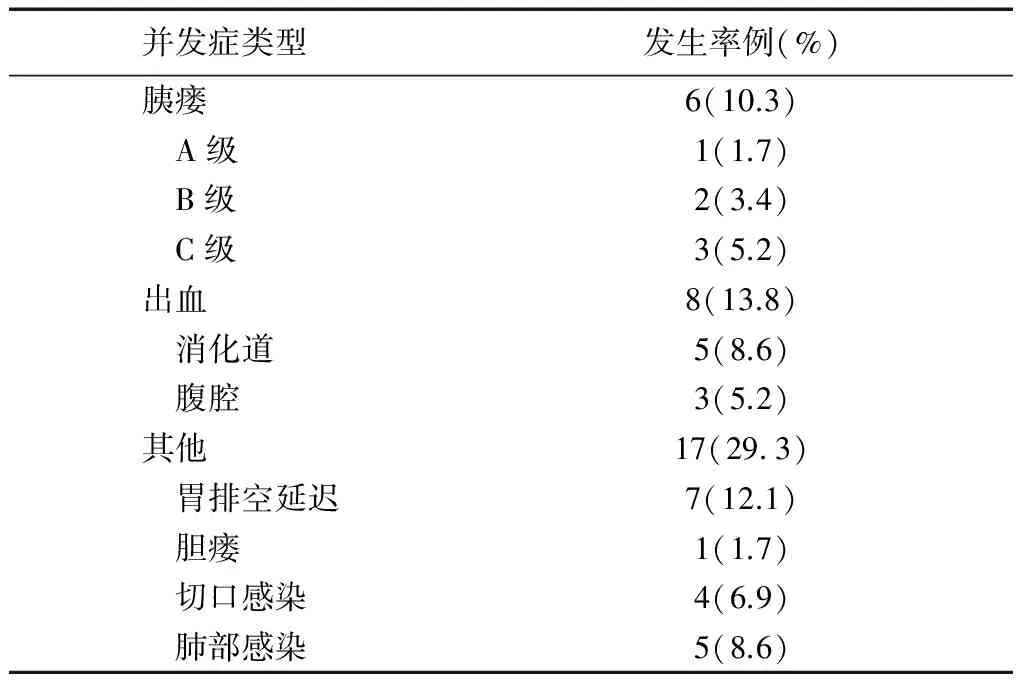
表1 胰十二指肠切除术后并发症发生率
对术前和术后的观察指标进行比较,发现术后患者白蛋白水平低于术前,但术后第7天已恢复至术前水平(P>0.05);术后总胆红素进行性下降,术后第3天已明显低于术前(P<0.05);术前和术后血淀粉酶无明显变化(P>0.05),见表2。
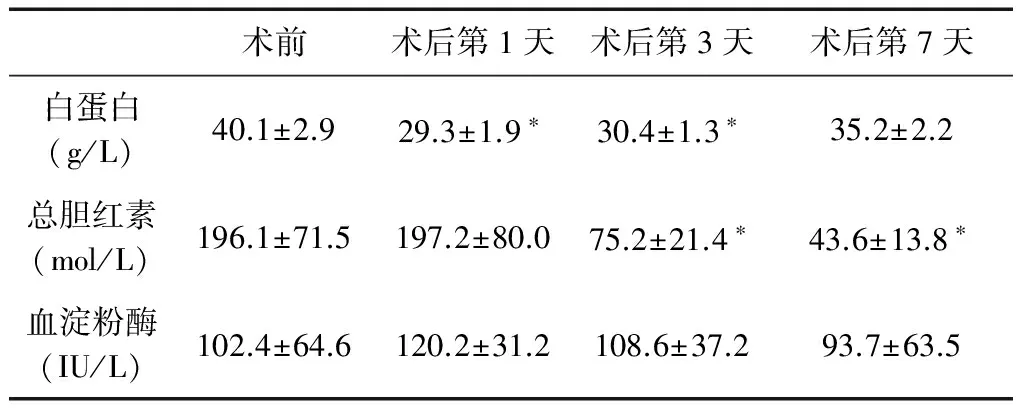
表2 术前与术后白蛋白、总胆红素及血淀粉酶的比较
*与术前比较,P<0.05
3 讨 论
胰十二指肠切除术是对外科技术要求极高的手术,对该手术的熟练程度直接反映医疗单位胰腺外科的医疗水平。随着手术技巧的提高,围手术期管理的进步以及手术器械的改进,术后死亡率有明显降低,但是其术后并发症的发生率尚较高。本组2例患者术后死亡,死亡率为3.4%。31例患者发生术后并发症,并发症发生率为53.4%,高于某些大的医疗中心报道的41%~49%的发病率[5-8]。
胰瘘是胰十二指肠切除术后主要的并发症,也是潜在危险性最大的并发症,渗出的胰液可侵蚀血管壁,导致假性动脉瘤的出现并且破裂出血,特别是淋巴结清除比较干净,血管骨骼化比较彻底的患者。当发生胰瘘如果引流不畅,极易发生迟发性出血。研究表明胰瘘的发生存在一些高危因素,其中质地柔软的胰腺组织,胰管直径小于3mm,术者的经验与胰瘘发生的相关性得到了公认。一篇2 664例胰十二指肠切除患者的文献回顾报道,慢性胰腺炎患者的胰瘘发生率为5%,胰腺癌患者为12%,壶腹部周围癌为15%,胆总管下端癌为33%[9]。在本研究中发生的C级胰瘘是一例十二指肠乳头腺癌患者,术前合并急性胰腺炎,胰腺质地软、轻度水肿,胰肠吻合时缝合线对胰腺组织切割明显。慢性胰腺炎的患者胰腺纤维化,胰腺外分泌功能受损,胰液分泌量减少,在行胰肠吻合时不易发生切割。研究发现胰十二指肠切除术在大型医疗中心术后并发症发病率低于手术量少的医院,提示术者经验的重要性[10]。
为了防止胰瘘的发生做了很多观念和技术上的改进,如术前的营养支持、术前减黄、胰肠吻合方式的改进、安置胰管支架、术后使用生长抑素等。对于这一系列革新是否有效,国内外学者做了大量随机对照研究,结果还存在一定的争议[9-13]。有3项前瞻性随机对照研究表明,通过胰管内安置支架外引流可分别将胰瘘的发生率从20%,42%和22%下降到6.7%,26%和6%[14-16]。Patel等[17]发表的一篇Meta分析结果再次证实胰管外引流能够降低胰瘘的发生和严重程度,从而减少住院时间。在本研究中我们采用国际胰腺外科研究小组对胰瘘的定义,胰瘘的发生率为10.3%,其中1例造成腹腔大出血,没有胰瘘相关死亡的患者。胰十二指肠术后胃肠功能未完全恢复,胰液及胆汁会潴留于空肠上段,胰液激活后对吻合口产生腐蚀作用,并且消化液的潴留会增加肠管内的压力,增加吻合口的张力,从而增加胰瘘发生的机率。本研究中早期肠内营养有促进肠蠕动功能的恢复,并且胰管外引流每日引流量约100~300ml,在这两种措施的共同作用下,可减少吻合口胰液的聚集,降低输入袢梗阻发生机率,降低胰肠吻合口的张力,从而减少胰瘘的发生。
术后出血是胰十二指肠切除术后致命的并发症,其发生率在5%~16%,根据部位分为消化道出血和腹腔内出血。消化道出血最常见的为胰腺断面,腹腔出血最常见的为胃十二指肠动脉的断端出血。早期出血常因术中止血不彻底,结扎不牢靠。晚期出血常因胰瘘、胆瘘、腹腔感染积脓,血管侵蚀所致。笔者认为胰腺断面需要常规进行8字缝扎或者叠瓦式缝扎,防止消化液侵蚀胰腺断面后发生出血,特别是行胰腺空肠端侧吻合的患者,更应该对胰腺断面进行缝扎。术中引流管的摆放位置和通畅引流可以减少漏出液的集聚,对术后出血有一定的防治作用。胰管外引流可减少胰液对胰腺断面的侵蚀,减少胰瘘的发生,从理论上说可以降低术后晚期出血的发生。但有前瞻性临床研究表明胰管外引流对术后出血发生没有影响[15]。当发生出血,若积极内科治疗,患者血压进行性下降,出血量大不能停止,首选选择性动脉造影,寻找出血血管进行动脉栓塞止血。内镜虽然也能发现消化道出血点并同时止血,但当消化道内有大量积血时会影响镜下视野致止血失败。
胰十二指肠切除术上消化道行3个吻合,为避免吻合口瘘的发生,在肛门排气前需禁食。胰腺癌患者术前大多存在营养不良,并且手术创伤大,术后营养不良进一步加重,使机体免疫力下降,增加并发症发生机会。腹部外科术后小肠蠕动功能在数小时后就可以恢复,这是进行早期肠内营养的基本前提。与全肠外营养相比,肠内营养对小肠有局部营养作用,能刺激肠蠕动,维持肠道粘膜屏障功能,防止肠道菌群易位,降低腹腔感染的发生[18]。在本研究中所有患者均在术中安置空肠造瘘管以便早期肠内营养,尤其是术后发生胃排空延迟不能进食的患者,可通过空肠造瘘管长期营养支持,不用担心因长期肠外营养而发生中心静脉导管相关感染,减少长期使用静脉营养液所产生的费用,减轻患者经济负担,而且经空肠造瘘管比经胃管进行肠内营养患者更容易耐受[19]。因胰管外引流和空肠造瘘管的联合使用,我们可以把每日引流出的胰液通过造瘘管回输入肠道,有利于维持全身水电解质平衡。但是有研究指出运用安置空肠造瘘管进行肠内营养可导致胃排空延迟的发生[20]。
总之,笔者认为胰十二指肠切除术中使用胰管外引流和安置空肠造瘘管进行早期肠内营养能减少术后并发症发生率,特别是胰瘘的发生,能促进胃肠功能恢复,手术操作简单易行,值得临床推广。空肠造瘘管的安置是否与胃排空延迟的发生相关,尚需要大样本前瞻性随机对照研究来证实。
[1] Whipple AO, Parsons WB, Mullins CR. Treatment of carcinoma of the ampulla of Vater [J]. Ann Surg, 1935, 102(4): 763-779.
[2] Murakami Y, Uemura K, Hayashidani Y,et al. No mortality after 150 consecutive pancreatoduodenctomies with duct-to-mucosa pancreaticogastrostomy [J]. J Surg Oncol, 2008, 97(3): 205-209.
[3] Park YC, Kim SW, Jang JY, et al. Factors influencing delayed gastric emptying after pylorus-preserving pancreatoduodenectomy [J]. J Am Coll Surg, 2003, 196(6): 859-865.
[4] Bassi C,Dervenis C,Butturini G,et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition [J].Surgery, 2005, 138(1): 8-13.
[5] Lermite E, Sommacale D, Piardi T, et al. Complications after pancreatic resection: diagnosis, prevention and management [J]. Clin Res Hepatol Gastroenterol, 2013, 37(3): 230-239.
[6] Assifi MM, Lindenmeyer J, Leiby BE, et al. Surgical Apgar score predicts perioperative morbidity in patients undergoing pancreaticoduodenectomy at a high-volume center [J]. J Gastrointest Surg, 2012, 16(2): 275-281.
[7] Yeo CJ, Cameron JL, Sohn TA, et al. Six hundred and fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes [J]. Ann Surg, 1997, 226(3): 248-257.
[8] Schmidt CM, Powell ES, Yiannoutsos CT, et al. Pancreaticoduodenectomy: a 20-year experience in 516 patients [J]. Arch Surg, 2004, 139(7): 718-727.
[9] Yeo CJ, Cameron JL, Maher MM, et al. A prospective randomized trial of pancreaticogastrostomy versus pancreaticojejunostomy after pancreaticoduodenectomy [J]. Ann Surg, 1995, 222(4): 580-592.
[10]Duffas JP, Suc B, Msika S, et al. A controlled randomized multicenter trial of pancreatogastrostomy or pancreatojejunostomy after pancreatoduodenectomy [J]. Am J Surg, 2005, 189(6): 720-729.
[11]Bassi C, Falconi M, Molinari E, et al. Reconstruction by pancreaticojejunostomy versus pancreaticogastrostomy following pancreatectomy: results of a comparative study [J]. Ann Surg, 2005, 242(6): 767-773.
[12]Takano S, Ito Y, Watanabe Y, et al. Pancreaticojejunostomy versus pancreaticogastrostomy in reconstruction following pancreaticoduodenectomy [J]. Br J Surg, 2000, 87(4): 423-427.
[13]Zeng Q, Zhang Q, Han S, et al. Efficacy of somatostatin and its analogues in prevention of postoperative complications after pancreaticoduodenectomy: a meta-analysis of randomized controlled trials [J]. Pancreas, 2008, 36(1): 18—25.
[14] Poon RT, Fan ST, Lo CM, et al. External drainage of pancreatic duct with a stent to reduce leakage rate of pancreaicojejunostomy after pancreaticoduodedenectomy. A prospective randomized trial [J]. Ann Surg, 2007, 246(3): 425-435.
[15] Pessaux P, Sauvanet A, Mariette C, et al. External pancreatic duct stent decreases pancreatic fistula rate after pancreaticoduodenectomy: prospective multicenter randomized trial [J]. Ann Surg, 2011, 253(5): 879-885.
[16] Motoi F, Egawa S, Rikiyama T, et al. Randomized clinical trial of external stent drainage of the pancreatic duct to reduce postoperative pancreatic fistula after pancreaticojejunostomy [J]. Br J Surg, 2012, 99(4): 524-531.
[17]Patel K, Teta A, Sukharamwala P, et al. External pancreatic duct stent reduces pancreatic fistula:A meta-analysis and systematic review [J]. Int J Surg, 2014, 12(8): 827-832.
[18] Chiang YH, Chao DP, Chu SF, et al. Early enteral nutrition and clinical outcomes of severe traumatic brain injury patients in acute stage: a multi-center cohort study [J]. J Neurotrauma, 2012, 29(1): 75-80.
[19]Torres Júnior LG, de Vasconcellos Santos FA, Correia MI. Randomized clinical trial: nasoenteric tube or jejunostomy as a route for nutrition after major upper gastrointestinal operations [J]. World J Surg, 2014, 38(9): 2241-2246.
[20]Martignoni ME, Friess H, Sell F, et al. Enteral nutrition prolongs delayed gastric emptying in patients after Whipple resection [J]. Am J Surg, 2000, 180(1): 18-23.
Applying of External Drainage of Pancreatic Fluid and Early Enteral Nutrition in Pancreaticoduodenectomy
Zheng Zhenjiang, Zhang Shu, Pu Guangchun, et al
(TheThirdPeople’sHospitalofChengdu,Chengdu610031,Sichuan,China)
Objective: To discuss the applying of external drainage of pancreatic fluid and early enteral nutrition in pancreaticoduodenectomy. Methods: Clinical data of 58 patients underwent pancreaticoduodenectomy who accepted external drainage of pancreatic fluid and early enteral nutrition in our hospital from January 2011 to December 2015 were retrospectively analyzed. The postoperative complications and flatus time were observed. Results: Two cases died after operation with the mortality of 3.4%. The overall incidence of postoperative complications was 53.4%, among which , one case accepted transcatheter arterial embolization due to intra-abdominal hemorrhage. The mean flatus time was 4.5±0.9 days (ranged from 3 to 7 days). There was no significant difference of the serum albumin level at the 7th days after operation comparing with that before surgery (P>0.05). Conclusion: Applying of external drainage of pancreatic fluid and early enteral nutrition can reduce the incidence of postoperative complications, as well as promote the recovery of gastrointestinal function and improve the nutritional status of patients.
Pancreaticoduodenectomy; External Drainage of Pancreatic Fluid; Early Enteral Nutrition; Pancreatic Fistula
2015- 10- 27
2016- 05- 10
郑振江(1982-),男,四川成都人,博士,主治医师,主要从事胰腺疾病基础与临床研究工作。
R735.9; R730.56
A
10.3969/j.issn.1674- 0904.2016.03.006

