艾纳香油对晒伤小鼠皮肤氧化应激及DNA损伤的影响
李小婷 王丹 庞玉新 杨全 范佐旺 马青松 许罗凤
摘 要 观察艾纳香油对UVB照射后Blab/C小鼠晒伤皮肤氧化应激及DNA损伤的影响。通过建立4组小鼠晒伤模型,在5个不同时间相点测定小鼠皮肤晒伤组织厚度和含水量,利用可见光分光光度法测各组皮肤组织中超氧化物岐化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)和8-羟基脱氧鸟苷(8-OHdG)的含量。结果表明:艾纳香油可明显加快晒伤创面处结痂脱落,抑制晒伤皮肤组织增厚(P<0.05),减少晒伤组织皮肤含水量的丧失(P<0.05,P<0.01);在整个治疗过程,能明显提高小鼠血清SOD活性(P<0.05,P<0.01),降低皮肤MDA含量(P<0.05),升高皮肤GSH的水平(P<0.05),降低皮肤8-OHdG含量(P<0.01)。艾纳香油可抵抗UVB晒伤后小鼠表皮增厚,减少光产物表达,并通过清除氧自由基,提高抗氧化酶活性而发挥抗氧化作用。
关键词 艾纳香油 ;中波紫外线 ;抗氧化
分类号 R284.1 ;S567.23+9 Doi:10.12008/j.issn.1009-2196.2016.02.012
Effects of Blumea Balsamifera Oil on Oxidative Stree
and DNA Damages in a Model of Skin Sunburn in Mice
LI Xiaoting1,2,3) WANG Dan2,3) PANG Yuxin22,3)
YANG Quan1) FAN Zuowang1,2,3) MA Qingsong1,2,3) XU Luofeng1,2,3)
(1 School of Traditional Chinese Medicine, Guangdong Pharmaceutical University,
Guangzhou, Guangdong 510006, China;
2 Tropical crops Genetic Resources Institute, CATAS, Danzhou, Hainan 571737, China;
3 Hainan Provincial Engineering Research Center for Blumea Balsamifera,
Danzhou, Hainan 571737, China)
Abstract To evaluate the protective effect of Blumea balsamifera oil on UVB irradiation-induced skin sunburn in Blab/C mice. The sunburn mouse models were established by UVB irradiation. The mice were randomly divided into four groups. The skin erythema and edema were assessed. The thickness of epidermis and the water content of tissues were determined and the levels of superoxide dismutase (SOD), malondialdehyde (MDA),glutathione (GSH), 8-Hydroxy-desoxyguanosine in its epidermis were measured with visible spectrophotometry methods at 5 different time points. Results: The skin loss of Blumea balsamifera oil group was accelerated. The topical application of Blumea balsamifera oil resulted in a significant decreasing in UVB-induced increases in skin thickness. Further more, Blumea balsamifera oil treatments also resulted in a significant increasing the level of SOD and GSH, decreasing the loss of skin water content and MDA, especially depressing in UVB mediated generation of 8-OHdG. We suggest that Blumea balsamifera oil could be developed as an agent for the management of condition selicited by UV exposure including skin sunburn.
Keywords Blumea balsamifera oil ; ultraviolet B irradiation ; antioxidant
医学研究表明,晒伤是由于皮肤接受了超过耐受量的UVB而引起的光毒反应[1]。晒伤发生机制之一是产生高度反应活性的活性氧族与各种细胞内结构相互作用而造成皮肤晒红和晒伤,引起DNA的直接改变和损伤,诱发炎症甚至是皮肤癌,严重影响人们的健康[2]。多项研究表明,UVB辐射引起皮肤细胞DNA损伤标志物主要为8-OHdG,这被认为是造成UVB损伤皮肤的重要介质之一[3]。艾纳香为菊科艾纳香属艾纳香[Blumea balsamifera(L.)DC.]的新鲜或干燥地上部分,具有清热解毒,消肿止痛,止痒等功效,而艾纳香油为艾纳香中挥发性成分的提取物是提取天然冰片的附属产品,含有L-龙脑、樟脑、α-蒎烯、芳樟醇、β-石竹烯等主要成分[5]。本研究以Balb/C小鼠为受试动物制备晒伤模型,探讨艾纳香油是否具有治疗皮肤晒伤的作用。
1 材料与方法
1.1 材料
1.1.1 动物
Balb/C小鼠(4~6周),80只,雌性,体重18~22 g,购自湖北省实验动物研究中心,生产许可证:SCXK(鄂)2015-0018。
1.1.2 药物与试剂
艾纳香油购自贵州省艾源生态药业开发有限公司(批号:20110116)。根据预实验结果,以85%乙醇稀释至浓度40%,备用;小鼠8-OHdG ELISA试剂盒购自北京鑫方程生物技术有限公司(批号:201505);SOD(批号:20150518)、GSH(批号:20150522)、MDA(批号:20150522)试剂盒均购自南京建成生物工程研究所,其他相关溶剂均为分析纯。
1.1.3 仪器与设备
UVB紫外线灯管(TL20W/12RS,荷兰PHILIPS公司);紫外线照度计(UV-340A,台湾Lutron Electronics公司);酶标仪(ELX800,美国BioTek公司);Sartorius CPA225D电子分析天平;紫外分光光度计(DU-800,美国Beckman Coulter公司)。
1.2 方法
1.2.1 动物模型的制备及处理
实验前2 d在小鼠背部脊柱两侧剪去体表长毛,面积约为3.0 cm ×3.0 cm,用8%硫化钠进行脱毛。将脱毛小鼠随机分为4组:空白对照组(NC)、UVB模型组(UVB)、溶剂组(VC,85%乙醇)、艾纳香油组(BB Oil,40%),每组20只[6]。除空白对照组外,对其余各组小鼠进行以下处理:开启UVB紫外线灯,预热15 min,固定光源距小鼠背部距离约为20 cm,照射时间为40 min,照射强度为0.25 mW/cm2,辐照量为600 mJ/cm2[7];照射期间停止给水给食,照射后0.5 h恢复。置室温(24 ±2)℃,湿度50%~60%,12 h白/黑环境下自由摄食、饮水。
照射后30 min起,开始于照射部位均匀涂抹药物0.25 mL/只,每天给药1次,连续11 d。分别在晒伤后5个时间相点l、2、4、7、11 d,每组每次处死4只小鼠,取小鼠背部皮肤和血液。皮肤组织经过漂洗、称重、匀浆、离心后留上清备用。全血室温静置20~30 min后,于4 500 r/min下离心5 min,取上清液得血清,置于-80 ℃冰箱保存,备用[8]。
1.2.2 小鼠晒伤创面结痂脱落时间观察
每天在每次给药前0.5 h观察小鼠背部的表皮变化,将结痂完全脱落的时间记为小鼠晒伤创面结痂脱落时间。
1.2.3 螺旋测微器检测小鼠背部皮肤厚度
用螺旋测微器测量小鼠背部皮肤厚度并记录数据,每只小鼠取剃毛区中心背部不同皮肤部位10处进行重复测量。
1.2.4 小鼠背部皮肤组织含水量测定
每只小鼠取相同部位的背部皮肤,约100 mg,滤纸吸干血液,电子天平称湿重,并记录。然后放于80℃烤箱烘烤24 h,取出称干重,干湿法计算组织含水量。计算公式如下:
组织含水量(%)= ×100%
1.2.5 小鼠血清中SOD与皮肤组织中MDA、GSH测定
用可见光分光光度法检测已制备的血清中SOD活性和皮肤组织上清液中MDA、GSH的含量,具体操作步骤按试剂盒说明书要求进行。
1.2.6 小鼠皮肤组织中8-OHdG测定
用酶标仪检测皮肤组织上清液中8-OHdG的含量,具体操作步骤按试剂盒说明书要求进行。
1.2.7 数据统计分析
采用SPSS 19.0统计软件,所有数据采用均数±标准差(x±s)表示,各组间采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 艾纳香油对晒伤创面结痂脱落时间的影响
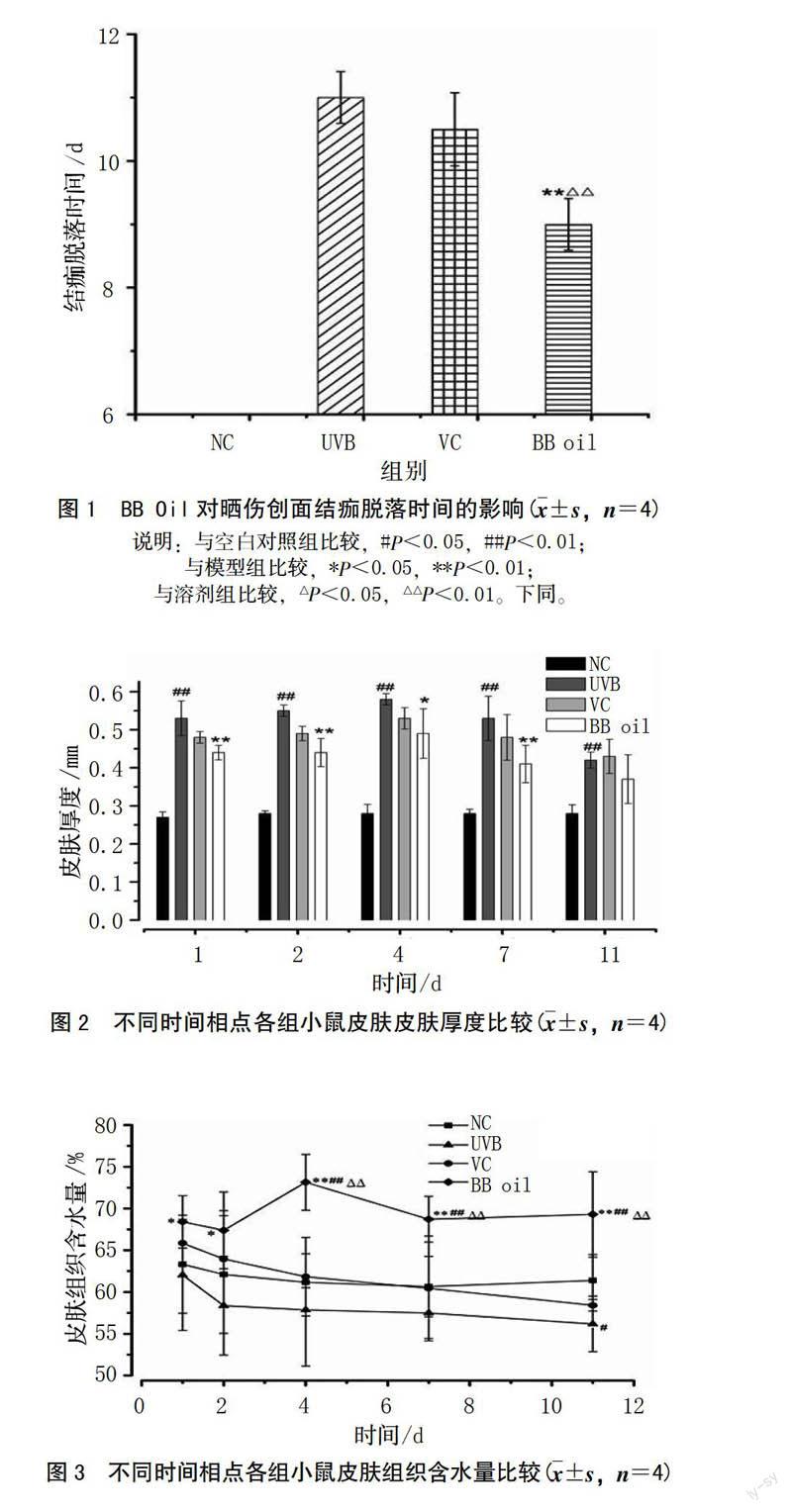
晒伤后前2 d,与空白组相比,模型组和溶剂组小鼠背侧出现表皮增厚、脱屑、皱缩现象;艾纳香油组小鼠背侧表皮仅有稍许皮肤增厚,无脱屑、皱缩。第3天起晒伤处渐渐形成结痂并从边沿开始脱落,艾纳香油组的脱落时间明显快于模型组、溶剂组,模型组完全脱落平均时间为11 d,溶剂组为10.5 d,艾纳香油组为9 d(图1)。
2.2 艾纳香油对晒伤皮肤厚度的影响
UVB晒伤后小鼠背部皮肤明显增厚为(0.53±0.046)mm,与空白对照组(0.27±0.014)mm相比差异有统计学意义(P<0.01);溶剂组皮肤厚度低于模型组,但高于艾纳香油组,与模型组、艾纳香油组比较差异无统计学意义(P>0.05);第1、2、4、7 天,艾纳香油组厚度与模型组相较差异具有显著性(P<0.01),提示艾纳香油可以抑制皮肤增生(图2)。
2.3 艾纳香油对晒伤组织皮肤含水量的影响
紫外线照射后第1 天各组皮肤含水量均较高,艾纳香油组>溶剂组>空白组>模型组,且艾纳香油组与模型组比较差异有显著性(P<0.05)。模型组和溶剂组皮肤含水量均随时间的后移而逐渐下降,在整个治疗过程中,艾纳香油组皮肤含水量最高,于第4天含水量达最高值(73.13±3.34)%,随后含水量逐渐下降稳定至(69.29±5.10)%,与空白组、模型组、溶剂组比较,差异均有统计学意义(P<0.05,P<0.01)(图3)。
2.4 艾纳香油对小鼠SOD活力、MDA含量、GSH含量的影响
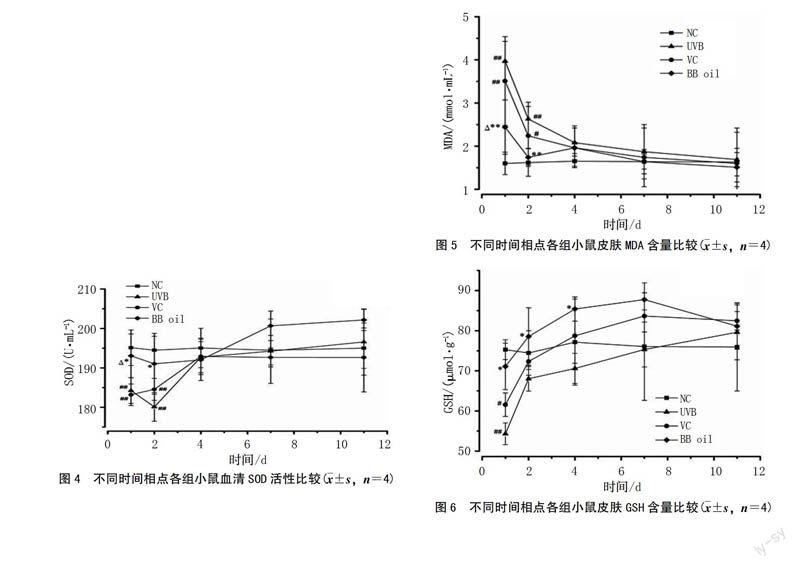
晒伤后第1、2、4 天,模型组、溶剂组、艾纳香油组SOD活性均低于空白组,第1、2天,模型组、溶剂组与空白组比较差异有统计学意义(P<0.01),且二者SOD活性相仿,两组比较差异无统计学意义(P>0.05)。外涂40%艾纳香油后,小鼠血清中SOD活力明显升高,第1 天与模型组、溶剂组相较,差异有统计学意义(P<0.05);第2天与模型组相较,差异仍有统计学意义(P<0.05);7 d后艾纳香油组SOD活性高于空白组,提示艾纳香油可增强机体清除氧自由基的能力(图4)。
晒伤后第1 天,模型组、溶剂组的MDA含量显著升高,与空白组比较差异均有统计学意义(P<0.01);艾纳香油组显著低于模型组(P<0.01)、溶剂组(P<0.05),高于空白组,但与空白组相较无统计学意义(P>0.05)。晒伤后第2 天,除空白组外,各处理组MDA含量均低于第1 天,但模型组、溶剂组与空白组比较差异仍均有统计学意义(P<0.01,P<0.05);艾纳香油组MDA含量仍低于模型组,且差异有统计学意义(P<0.01)。晒伤4 d后,随着机体调节和给予相应药物,各处理组小鼠皮肤组织中的MDA含量趋于稳定,并恢复到正常水平,表明艾纳香油在晒伤前期能够有效减少皮肤中脂质过氧化产物的堆积(图5)。
晒伤后第1、2 天,模型组、溶剂组GSH含量均低于空白组和艾纳香油组,第1 天,模型组、溶剂组与空白组比较差异有统计学意义(P<0.01,P<0.05),且两者SOD活性相仿,两组比较差异无统计学意义(P>0.05)。艾纳香油组皮肤中GSH含量明显升高,第1、2、4 天与模型组相较,差异均有统计学意义(P<0.05),提示艾纳香油可增强皮肤的抗氧化能力(图6)。
2.5 艾纳香油对小鼠皮肤8-OHdG的影响
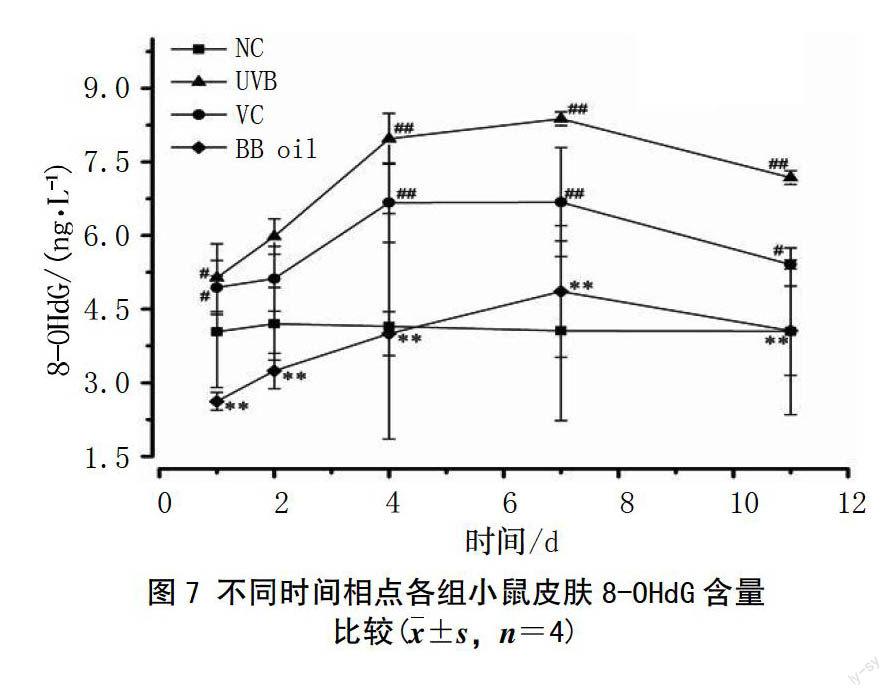
在整个晒伤治疗周期中,除空白组处于稳定值外,其他3组8-OHdG含量总体呈上升趋势。其中,在第1、4、7、11天,模型组、溶剂组8-OHdG含量均高于空白组,且差异存在统计学意义(P<0.05,P<0.01),而在第1、2、4、7、11天不同的5个时间点,艾纳香油组8-OHdG含量均显著低于模型组和溶剂组,差异存在统计学意义(P<0.05,P<0.01),艾纳香油组与空白组相较无显著性差异(P>0.05),提示艾纳香油可以促进UVB辐射光产物的清除(图7)。
3 结论与讨论
过度UV诱导的皮肤氧化损伤,可造成皮肤出现红斑、水肿、炎症、异常增生、色素沉着等皮肤晒伤表现,当前市场上缺乏治疗晒伤的专用药[2]。研究表明,艾纳香油具有抗氧化、抗菌[9]、治疗皮肤烧烫伤[4]的作用,而艾纳香油是否能抑制中波紫外线晒伤后诸多表现尚未被证实。本实验以Balb/C小鼠为对象,进行急性UVB辐射,造成小鼠皮肤晒伤表现,对艾纳香油的抗氧化药效进行检测,研究结果显示,艾纳香油可以加速晒伤创面结痂脱落,促进伤口愈合,明显减轻UVB引起的皮肤增厚。UVB晒伤有一定的促细胞肿胀作用,这也是UVB晒伤引起皮肤炎症产生的可能机制之一,艾纳香油处理后皮肤增厚程度明显减轻从而降低炎症发生。皮肤晒伤后将会出现发红、干燥、脱屑、含水量减少、弹性减少等现象,实验结果表明,艾纳香油在小鼠晒伤后期可升高皮肤的含水量,与模型相、溶剂组比较有统计学意义(P<0.01),表明艾纳香油对晒伤皮肤组织的恢复有良好的促进作用。
紫外线辐射会引起体内自由基激增,脂质过氧化作用增强,并因此形成脂质过氧化物MDA,故MDA的高低间接反应了机体细胞受自由基攻击的严重程度。SOD是体内清除氧自由基的重要酶,对活性氧异常敏感,易被活性氧氧化失活,破坏细胞的结构和功能。因而检测SOD活性对探讨皮肤晒伤的病因有重要作用。GSH是机体内最重要的非酶性抗氧化物,具有清除自由基、维持DNA的生物合成及细胞免疫等重要生理功能,GSH量的多少是衡量机体抗氧化能力大小的重要因素。8-OHdG是UVB损伤皮肤细胞DNA而产生的主要光产物之一,反映了整个机体平均的氧化损伤率及体内DNA氧化损伤与机体正常的修复作用。本研究中,经紫外线晒伤后小鼠SOD活性降低,MDA含量明显增加,GSH含量下降,与空白对照组各指标变化比较差异有显著性意义(P<0.05,P<0.01),外涂艾纳香油后,小鼠血清中SOD活力明显升高,皮肤中MDA含量显著降低,GSH含量显著升高,差异均有显著性意义(P<0.05,P<0.01),而且艾纳香油组8-OHdG含量均明显低于模型组和溶剂组(P<0.05,P<0.01),说明艾纳香油可增强皮肤对自由基的防护功能,减少脂质过氧化产物堆积,减轻UVB辐射造成的DNA损伤,具有较好的抗氧化能力,且起效周期短,给药前5 d较为明显。
本实验仅测定了40%艾纳香油对晒伤后小鼠皮肤的抗氧化作用以及对DNA损伤修复的作用,故下阶段试验中将再增加几个实验浓度,同时再设立使用不同浓度艾纳香油而不照射UVB组,以便排除“药物”本身对皮肤的影响,进一步对血清及皮肤组织中的炎症介质或细胞因子进行检测,探讨艾纳香油治疗晒伤的药理作用机制。
参考文献
[1] 蒋小云,肖风丽. 紫外线与皮肤癌[J]. 中国麻风皮肤病杂志,2013,29(1):28-30.
[2] 叶小红,宋洪涛. 中药治疗日晒伤的研究进展[J]. 解放军药学学报,2010,26(1):83-86.
[3] 郑 欣,吴 严,徐天华,等. 抗氧化剂复合物对急性紫外线照射所致皮肤日晒伤的保护作用[J]. 中国美容医学,2012,21(7):1 170-1 172.
[4] 范佐旺,王 丹,庞玉新,等. 艾纳香油对大鼠深Ⅱ度烫伤的治疗研究[J]. 中医药信息,2014,31(6):93-96.
[5] 吴丽芬,庞玉新,杨 全,等. GC法同时测定艾纳香油中5个主要成分的含量[J]. 药物分析杂志,2015,07:1 179-1 184.
[6] 骆 丹,周炳荣. 黄芩苷对中波紫外线诱导后BALB/c小鼠表皮光产物形成的干预作用[J]. 中华皮肤科杂志,2009,42(2):132-134.
[7] Lee C W, Ko H H, Lin C C, et al. Artocarpin attenuates ultraviolet B-induced skin damage in hairless mice by antioxidant and anti-inflammatory effect[J]. Food Chem Toxicol, 2013, 60:123-129.
[8] Silva M A, Trevisan G, Hoffmeister C, et al. Anti-inflammatory and antioxidant effects of Aloe saponaria Haw in a model of UVB-induced paw sunburn in rats[J]. J Photochem Photobio B,2014,133:47-54.
[9] 唐晖慧,金美东. 琼产艾纳香叶精油的抗氧化和抗菌活性[J]. 食品与发酵工业,2013,39(6):47-52.

