化学反应焓变测定实验装置改进与误差分析探讨
陈创前 杨水兰 于春侠


摘要:反应热效应的测量方法很多,大部分采用普通的保温杯和精密温度计作为简易量热计来测量,热量损耗相对较大;本实验通过对化学反应焓变测定实验装置改进,达到了减小误差的目的,在对实验数据处理过程中,对外推法求温度差的近似计算方法进行了探讨分析。
关键词:焓变;温度;误差
中图分类号:G642.3 文献标志码:A 文章编号:1674-9324(2016)29-0257-02
反应热效应的测量方法很多,大部分采用普通的保温杯和精密温度计作为简易量热计来测量,往往热量损耗相对较大,而且水银温度计和保温瓶易碎,存在安全隐患;为了提高实验效率,减小误差,有效降低安全事故的发生,本实验室研制了一种可视化新型装置,其可适用于大部分化学反应热的测定实验,该实验仪器装置结构设计独特,使用操作方便且造价便宜,能用于本专业和非专业基础化学实验教学,也可在科研实验中进行推广应用。外推法是根据过去和现在的发展趋势推断未来的一类方法的总称,用于科技、经济和社会发展的预测,是情报研究法体系的重要部分。通俗地说,它是一种很好的近似计算方法,对于已求得的低精度近似值,只要作几次最简单的四则运算,便立刻得到高精度的近似值。更简单地说,它是一种把低精度近似值加工到高精度的近似值的一种方法,简称精加工。根据多次实验数据处理结果,发现本实验使用的外推法存在很大不确定性,反而会误导学生对实验数据的不信任,从而偏离化学实验课真正的目的与意义。
一、化学反应焓变实验原理
化学反应过程中,除了发生物质的变化外,还有能量的变化,这种能量变化表现为反应热效应,而化学反应通常是在恒压的条件下进行的,此反应热效应叫做等压热效应。[1]化学反应的等压热效应Qp等于化学反应的摩尔反应焓变△rHm(放热反应为负值,吸热反应为正值)。在标准状态下化学反应的焓变称为化学反应的标准焓变,用△rHmθ表示。[2]反应热效应的测量方法很多,教学实验大部分采用普通的保温杯和精密温度计作为简易量热计来测量。假设反应物在量热计(图1)中进行的化学反应是在绝热条件下进行的,即反应体系(量热计)与环境不发生热量传递。这样,从反应体系前后的温度变化和量热器的热容及有关物质的质量和比热容等,就可以按(1)式计算出反应的热效应。实验是以锌粉和硫酸铜溶液发生置换反应,在298.15K和标准状态下,1mol锌置换硫酸铜溶液中的铜离子,放出218.7kJ的热量。
Zn(s)+Cu(aq)=Cu(s)+Zn(aq)
ΔH=-218.7kJ·mol
由溶液的比热和反应前后溶液的温度变化,可求得上述反应的焓变。计算公式如下:
ΔH(T)=-ΔT·c·V·ρ· (1)
式中:ΔH——反应的焓变(kJ·mol-1);
ΔT——反应前后溶液的温度变化(K);
c——溶液的热容(J·g-1·K-1)(取4.18);
V——溶液的体积(mL);
ρ——溶液的密度(g·mL-1)(近似以1.00计);
n——溶液中溶质的物质的量;
由于此系统非严格地绝热,在反应液温度升高的同时,量热计的温度也相应提高,而计算时又忽略此项内容,故会造成温差的偏差。在处理数据通常采用外推法,按图2中虚线外推至反应开始的时间图解求得反应系统的最大温升值T,这样可较客观地反映出由反应热效应引起的真实温度变化值。
二、测定装置的改进与实际效果
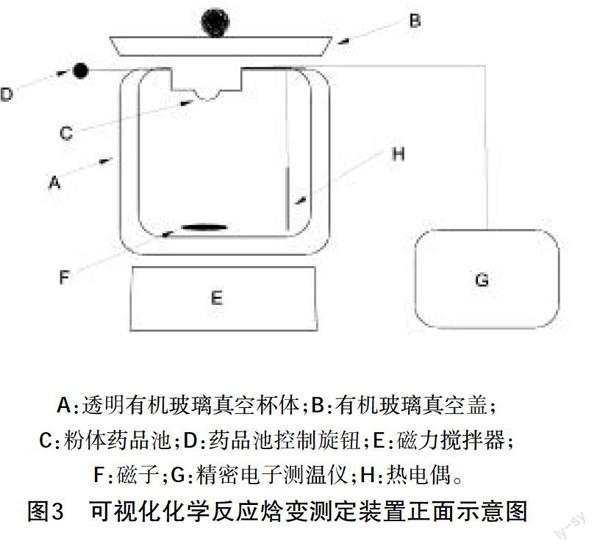
本研制装置采取的技术方案:如图3所示,A为透明有机玻璃真空杯体、B为有机玻璃盖、C为粉体(锌粉)药品池、D为药品池控制旋钮、E为磁力搅拌器、F为磁子、G为精密电子测温仪、H为热电偶。A的材质为双层中空透明有机玻璃500毫升抽真空圆柱形杯体(内腔:?覬80*100,外腔:?覬90*105),外侧留真空抽气孔(带气阀,接真空表可测真空度);B的材质为圆盘状(?覬90*10)双层中空透明有机玻璃,内部要求真空;B下面加装5毫米厚圆环状橡胶隔热密封圈,药品池架和热电偶导线直径均要求为2毫米并穿过密封圈,这样当B盖上以后再加500克圆环状配重以确保整个腔体为绝热体系;E和F可以辅助反应充分进行;G和H配合可以精确测量全程温度,配合秒表便可以轻松完成化学反应摩尔焓变的测定实验。
从反应体系前后的温度变化和量热器的热容及有关物质的质量和比热容等,就可以计算出反应的热效应。本研制装置的操作原理和步骤为:①先将A放在E上,将F放入A内,再往A内注入定量蓝色硫酸铜标准溶液;②加装密封圈、药品池和热电偶,确保热电偶插入液面以下,将定量锌粉装入C后轻轻盖上B,并加上配重;③接通电源,打开E让F匀速搅拌,再打开G待体系温度稳定后记录反应前温度;④调好秒表,慢慢转动D当锌粉匀速洒落的同时按下秒表,每隔30秒记录一次温度,注意观察反应液颜色,当蓝色完全消失后停止加锌粉,待温度不再上升后,再记录3分钟的数据;⑤数据记录完毕后,先关闭所有电子设备,然后拆装,回收锌粉和废液,清洗完A后倒置干燥,彻底清理实验台;⑥处理数据,完成实验报告。我们用新装置和旧装置分别测试了多组实验,结果表明溶液反应前温度为14.25℃,反应后最高温度保持在23.25~23.85℃之间,而旧装置反应后最高温度保持在21.75~23.15℃之间,对比发现新装置的热量损耗相对减少,操作过程的误差因素也相对减少。
三、数据处理中对外推法的探讨
实验的关键在于能否测得准确的温度值。为获得准确的温度变化ΔT,除精细观察反应时的温度变化外,还要对影响ΔT的因素进行校正。通常用的校正的方法是:在反应过程中,每隔30秒记录一次温度,然后以温度(T)对时间(t)做图,绘制T-t曲线,如图2所示。将曲线AB和CD线段分别延长,再做垂线EF,与曲线交与G点,且使CEG和BFG所围二块面积相等,此时E和F对应的T值之差即为校正后的温差ΔT。但是,学生在实际过程中,很难确定CD线段的斜率和准确位置,使CEG和BFG所围二块面积相等根本实现不了,大部分学生理解不了,通过C点随便做一条切线来求ΔT,甚至有的学生求出的ΔT比标准值还大许多。所以,笔者认为此外推校正方法针对化学反应焓变实验存在缺陷,可行性欠妥,其实我们在实验课前就应该让学生明白实验的系统误差是不可避免的,绝对严格绝热系统装置是不存在的,让学生明白实验过程误差因素有哪些,而且怎样减小误差,在实验过程中尽最大努力测到反应后的温度最大值,然后减去反应前的温度值,即可得到温差ΔT,在达到实验目的同时,也是学生感到自己实验数据确切真实。而且,我们通过改进实验装置后,热损耗的确减少了,进一步表明,不用外推法校正也可以使实验数据更加接近标准值。
参考文献:
[1]李聚源.化学反应摩尔焓变的测定实验的改进[J].化学世界,2003,(8):444-446.
[2]李侃社,刘向荣,贺诗华,梁耀东.[M].北京:化学工业出版社,2009.

