润燥灵对干燥综合征模型小鼠脾脏干预初探
曾苹 侯雷 和秀丽 王莹 马武开
【摘 要】目的:探讨润燥灵对干燥综合征模型小鼠脾脏的影响。方法:将90只C57bl/6j小鼠随机分为空白对照组,模型对照组,醋酸泼尼松组和润燥灵高、中、低剂量组,每组15只。空白对照组正常饲养,其余各组采用免疫诱导法建立干燥综合征模型小鼠,各治疗组予润燥灵高、中、低剂量中药及醋酸泼尼松灌胃治疗,用药4周后眼球取血,处死小鼠后无菌取出脾脏,HE染色,观察病理切片,并采用MTT法检测脾T淋巴细胞增殖转化能力。结果:脾脏病理切片观察显示,模型对照组脾脏较空白对照组脾脏结构广泛破坏,白髓广泛增生,红髓萎缩,脾血窦结构不清。润燥灵高剂量组及醋酸泼尼松组与空白对照组比较,未见明显病理改变。润燥灵中、低剂量组脾脏白髓呈不同程度增生,红髓呈不同程度萎缩。MTT法检测结果显示,模型对照组OD值明显高于空白对照组,2组比较,差异有统计学差异(P < 0.01);除润燥灵低剂量组外,其余3个治疗组均低于模型对照组,差异有统计学意义(P < 0.01)。结论:润燥灵能够抑制干燥综合征模型小鼠ConA诱导的脾T淋巴细胞的增殖,修复干燥综合征模型小鼠脾脏的免疫损害。
【关键词】 干燥综合征;润燥灵;T细胞;涎腺;动物模型;脾脏
doi:10.3969/j.issn.2095-4174.2016.03.002
Study on the Effect of Runzao Ling(润燥灵)on the Spleen of Mouse with Sj?gren's Syndrome
ZENG Ping,HOU Lei,HE Xiu-li,WANG Ying,MA Wu-kai
【ABSTRACT】Objective:To explore the effect of Runzao Ling(润燥灵)on the spleen of mouse with sj?gren's
syndrome.Methods:Ninety C57bl/6j mice were randomly divided into a blank control group,a model control group,a prednisone acetate group and the high,medium and low dose groups of Runzao Ling,15 mice in each group.The blank control group was fed normally.The rest groups were used to establish Sjogren's syndrome models by immune induction.All the treatment groups were given high,medium and low doses of Runzao Ling and prednisone by gavages.After
4 weeks of medication,blood of them was drawn from their eyeballs.Then killed the mice,took out their spleen sterilely and did HE staining to observe the pathological sections.MTT was used to detect proliferation transformation ability of the splenic T lymphocytes.Results:According to the spleen pathological sections,spleens of the model control group were more destroyed than those of the blank control group.Their white pulp had hyperplasia,red pulp had atrophy,and splenic sinusoid structure was not clear.The Runzao Ling high dose group and the prednisone group had no significant pathological changes compared with the blank control group.The white pulp of the spleens in the medium and Runzao Ling low dose groups had hyperplasia in different degrees,and their red pulp showed different degrees of atrophy.MTT assay showed that the OD value of the model control group was higher than that of the control group,with significant difference between them(P < 0.01).Except for the low dose group,the OD value of the other three treatment groups was lower than that in the model control group,and the difference was statistically significant(P < 0.01).
Conclusion:Runzao Ling can inhibit the proliferation of splenic T lymphocytes induced by ConA in the mice of sj?gren's syndrome and repair the immune damage of their spleens.
【Keywords】 sj?gren's syndrome;
Runzao Ling(润燥灵);T lymphocyte;salivary
gland;animal model;spleen
干燥综合征(sj?gren's syndrome,SS)是一种以侵犯涎腺、泪腺等外分泌腺为主,具有高度淋巴细胞浸润的自身免疫性疾病,可见于任何年龄,最常见于40~60岁的女性,其发病率在风湿免疫病中居第2位,仅次于类风湿关节炎[1]。本病病理为淋巴及浆细胞浸润,脾脏是机体最大的外周淋巴器官,当机体受到抗原刺激或机体免疫紊乱时,脾脏中T细胞便会克隆增殖。本病属中医学“燥证”“燥毒”“燥痹”等范畴。笔者认为,津亏、血瘀、燥毒是其发病特点,采用润燥解毒、养阴生津、化瘀通络的治疗方法,辨证与辨病相结合,组成润燥灵方,经临床验证取得良好治疗效果[2]。笔者建立SS模型小鼠,探讨润燥灵方对SS模型小鼠脾脏的修复作用及对脾脏中T细胞的干预作用。
1 实验材料
1.1 实验动物 选择C57bl/6j小鼠90只,SPF级,雌性,8周龄,体质量约20 g,购自重庆腾鑫生物技术有限公司,许可证号:SCXK(军)2012-0011。Lewis大鼠20只,SPF级,雌性,8周龄,体质量约150 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。
1.2 实验药物 润燥灵为本科室经验方,由肿节风10 g、姜黄10 g、白花蛇舌草10 g、生地黄15 g、玄参15 g、紫草10 g、当归10 g、赤芍15 g、金银花10 g等组成。生药购自本院药房。上药加水浸泡10 min,煎煮2次,每次30 min,合并滤液,浓缩成每毫升含生药5 g液体,4 ℃冰箱保存备用。醋酸泼尼松(浙江仙琚制药股份有限公司,生产批号140746)。
1.3 实验试剂 百白破疫苗(武汉生物制品股份有限公司,批号20140104-2)由贵州省湄潭县卫生防疫站提供;SIGMA弗氏完全佐剂(批号SLBJ2845V);考马斯亮兰试剂盒(南京建成生物工程研究所,批号20140710);MTT(索莱宝生物科技,批号20150119);红细胞裂解液(索莱宝生物科技,货号R1010);ConA(SIGMA,货号C-2010);异丙醇(富宇试剂,XK13-011-00015);质量分数为4%的多聚甲醛(索莱宝生物科技,货号P1110),PBS缓冲液(HYCLONE,SH30256)。
2 方 法
2.1 动物分组 将90只C57bl/6j小鼠随机分为空白对照组,模型对照组,醋酸泼尼松组和润燥灵高、中、低剂量组,每组15只。
2.2 动物模型的建立 参照Cutler方法加以改进[3],
在无菌条件下取Lewis大鼠颌下腺,电动匀浆,4 ℃,1000 g,15 min离心,保留上清;向沉淀中加入
2 mL PBS,再次匀浆、离心,将2次上清液混合,4 ℃,10 000 g,15 min离心,保留沉淀加入1 mL PBS,冰浴保存;取上清4 ℃,25 000 g,15 min离心,保留沉淀加入1 mL PBS,冰浴保存;取上清4 ℃,40 000 g,15 min离心,保留沉淀加入1 mL PBS,冰浴保存;取上清4 ℃,100 000 g,15 min离心,保留沉淀加入1 mL PBS,冰浴保存,弃上清;将4次沉淀混合,采用考马斯亮蓝比色法,测定抗原质量分数为
8.7 mg·mL-1,加入PBS缓冲液稀释抗原质量分数至2 mg·mL-1,再加入同体积弗氏完全佐剂,制备成最终抗原质量分数为1 mg·mL-1。除空白对照组外,其余模型对照组及用药组首次免疫,每只小鼠背部、腹部注射抗原,总量为每只0.2 mL;第
2天予背部、腹部注射百白破疫苗0.5 mL,此后每隔14 d再加强免疫1次,除空白对照组外,其余模型对照组及用药组再次加强免疫,每只小鼠背部、腹部注射抗原,总量为每只0.2 mL;第2天予背部、腹部注射百白破疫苗0.5 mL,产生类似于人SS的唾液腺改变及临床表现特点,连续免疫4周。
2.3 给药方法 建立动物模型,第5周开始灌胃给药。根据人与小鼠体表面积换算给药,润燥灵中剂量组为人的等效剂量(给药质量分数为2.5 g·mL-1),
润燥灵高剂量组为人等效量2倍量(给药质量分数为5 g·mL-1),润燥灵低剂量组为人等效量1/2量(给药质量分数为1.25 g·mL-1),醋酸泼尼松组为人的等效剂量(给药质量分数为0.5 mg·mL-1),
各组均每日灌服2 mL,连续灌胃给药4周。
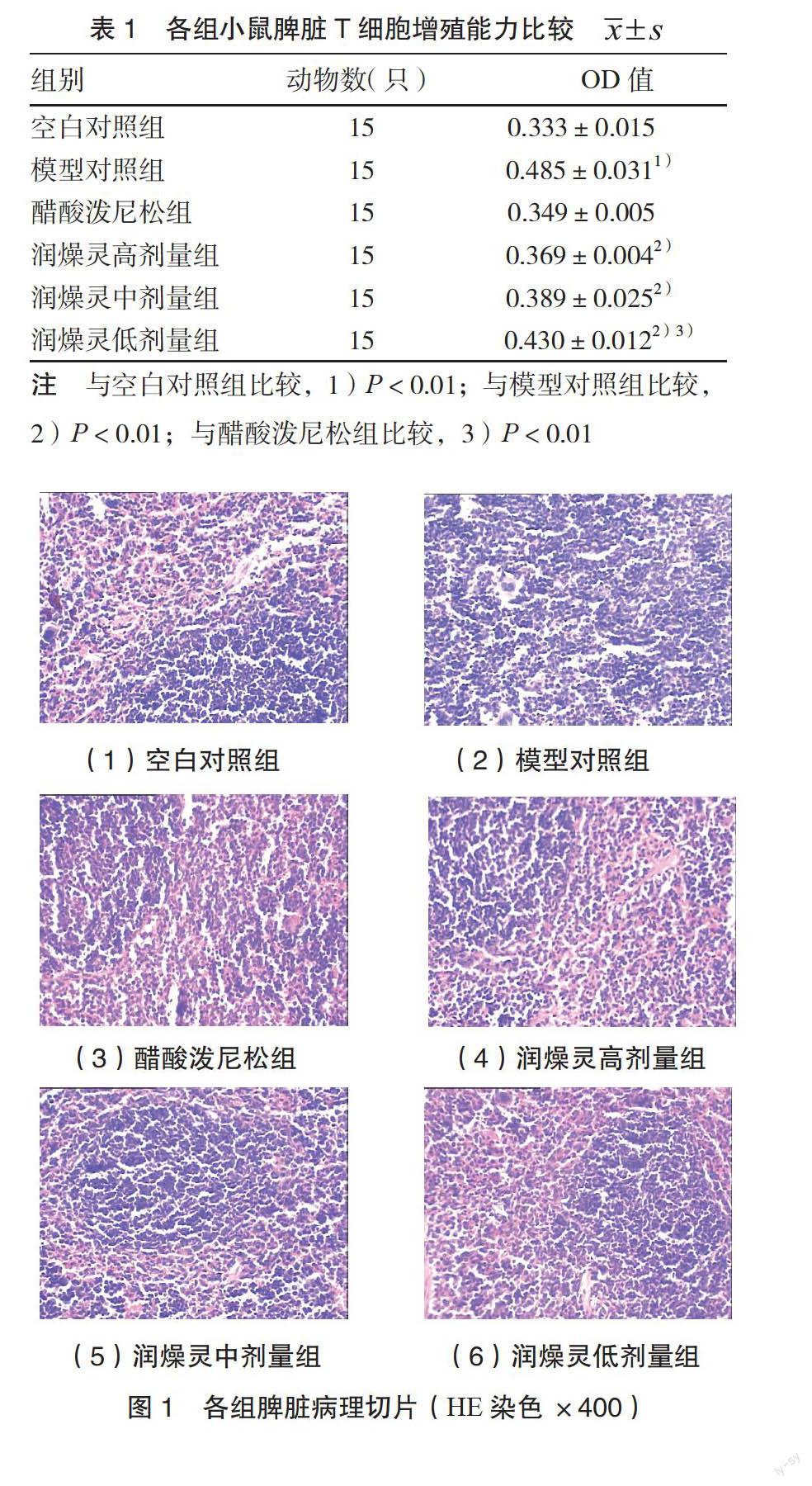
2.4 病理学检测 于第8周眼球取血,处死小鼠,立即取出小鼠脾脏。用质量分数为4%的多聚甲醛固定,石蜡包埋,切片,HE染色,由专业病理人员在光学显微镜下阅片。
2.5 小鼠脾脏T细胞增殖检测 无菌取脾,分离成单个细胞,调脾淋巴细胞质量分数为5×106·mL-1,
加入96孔板中,每孔100 μL。用含ConA刺激物的1640完全培养液补足至每孔200 μL,最终质量分数为5 μg·mL-1,每组设3个平行孔。将培养板放入37 ℃、体积分数为5%的CO2培养箱中,培养72 h,培养结束前4 h每孔加入MTT溶液20 μL继续培养。培养结束后培养板3000 r·min-1,离心5 min,弃去上清,用滤纸吸去水分后,每孔加入酸化异丙醇100·L-1,静置15 min,轻轻混匀后,492 nm波长测OD值。
2.6 统计学方法 采用SPSS 19.0软件进行统计分析。计量资料以表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
3 结 果
3.1 脾脏病理切片 空白对照组小鼠脾脏脾血窦分布于脾小体之间,未见扩散。红、白髓分布整齐,排列均匀。模型对照组与空白对照组比较,脾脏结构广泛破坏,白髓区脾小体广泛增生,期间见大量淋巴细胞及单核、多核巨噬细胞增生。红髓萎缩,脾血窦结构不清。润燥灵高剂量组及醋酸泼尼松组较正常组比较未见明显病理改变。润燥灵中剂量组脾脏结构不规则,白髓区轻度增生。润燥灵低剂量组脾脏结构破坏,白髓增生明显,淋巴细胞、单核、多核巨噬细胞散在分布于红髓之间。见图1。
3.2 各组小鼠脾脏T细胞增殖转化能力比较 MTT法检测结果显示,模型对照组OD值明显高于空白对照组,2组比较,差异有统计学意义
(P < 0.01);各用药组治疗后T细胞增殖有不同程度下降,除润燥灵低剂量组外,其余3组与模型对照组比较,差异均有统计学意义(P < 0.01);润燥灵高、中剂量组T细胞的增殖与醋酸泼尼松组比较,差异无统计学意义(P > 0.05)。见表1。
4 讨 论
SS是一种以侵犯外分泌腺为主的慢性、炎症性自身免疫病。临床上除口眼干涩等主要症状外,还会出现受累腺体T淋巴细胞浸润、外周血中免疫球蛋白含量增多和高水平的自身抗体等免疫系统紊乱的表现。脾是机体最大的外周淋巴器官,其中含有大量的T细胞和B细胞,当这些免疫细胞被抗原刺激后,引起T细胞和B细胞增殖。SS属中医学“燥证”“燥痹”“燥毒”等范畴[4]。中医药较西药治疗SS具有明显优势。根据SS的发病特点,本课题组将SS的主要病因病机归为阴虚、瘀血及燥毒相互搏结[5-6],而致五脏六腑失其所养,五官九窍失其滋润。润燥灵方对改善SS症状有较好疗效[2]。朱跃兰[7]也认为,SS的病机在于燥、毒、瘀三者间的相互作用,并指出治疗当以润燥、解毒、活血为原则。刘维[8]指出,治疗SS应以清热解毒、润燥护阴为原则。润燥灵方中肿节风、玄参、白花蛇舌草清热解毒,当归润燥活血,姜黄、紫草、赤芍化瘀通络,生地黄养阴生津。
本研究结果显示,模型对照组与空白对照组小鼠比较,脾脏病理改变明显。润燥灵高剂量组、醋酸泼尼松组与空白对照组脾脏比较,未见明显病理改变。润燥灵中、低剂量组脾脏均有较明显病理改变,且润燥灵中剂量组脾脏的病理改变较润燥灵低剂量组轻。说明润燥灵浓度越高对小鼠脾脏的修复效果越好,并且润燥灵高剂量对修复小鼠脾脏的作用同醋酸泼尼松相当。
SS模型小鼠脾脏中T细胞的增殖能力经MTT法检测显示,模型对照组SS小鼠脾脏中T细胞的增殖明显高于空白对照组(P < 0.01);加用润燥灵治疗后,高、中、低剂量组均有较明显改善,各用药组治疗后小鼠脾脏中T细胞的增殖均明显小于模型对照组(P < 0.01),说明醋酸泼尼松与润燥灵均可以抑制SS模型大鼠体内亢进的细胞免疫反应。但润燥灵高、中、低剂量组对SS小鼠脾脏T细胞的增殖抑制作用不及醋酸泼尼松对照组(P < 0.01),说明润燥灵对抑制SS模型大鼠体内细胞免疫反应的能力不及醋酸泼
尼松。
在以前的研究中,笔者对润燥灵治疗SS的作用机制进行了探讨,其能够通过调节SS模型小鼠水分子通道蛋白5,改善模型小鼠的唾液量[9-10]。本次研究观察了润燥灵对SS模型小鼠的治疗作用,并对其免疫机制做了初步探讨,为后续进一步探讨润燥灵对于T细胞的调节作用打下基础。
5 参考文献
[1] 蒋明,张奉春.风湿病诊断与诊断评析[J].上海:上海科学技术出版社,2004:143-154.
[2] 侯雷,马武开.马武开教授治疗干燥综合征经验[J].风湿病与关节炎,2013,2(6):57-58.
[3] Cutler LS,Creiner DL,Rozenski D.Experimental autoallergic sialadenitis in the LEW rat.Ⅱ.Target antigen are associated with cell surface and intracellular particulate fractions derived from the submandibular gland[J].Cell Immunol,1991,135(2):346-353.
[4] 马武开,王莹,唐芳,等.燥痹琐议[J].新中医,2012,44(6):191-192.
[5] 和秀丽,侯雷,曾苹,等.马武开教授从毒蕴血瘀论治干燥综合征经验拾萃[J].风湿病与关节炎,2015,4(11):38-39,65.
[6] 马武开.论干燥综合征久必燥胜成毒[J].江苏中医药,2010,42(10):6-7.
[7] 靖卫霞,朱跃兰,周光春.朱跃兰教授运用活血解毒方治疗干燥综合征经验[J].风湿病与关节炎,2012,1(6):63-66.
[8] 丁园园,刘维.刘维教授治疗燥痹经验:清热解毒、润燥护阴治疗干燥综合征1例[J].现代中医药,2012,32(2):1-2.
[9] 马武开,贾二涛,刘丽敏,等.润燥灵对干燥综合征模型小鼠涎腺干预作用初步研究[J].时珍国医国药,2011,22(5):1239-1240.
[10] 马武开,贾二涛,刘丽敏,等.干燥综合征模型小鼠涎腺AQP1、AQP5基因表达及解毒化瘀中药治疗作用研究[J].新中医,2011,43(10):111-113.
收稿日期:2015-09-03;修回日期:2015-12-07