我国甘蔗锈病病原菌及甘蔗品系抗褐锈病基因Bru1的分子检测
傅华英 肖胜华 刘营航 孙生仁 吴小斌 陈如凯 高三基

摘 要 为了解我国甘蔗锈病病原菌发生以及优良甘蔗新品种(系)抗褐锈病基因Bru1的分布频率情况,以来自我国5省(区)81份疑似甘蔗锈病叶片样品为材料,分别用Pm1-F/Pm1-R和Pk1-F/Pk1-R引物对进行褐锈病菌(Puccinia melanocephala)与黄锈病菌(Puccinia kuehnii)分子鉴定。结果表明,锈病病原菌检出率为40.7%,除了福建省福州市叶片样品仅检测到P. melanocephala外,其他省(区)的叶片样品均检测到2种锈病病原菌,且存在混合侵染现象。对24份黄锈病菌阳性PCR产物(527 bp)克隆并测序,结果发现P. kuehnii间隔区1(ITS1)第183个核苷酸存在单核苷酸多态性(SNP),其中,A碱基(183A)、G碱基(183G)位点的病菌分离物分别占29.2%和25.0%,2种碱基(183A/G)位点的混合病菌分离物有45.8%。通过R12H16与9020-F4/RsaI两种分子标记对40份甘蔗新品种(系)抗褐锈病基因Bru1进行分子检测,结果表明,42.5%参试新品种(系)含抗褐锈病基因Bru1,这些材料可作为甘蔗抗褐锈病新品种加以推广应用。
关键词 甘蔗锈病;病原菌;新品种(系);抗褐锈病基因Bru1;分子检测
中图分类号 S435.661 文献标识码 A
Abstract The aim of this study was to investigate the incidence of causal pathogens causing sugarcane rust and frequency of Bru1 gene in new elite sugarcane clones. Two sets of primers of Pm1-F/Pm1-R and Pk1-F/Pk1-R were used for the identification of Puccinia melanocephala and Puccinia kuehnii respectively, causing the sugarcane rust in 81 leaf samples collected from five provinces in China. PCR assay revealed 40.7% of samples were verified to infect with P. melanocephala or/and P. kuehnii. Co-infection with two causal fungi was observed in leaf samples from most of provinces except for Fuzhou, Fujian. Subsequently, PCR products from 24 leaf samples infected with P. kuehnii were cloned and then sequenced to analyze the SNP(Single Nucleotide Polymorphism)in P. kuehnii ITS1 183A/G locus. Results showed that allele 183A and 183G were observed in 29.2% and 25.0% causal isolates, respectively, whereas 183A/G was detected in 45.8% causal isolates. Two marker-assisted R12H16 and 9020-F4/RsaI were used for screening of Bru1 resistance gene for brown rust in 40 new elite sugarcane clones. Bru1 frequency was 42.5% in the tested clones, of which would be applied in the effective and durable resistance in sugarcane against the P. kuehnii.
Key words Sugarcane rust; Pathogenic bacteria; New varieties(or lines); Bru1(brown rust resistance genes); Molecular detection
doi 10.3969/j.issn.1000-2561.2016.05.017
甘蔗锈病是一种重要的世界流行的甘蔗真菌性病害,分为褐锈病(Brown rust)和黄锈病(Orange rust)2种类型,其病原菌分别为担子菌纲柄锈科(Pucciniaceae)柄锈菌属(Puccinia)的黑顶柄锈菌Puccinia melanocephala H. & P. Syd. 和屈恩柄锈菌Puccinia kuehnii Butler[1]。甘蔗褐锈病分布广泛、为害较大,在多数种植甘蔗的国家或地区均有发生,可以引起感病品种产量损失10%~40%;甘蔗黄锈病主要分布于亚洲和澳大利亚,近年来已扩散到美国的弗罗里达州以及墨西哥、巴西等西半球国家或地区,在非洲国家目前还未有黄锈病发生的报道[1-2]。
甘蔗褐锈病与黄锈病可以通过田间甘蔗感病症状及夏孢子的颜色和形态加以区别。然而,夏孢子形态特征上的差异细微,且仅当孢子堆完全成熟时才可通过高倍显微镜鉴别,受到繁殖季节、病原保存、仪器设备等诸多因素的限制。利用分子生物检测手段来区别这2种病原菌已有报道。Glynn等[2]针对P. melanocephala和P. kuehnii这2种病原菌分别设计了特异性常规PCR和实时荧光PCR引物及探针;此外,利用PIRA-PCR(Primer-introduced restriction analysis PCR)技术检测分析P. kuehnii病菌,发现PkPmF/PkPmR引物扩增的PCR产物(606 bp)第183个核苷酸存在SNP(Single Nucleotide Polymorphism)位点,为A或G碱基[2]。
甘蔗锈病的流行与品种抗病性密切相关,抗性品种的选育和推广已成为控制褐锈病爆发流行最经济有效的措施[3]。因此,对已有的优良甘蔗新品种(系)进行抗褐锈病筛选成为选育高抗甘蔗品种的关键。然而,抗甘蔗褐锈病品种的筛选与鉴定主要使用人工接种表型观察选择,该传统方法低效、费时,且由于环境条件、病原活力以及接种压力的影响,鉴定结果容易出现误差[4]。为此,国内外甘蔗分子遗传学家试图寻找与抗锈病相关的分子标记。Daugrois等[5]发现了抗褐锈病主效基因Bru1;Costet等[6]研发出9020-F4/RsaI和R12H16 两个针对抗褐锈病基因Bru1的PCR分子标记,之后,许多国内外研究结果证实抗褐锈病基因Bru1与甘蔗抗P. melanocephala能力紧密相关[7-8]。早有报道,我国甘蔗锈病致病菌有P. melanocephala和P. kuehnii[9]。本研究拟了解这2种病原菌在我国主要蔗区的发生情况以及优良甘蔗新品种(系)抗褐锈病基因Bru1的分布状况,为及时有效开展甘蔗锈病病原检测和优良甘蔗新品种(系)的筛选提供参考依据。
1 材料与方法
1.1 材料
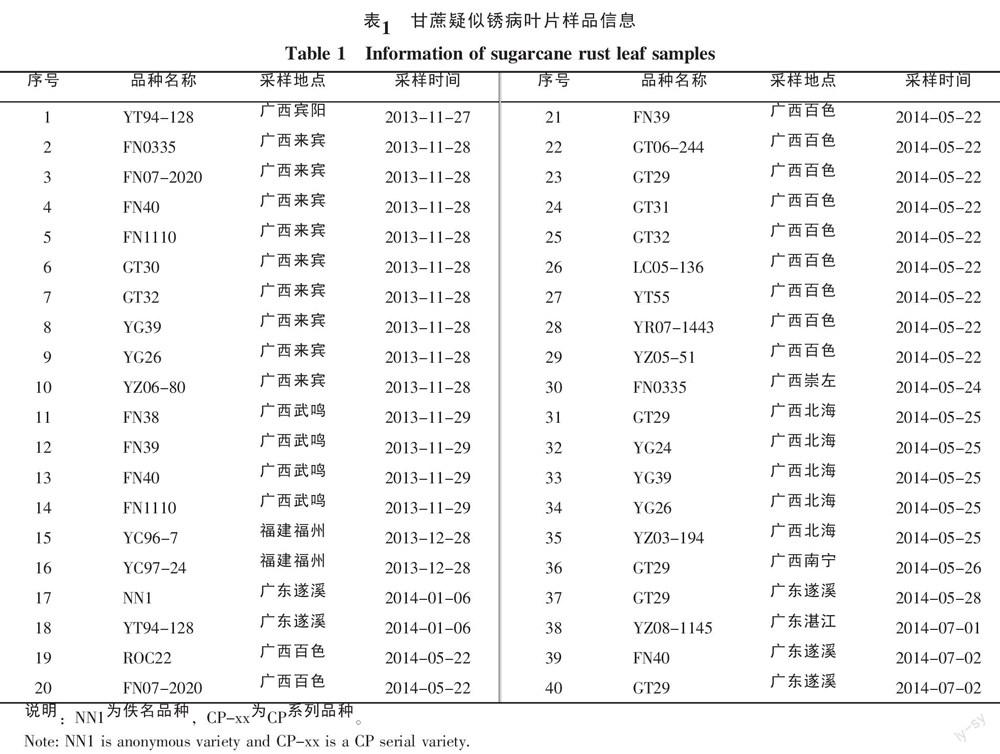
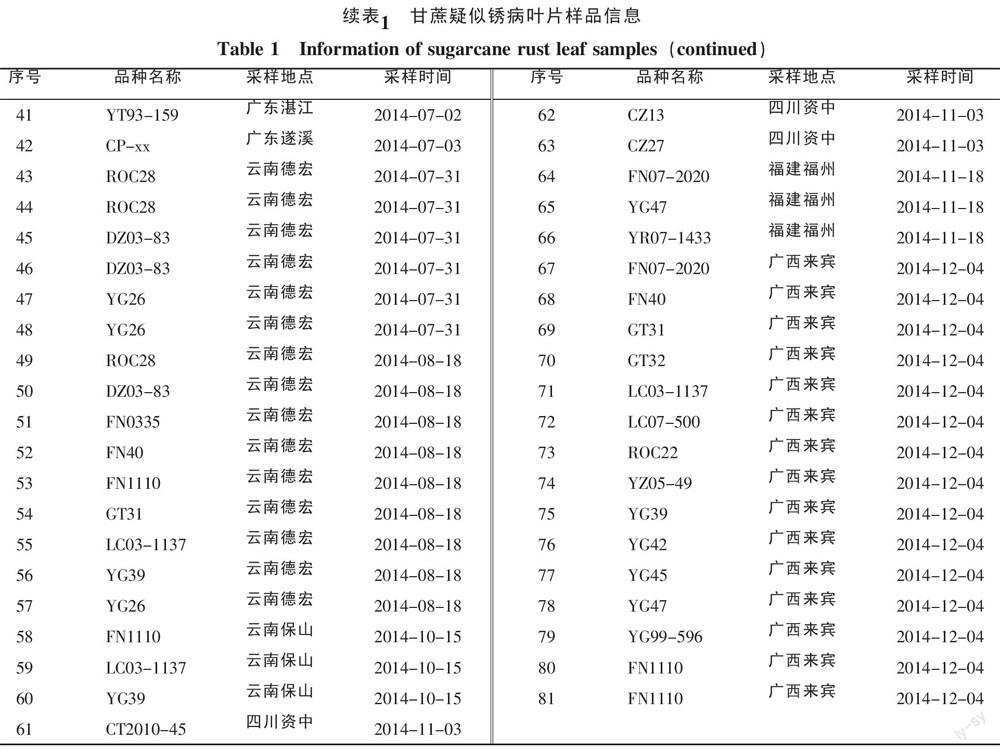
2013~2014年,从云南、广东、广西、四川、福建等省(区)的40个甘蔗新品种(系)采集的疑似甘蔗锈病症状叶片样品81份(表1),-80 ℃冰箱保存备用。
dNTPs、Ex Taq酶、限制性内切酶RsaI、pMD19-T载体购自TaKaRa(上海)公司;DNA Marker、大肠杆菌宿主菌DH5α感受态细胞、琼脂糖凝胶DNA回收试剂盒购自北京天根生化科技有限公司。
1.2 方法
1.2.1 引物合成 用于检测褐锈病引物Pm1-F/Pm1-R和检测黄锈病引物Pk1-F/Pk1-R的序列参照文献[2],甘蔗抗褐锈病基因Bru1的两种分子标记R12H16和9020-F4引物序列参照文献[6](表2)。引物合成由生工生物工程(上海)股份有限公司完成。
1.2.2 DNA提取及锈病PCR检测 甘蔗叶片总DNA提取参考CTAB法完成。DNA的质量和数量分析分别通过琼脂糖凝胶电泳检测和Naro Drop微量核酸测定仪完成,所有DNA保存于-20 ℃备用。PCR反应体系及反应条件参照文献[2]。总体积均为25 μL,包括1.0 μL DNA(约100 ng)为模板,1.0 U Ex Taq DNA聚合酶,2.5 μL 10×Ex Taq buffer,0.25 μmol/L上下游引物Pm1-F/Pm1-R或Pk1-F/Pk1-R和0.2 mmol/L dNTPs。反应条件为94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃延伸7 min。
1.2.3 甘蔗抗褐锈病基因Bru1的分子检测 甘蔗抗褐锈病基因Bru1分子标记R12H16和9020-F4的PCR反应体系及反应条件参照文献[6]。总体积均为25 μL,包括1.0 μL DNA(约100 ng)为模板,1.0 U Ex Taq DNA聚合酶,2.5 μL 10×Ex Taq buffer,0.25 μmol/L上下游引物R12H16-F/R12H16-R或9020-F4-F/ 9020-F4-R和0.2 mmol/L dNTPs。PCR扩增程序为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃延伸5 min。
R12H16分子标记PCR扩增产物直接用1.5%琼脂糖凝胶电泳检测;9020-F4/RasI分子标记PCR扩增产物通过限制性内切酶RsaI 酶切检测,并根据限制性内切酶多态性判别。酶切体系总体积25 μL,含有纯化后的PCR产物15.0 μL、10×NEB 缓冲液2.5 μL、RsaI酶(10 000 U)1.0 μL、无菌水 6.5 μL,酶切反应程序为37 ℃ 2 h,然后65 ℃ 10 min。取酶切产物10 μL,用3%低熔点琼脂糖凝胶电泳检测。
1.2.4 PCR产物纯化和克隆 PCR反应结束后取5 μL反应产物用1%琼脂糖凝胶电泳进行检测。PCR产物经纯化后克隆至pMD19-T载体,并转化至DH5α感受态细胞中,取100 μL涂于含50 μg/mL氨苄青霉素的LB固体培养基平板上,37 ℃暗培养16~18 h,挑取若干个单菌落分别接种到含氨苄青霉素的LB液体培养基中,37 ℃振荡培养4 h,经菌液PCR筛选得到阳性克隆,随机挑选3个阳性克隆子送生工生物工程(上海)股份有限公司进行测序。
1.2.5 序列分析 PCR产物目的片段克隆和测序后,序列提交GenBank数据库在线blast分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),验证序列是否正确。
2 结果与分析
2.1 甘蔗锈病病原菌PCR鉴定
在我国主要蔗区采集的81份甘蔗叶片样品中共检测得到33份阳性样品,锈病病原菌的阳性检出率为40.7%。其中17份样品PCR扩增出现P. melanocephala目的片段,大小约480 bp,24份样品PCR扩增出现P. kuehnii目的片段,大小约527 bp,8份样品PCR扩增同时出现P. melanocephala和P. kuehnii目的片段(图1)。所有阳性样品目的片段序列提交GenBank数据库在线Blast分析,证实为褐锈或黄锈病菌ITS序列,包括ITS1区(位于18S与5.8S rDNA之间)、ITS2区(位于5.8S与28S rDNA之间)的一部分序列和5.8S rDNA的全部序列。
2.2 甘蔗锈病病菌分布
根据甘蔗锈病样品的地理来源,对我国主要蔗区锈病病原菌检出率和地理分布进行统计(表3),结果显示,除了福建省福州甘蔗样品仅检测到褐锈病病菌外,其他省(区)广东、广西、云南、四川甘蔗样品均检测到2种锈病病原菌,其中广东、广西、四川样品存在混合侵染现象。在33份阳性样品中,P. melanocephala和P. Kuehnii单独侵染样品检出率分别为11.1%和19.8%,2种病原菌混合侵染样品检出率为9.8%。
2.3 甘蔗黄锈病菌的SNP多态性
已有报道PkPmF/PkPmR引物扩增的PCR产物(606 bp)第183个核苷酸存在SNP位点,为A或G碱基[2]。为此,对本实验检测为阳性的24份黄锈病样品的PCR产物进行克隆并测序。序列分析发现24份样品PCR产物中第183个核苷酸为A碱基(183A)有29.2%,为G碱基(183G)有25.0%,而存在2种碱基(183A/G)有45.8%(图2)。同一PCR产物同时存在183A或183G,可能由于2种类型的P. kuehnii病菌分离物同时侵染同一甘蔗品种(系)所致。
2.4 优良甘蔗新品种(系)抗褐锈病基因Bru1的分子检测
以我国各育种单位选育的40份甘蔗品种(系)的DNA为模板,抗褐锈病基因Bru1分子标记R12H16-F/R12H16-R特异性引物检测结果表明,有17个甘蔗品种(系)含有该基因(图3-A),阳性检出率为42.5%;以另一对分子标记特异性引物9020-F4-F/9020-F4-R进行PCR检测,结合RsaI限制性内切酶多态性分析,含有该基因的甘蔗品种(系)阳性样品含有一条200 bp大小的特异性条带(图3-B),其检出率与R12H16-F/R12H16-R分子标记检测结果一致。
3 讨论
我国蔗区锈病的发生以褐锈病为主,黄锈病是在上世纪80年代底在福建等蔗区发现[9]。在云南西南湿热蔗区发现蔗茅柄锈菌(Puccinia erianthi Padw et Khan)引起了锈病[10-11],但后来国外学者认为蔗茅柄锈菌与黑顶柄锈菌属于引起甘蔗褐锈病的同种病原菌[12-13]。本研究从我国5个省(区)蔗区采集了81份疑似锈病的甘蔗叶片样品,检测结果发现除了福建福州叶片样品没有检测到黄锈病菌,其他省份蔗区叶片样品均检测到黄锈病菌和褐锈病菌,且存在混合侵染现象。福州蔗区没有检测到黄锈病菌,可能由于采集样品太少所致。
为了进一步分析P. kuehnii病菌是否存在SNP位点,在Pk1-F/Pk1-R引物检测P. kuehnii为阳性的24份叶片样品中,从它们的PCR产物克隆和测序分析得知目的片段第183个核苷酸存在SNP,183A、183G位点出现频率分别为29.2%、25.0%,而同时存在2种类型183A/G的频率为45.8%。同一叶片样品存在2种类型P. kuehnii病菌分离物混合侵染,已排除因为PCR扩增、测序引起的误差。Glynn等[2]利用PIRA-PCR方法检测来自各国甘蔗锈病叶片样品P. kuehnii病菌SNP,结果发现来自中国、澳大利亚的样品P. kuehnii病菌存在183A或183G位点,而来自加勒比海盆地国家的样品发现只有183A位点。同时,Glynn等[2]也对PkPmF/PkPmR引物扩增的PCR产物直接测序,发现183A/183G等位位点频率与PIRA-PCR方法检测结果略有差异,这可能由于P. kuehnii病菌分离物183A/183G附近存在额外的差异碱基,导致PIRA-PCR方法无法检测到这2种等位位点。
选育和推广抗病品种是病害防治的最经济、最有效的方法。甘蔗为异源多倍体无性繁殖作物,基因型受环境条件影响较大,育种年限较长,选育出1个优良品种至少需要8~10年。随着分子标记技术的发展,利用与抗病基因紧密连锁的分子标记可以作为甘蔗抗病分子育种重要的辅助手段。Daugrois[5]和Asnaghi[14]等分别在栽培品种R570上发现和定位甘蔗抗褐锈病主效基因Bru1,随后,Costet等[6]开发出2种与该基因密切相关的R12H16和9020-F4/RsaI分子标记,研究发现在来自全球各蔗区的194份抗褐锈病材料中,有86%存在抗褐锈病基因Bru1,而感病材料均不含该基因。之后,许多学者将这2个分子标记应用于甘蔗品种及种质资源[15]、杂交亲本及其后代[4,7]、野生种质资源[8]抗褐锈病材料的发掘、筛选和评价,认为这些含有抗褐锈病基因Bru1的材料是选育抗褐锈病甘蔗品种很有利用前景的抗源种质。本研究也利用R12H16和9020-F4/RsaI分子标记对40个供试品种(系)开展了抗褐锈病筛选,发现42.5%的品种(系)含有抗褐锈病基因Bru1,有意思的是,本实验中含有抗褐锈病基因Bru1的品种(系)均未检测到P. melanocephala,然而这些供试材料的抗病性等级需要进一步通过孢子悬浮液人工接种验证。
参考文献
[1] Ryan C C, Egan B T. Rust. // Ricaud C, Egan B T, Gillaspie Jr A G, et al, eds. Diseases of Sugarcane: Major Diseases[M]. Amsterdam, the Netherlands: Elsevier, 1989: 189-210.
[2] Glynn N C, Dixon L J, Castlebury L A, et al. PCR assays for the sugarcane rust pathogens Puccinia kuehnii and P. melanocephala and detection of a SNP associated with geographical distribution in P. kuehnii[J]. Plant Pathology, 2010, 59(4): 703-711.
[3] Raid R N, Comstock J C. Common rust. // Rott P, Bailey R A, Comstock J C, et al, eds. A Guide to Sugarcane Diseases[M], Montpellier, CIRAD and ISSCT, 2000: 85-89.
[4] Parco A S, Avellaneda M C, Hale A H, et al. Frequency and distribution of the brown rust resistance gene Bru1 and implications for the Louisiana sugarcane breeding programme[J]. Plant Breeding, 2014, 133(5): 654-659.
[5] Daugrois J H, Grivet L, Roques D, et al. A putative major gene for rust resistance linked with a RFLP marker in sugarcane cultivar “R570”[J]. Theoretical and Applied Genetics, 1996, 92: 1 059-1 064.
[6] Costet L, Le Cunff L, Royaert S, et al. Haplotype structure around Bru1 reveals a narrow genetic basis for brown rust resistance in modern sugarcane cultivars[J]. Theoretical and Applied Genetics, 2012, 125: 825-836.
[7] Glynn N C, Laborde C, Wayne Davidson R, et al. Utilization of a major brown rust resistance gene in sugarcane breeding[J]. Molecular Breeding, 2013, 31(2): 323-331.
[8] 李文凤, 王晓燕, 黄应昆, 等. 31份甘蔗野生核心种质资源褐锈病抗性鉴定及Bru1基因的分子检测[J]. 作物学报, 2015, 41(5): 806-812.
[9] 张学博. 福建省甘蔗锈病的初步调查研究[J]. 植物保护, 1990, 16(增刊): 10-12.
[10] 阮兴业, 杨 雰, 孙楚坚. 云南省发现甘蔗茅柄锈菌[J]. 真菌学报, 1983(2): 260-261.
[11] 黄应昆, 李文凤. 云南蔗区甘蔗锈病流行原因及防治对策[J]. 植保技术与推广, 1998, 18(5): 22-23.
[12] Comstock J C, Tew T L, Ferreira S A. Sugarcane Rust in Hawaii[J]. Plant Disease, 1982, 66: 1 193-1 194.
[13] Mordue J E M. Urediniospore ornamentation in the sugarcane pathogens Puccinia kuehnii and P. melanocephala[J]. Transactions of the British Mycological Society, 1985, 84(4): 758-760.
[14] Asnaghi C, Roques D, Ruffel S, et al. Targeted mapping of a sugarcane rust resistance gene(Bru1) using bulked segregant analysis and AFLP markers[J]. Theoretical and Applied Genetics, 2004, 108: 759-764.
[15] Racedo J, Perera M F, Bertani R, et al. Bru1 gene and potential alternative sources of resistance to sugarcane brown rust disease[J]. Euphytica, 2013, 191: 429-436.

