低温引起月季花朵过度重瓣化关键基因的表达及分析
田亚然 范天刚 张钢 李永红


摘 要 低温引起切花月季花朵过度重瓣化导致畸形在生产上亟需解决。以‘芬得拉(Rosa hybrida‘Vendela)为试材,以RT-PCR研究与月季花器官发育密切相关基因RhAP1, RhAP2, RhAP3, RhTM6, RhPI, RhAG, RhSHP, RhWUS在不同温度不同花芽分化时期表达量。发现过度重瓣化形成关键时期,只有RhAG表达水平相对较高,且低温下表达水平明显低于常温,相比其它基因变化最明显。本课题组推测RhAG在低温导致的过度重瓣化中可能起着主要调控作用。为深入研究,以RT-PCR结合RACE克隆到RhAG全长。其全长4 942 bp,包含7个内含子、8个外显子,开放阅读框747 bp,编码248个氨基酸,N端含保守MADS-box、K-box结构域,属MADS-box家族。洋葱表皮亚细胞定位发现其位于细胞核内,属核蛋白。上述结果对明确低温导致月季花朵过度重瓣化分子机制提供了理论依据。
关键词 切花月季;RhAG;低温;过度重瓣化;花器官发育
中图分类号 S685.12 文献标识码 A
Abstract The excessive double flowers in rose caused by low temperature, resulting to abnormal flowers needs prompt solutions in production. To use Rosa hybrida‘Vendelaas the material and take RhAP1, RhAP2, RhAP3, RhTM6, RhPI, RhAG, RhSHP, RhWUS which are closely related to rose floral organ development as the research objects. Their expression quantity at different temperature and different flower bud differentiation period were analyzed by RT-PCR technique.We found that the expression level of RhAG was higher than others at the key period of excessive double flowers in rose caused by low temperature, the expression at low temperature was much lower and its change was the most obvious. It indicated that RhAG played a major regulatory role in the excessive double flowers in rose caused by low temperature.For further research, we amplified the full length of RhAG by RACE and RT-PCR techniques.The results showed that the cloned full-length cDNA of RhAG was 4 942 bp, containing a 747 bp open reading frame(ORF)which encoded 248 amino acids. It had 7 introns and 8 exons. Protein alignment analysis showed that RhAG protein contained a MADS domain and a K domain at N terminal which indicated that RhAG was a member of MADS-box family. We used onion epidermal sub-cellular location to locate RhAG, and found that RhAG was located in cell nucleus, it was a nucleoprotein.
Key words Cut rose; RhAG; Low temperature; Excessive double flowers; Flower organ development
doi 10.3969/j.issn.1000-2561.2016.06.016
重瓣性是觀赏植物花器官重要性状[1],过度重瓣化降低观赏特性,严重影响经济效益。重瓣花起源分积累、台阁、重复、苞片、花序、雌雄蕊6种[2]。月季属雄蕊起源,重瓣和过度重瓣均源自雄蕊[3-4]。雄蕊瓣化属花器官发育范畴,符合ABCE模型[5-6],即A,E决定萼片特性,A,B,E决定花瓣特性,B,C,E决定雄蕊特性,C,E决定心皮特性。目前重瓣化分子机理研究主要集中在C功能基因突变导致下游调控因子变化导致重瓣化[7],如金鱼草C功能AG同源基因FAR的缺失突变导致雄蕊瓣化形成重瓣花[8];麝香百合(Lilium longiflorum)因C类基因向中央收缩使外轮雄蕊变成花瓣形成重瓣花[9]等。
有关环境因子对花器官同源转化影响的研究仅停留在生理方面。低于13 ℃石竹科(Caryophyllaceae)红粉雪轮花瓣增加,雄蕊减少;重瓣香雪兰高温形成单瓣花[10];月季‘芬德拉在昼/夜温15/5 ℃雄蕊显著减少,花瓣增加[4]等,其形成的分子机理尚未见报道。有关常温月季重瓣化分子机理研究取得一定进展,重瓣‘Malmaison和单瓣‘St Annes月季花器官形成不同阶段,B功能基因RhTM6,RhAP3,RhpI表达基本相似,C类唯RhAG在2个品种间有较大差异,后者转录本积累量为前者的5倍,且表达域扩展[1],表明常温月季重瓣化AG具有决定作用。但迄今为止,低温导致月季过度重瓣化分子机制仍不明确。
月季是第一大切花,过度重瓣化使品质降低80%~90%,严重影响经济效益。据EST数据库,RhAP1, RhAP2, RhAP3, RhTM6, RhPI, RhAG, RhSHP, RhWUS与月季花器官发育密切相关。AP1,AP2属A功能基因,决定萼片、花瓣特性[11-12]。AP3,TM6,PI属B功能基因[13],决定花瓣、雄蕊特性;AG是唯一C功能基因;SHP属D功能基因,控制心皮发育;WUS为顶端分生组织特征基因,维持AG活性[14]。本研究拟对比8个基因在花芽分化4个时期常温与低温表达差异,确定低温引起过度重瓣化的关键基因,对其克隆并探讨基因型,为解决月季生产瓶颈问题提供理论依据,并为花朵品质改良、分子育种提供基因储备。
1 材料与方法
1.1 材料与处理
实验自2014年9月在深圳职业技术学院进行。以生长健壮2年生‘芬得拉盆栽苗为试材,修剪后培养于Thermoline TPG-6000-TH生长室。常温(A):25 ℃/15 ℃(昼/夜);低温(B):15 ℃/5 ℃(昼/夜)。其它条件相同(光强70 μmol/(m2·s),光照时间12 h,相对湿度60%)。依据项目组前期月季花芽分化切片结果[4]对应的在不同温度下的萌芽天数和花芽直径大小确定花芽分化期,2个月后分别取萼片原基分化期(第1时期),花瓣原基分化期(第2时期),雄蕊原基分化期(第3时期),雌蕊原基分化期(第4时期)花芽,液氮速冻后-80 ℃冰箱保存。
1.2 方法
1.2.1 實时荧光定量PCR 仪器:ABI PRISMR 7500 Sequence Detection System,试剂盒:Invitrogen公司的Platinum SYBR Green qPCR Supermix-UDG。引物见表1。步骤见说明书。以RhTCTP为内参。以最小Ct值作为判定标准,对阳性标准品进行检测。反应程序:94 ℃ 2 min,94 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s,40次循环,每次循环第3步进行荧光采集,最后95 ℃ 1 min,退火至55 ℃,保温1 min,检测荧光值,绘制熔点曲线。基因表达情况采用相对标准曲线法分析。以每个基因在常温下第1时期表达量为对照,SPSS软件分析差异显著性。4个时期不同温度处理的样品均设3个生物学重复。
1.2.2 RNA的提取及cDNA的合成 步骤见pBiozol植物总RNA提取试剂盒说明书。以Super Script TMII RNaseH Reverse Transcriptase(Invitrogen)和Random Primer合成单链cDNA。反应体系和过程:0.5 μL oligo dT primers,1 μL dNTP,2 μg Total RNA,加DEPC至13 μL,70 ℃变性5 min,冰浴3 min,加4 μL 5×buffer,2 μL 0.1 mol/LDTT,反转录酶1 μL,42 ℃反应90 min,冰浴10 min。
1.2.3 RhAG基因的克隆与生物信息学分析 月季EST数据库(http://bioinfo.bti.cornell.edu/cgi-bin/rose_454/index.cgi)获得Unigene片段,Primer primer 5.0设计引物(见表1)。以cDNA为模版扩增目的基因序列。TIANGEN凝胶回收试剂盒回收纯化,连接载体pMD19-T Vector,转化DH5ɑ。PCR检测阳性克隆送华大基因测序。
ProtParam(http://web.expasy.org/protparam)在线分析氨基酸理化性质,TMHMM Serverv. 2.0蛋白跨膜性分析,PROSITE、InrerProScan预测蛋白结构及功能位点,NCBI上Blast比对,分析与其他物种同源性,MEGA5.0构建系统进化树,自展法(Bootstrap)与已报道其同源基因氨基酸序列进行进化树分析。
1.2.4 洋葱表皮亚细胞定位 Blast X比对找出RhAG全部CDS序列。用带XhoⅠ和SmaⅠ内切酶酶切位点的引物(见表1)扩增编码区序列,连接到pMD19-T载体,转化DH5ɑ,PCR检测阳性送华大基因测序。基因枪轰击法将融合表达载体导入洋葱表皮细胞中,使目的基因与绿色荧光蛋白(GFP)瞬时融合表达。Zeiss LSM510 META共聚焦显微镜下观察洋葱表皮细胞中的绿色荧光信号。
2 结果与分析
2.1 常温和低温下不同时期的基因表达分析
通过RT-PCR得到了8个基因常温下4个时期的表达量(图1)。对比发现:RhAP1,RhAP3主要在花瓣发育时期表达;RhAP2,RhTM6主要在萼片时期微弱表达;RhPI在4个时期均微弱表达,无明显差异;RhAG在第1,2时期几乎不表达,在雄蕊、雌蕊时期表达量显著升高;RhSHP主要在花瓣、雌蕊时期表达;RhWUS在第2,3,4时期均表达。由以上分析本课题组发现在月季花发育过程中,只有RhAG符合前2个时期几乎不表达,在雄蕊、雌蕊时期大量表达的特点,与重瓣花形成的关键时期特点相符。因此,常温下RhAG是重瓣花形成的关键基因。
通过SPSS分析4个时期8个基因常温、低温表达差异发现:RhAP1在1,2,3时期差异极显著(图1),在第1时期差异最明显;RhAP2在1,2,4时期差异极显著,在第2时期差异最明显;RhAP3在1,3,4时期差异极显著,在第1时期差异最明显;RhPI在1,3时期差异极显著,在第1时期差异最明显;RhAG在第3,4时期差异极显著,均很明显;RhSHP在第1时期差异极显著;RhTM6在1,2时期差异极显著;RhWUS在2,3,4差异显著。由此可见,与月季花器官发育密切相关的基因中,只有RhAG在花朵过度重瓣化形成关键时期--3,4时期在常温与低温的表达量相比其他基因变化最明显。由此推测在低温导致的过度重瓣化中RhAG可能起主要调控作用。
2.2 RhAG基因的克隆
采用Tail-PCR技术获得RhAG基因组序列。分析表明:全长4 942 bp,包含7个内含子,8个外显子,开放阅读框747 bp,编码248个氨基酸(图2),5′UTR长48 bp,3′UTR长324 bp,分子量约28.5 ku,理论等电点9.40,未发现含跨膜区域。BLAST比对发现N端含约60个氨基酸的MADS-box保守区域,在110~172氨基酸之间有一个K-box区域(图2),具MADS-box家族典型结构特征。本课题组将月季AGAMOUS基因命名为RhAG。
2.3 氨基酸序列对比和系统聚类分析
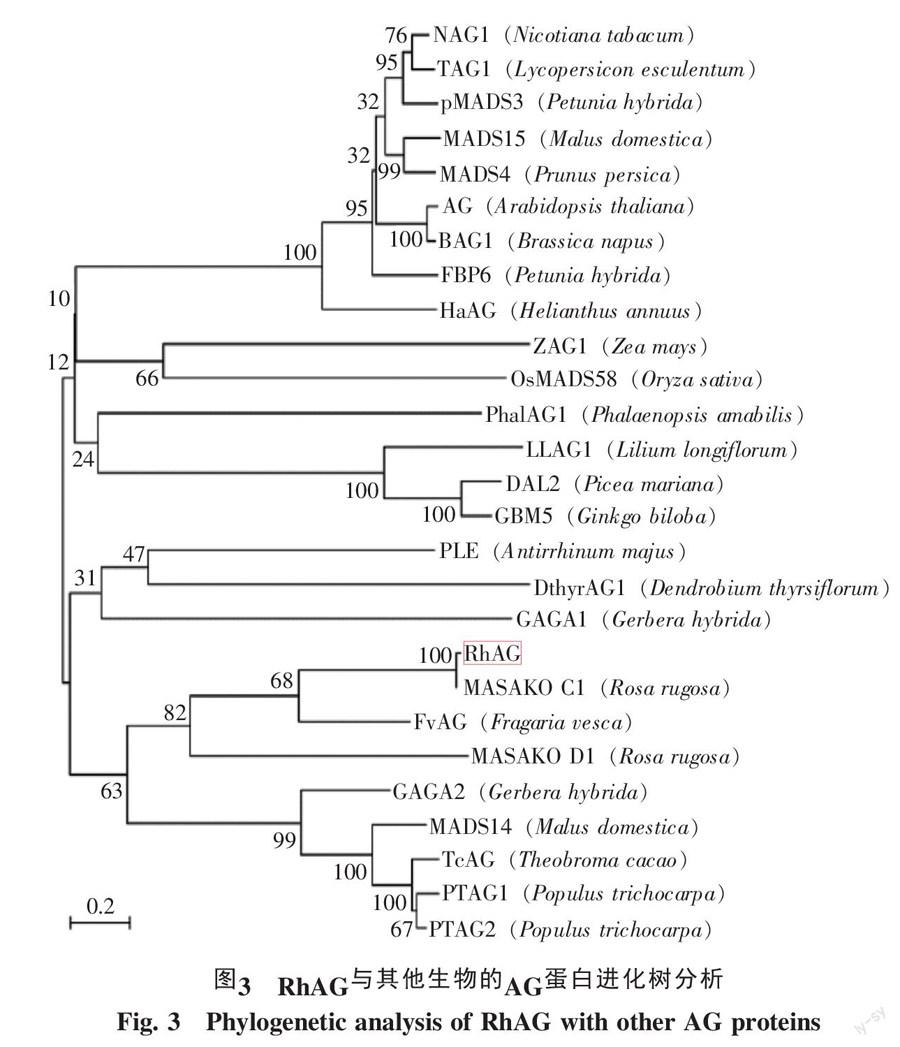
通过同源蛋白氨基酸序列比对发现RhAG和拟南芥AtAG,矮牵牛FBP6,金鱼草PLE,水稻OsMADS58,烟草NAG1,玉米ZAG1和番茄TAG1的氨基酸序列在MADS-box及K-box区域有极高相似性(图2)。MADS-box区域对于DNA结合必需,K-box区域在AG和其他MADS基因协同作用中发挥重要作用[15]。同时,利用C1uSta1X1.81软件,采用MEGA5.0将RhAG所编码氨基酸序列与已报道AG同源基因氨基酸序列进行进化树分析,发现RhAG和同属玫瑰MASAKO C1聚为一枝(98.4%);在遗传距离上,RhAG与草莓FvAG、苹果MADS14、可可TcAG、非洲菊GAGA2和毛果杨PTAG1进化距离较近(图3)。
2.4 亚细胞定位分析
细胞中蛋白质合成后被转运到特定细胞器,只有转运到正确的部位才能参与细胞的各种生命活动[15]。以没有融合目的基因的空载体pUC-SPYNE为对照,本课题组构建了绿色荧光蛋白(GFP)与RhAG的融合表达载体以检测RhAG在细胞中的具体功能部位。结果表明(图4):对照的GFP绿色荧光信号在细胞质、细胞膜、细胞核内均有分布,分布并无特异性;而融合了RhAG蛋白的RhAG-GFP在细胞内仅分布在细胞核内,这说明RhAG是核定位蛋白。
3 讨论与结论
温度是影响植物成花的关键因素,低温不仅影响花芽分化进程,而且通过影响花瓣和雄蕊等花器官的发育造成花朵畸形[16]。本研究以EST数据库得到的RhAP1, RhAP2, RhAP3, RhTM6, RhPI, RhAG, RhSHP, RhWUS 8个与月季花器官发育密切相关的基因为研究对象,通过基因时空表达分析发现,RhAG在雄蕊、雌蕊分化期表达水平相对较高,且在低温条件下表达量明显低于常温,相比其它基因变化最明显。AG是在拟南芥中发现最早的花发育调控基因,也是唯一具有C功能的同源异形基因,AG是调控雄蕊和心皮发育的转录调控因子[17],是影响雄蕊和花瓣分化的关键基因[18]。
前人研究表明,拟南芥中AG早期调控雌雄蕊发育,后期决定细胞分化,并控制花分生组织的终止[14]。在重瓣百合‘Elodie中雄蕊重瓣化程度越高,C功能基因LelAG1在花器官发育3、4轮中的表达量越低[19];日本重瓣晚樱(Prunus lannesiana)‘Albo-rosea很可能是ag突变体[20];在拟南芥中,AG缺失导致雄蕊转变为花瓣形成重瓣花,当AG 反义基因导入后则出现雄蕊、心皮转变为花瓣和花萼[21]等,都佐证了AG可能参与重瓣花形成。另外,月季花芽分化早期对温度比较敏感,花瓣数量与温度密切相关,低温会导致花朵过度重瓣化产生畸形[4,22]。而在拟南芥中bell突变体能够在温度和时间上解除对AG基因的抑制作用,因此推断AG基因的表达采用温度和时间依赖型的分子机制[23]。本研究中,本课题组从切花月季‘芬得拉花芽中分离得到RhAG基因。RhAG属于MADS-box基因,具有高度保守MADS-box区和K-box区域。通过对RhAG氨基酸序列比对分析,显示切花月季RhAG与同属玫瑰以及同科的草莓、苹果、毛果杨的C功能基因进化关系较近。同时,瞬时转化RhAG-GFP在洋葱表皮细胞中,证明其定位在细胞核内。通过对切花月季RhAG在不同温度及花器官发育各时期表达量进行分析表明,RhAG在花器官发育进程中的表达受温度的影响,并且低温导致RhAG基因表达量的降低。对低温和常温条件下RhAG基因表达量进行比较,结果显示无论在常溫还是低温条件下,花器官发育的第1,2轮中都几乎没有表达,这与前人的研究结果一致[22];在第3,4轮中,RhAG基因的表达量明显升高,但低温条件下的表达量比常温条件下显著降低。因此,低温下月季花瓣过度重瓣化导致的花朵畸形与RhAG的表达降低息息相关,但此现象是通过RhAG单基因或与其他相关基因协同影响,及低温引起切花月季过度重瓣化的基因调控网络尚需进一步研究。
参考文献
[1] 刘青林, 陈俊愉. 观赏植物花器官主要观赏性状的遗传与改良[J]. 园艺学报, 1998, 25(1): 81-86.
[2] 赵印泉, 刘青林. 重瓣花的形成机理及遗传特性研究进展[J]. 西北植物学报, 2009, 29(4): 832-841.
[3] Dubois A, Raymond O, Maene M, et al. Tinkering with the C function: a molecular frame for the selection of double flowers in cultivated roses[J]. 2010, PLoS One, 5(2): e9 288
[4] 范天刚, 张 钢, 田亚然, 等. 低温诱导切花月季过度重瓣化的形态学观察[J]. 东北林业大学学报, 2014, 42(9): 73-78.
[5] Theiβen G. Development of floral organ identity: stories from the MADS house[J]. Current Opinion in Plant Biology, 2001, 4(1): 75-85.
[6] Theiβen G, Saedler H. Plant biology: floral quartets[J]. Nature, 2001, 409(6 819): 469-471.
[7] Ludovico D, Michela O, Martin M K. The ins and outs of the rice AGAMOUS subfamily[J]. Molecular Plant, 2013, 6(3): 650-664.
[8] Kramer E M, Jaramillo M A, Distilio V S. Patter ns of gene duplication and functional evolution during the dive resification of the AGAMOUS subfamily of MADS box genes in angiosperms[J]. Genetics, 2004, 66(2): 1 011-1 023.
[9] Benedito V A, Angenent G C, Van T J M. Lilium longiflorumand molecular floral development: the ABCDE model[J]. ActaHort., 2004, 651: 83-89.
[10] Baer J, Kho Y O. An investigation into the cause of sterility in double-flowered freesia varieties and the possibility of restoring fertility[J]. Euphytica, 1971, 20(4): 493-497.
[11] Theissen G, Becker A, Rosa Di A, et al. A short history of MADS-box genes in plants[J]. Plant Molecular Biology, 2000, 42(1): 115-149.
[12] Kunst L, Klenz J E, Martinezzapater J, et al. Ap2 gene determines the identity of perianth organs in flowersof Arabidopsis thaliana[J]. Plant Cell, 1989, 1(12): 1 195-1 208.
[13] Theiβen G. Development of floral organ identity: stories from the MADS house[J]. Current Opinion in Plant Biology, 2001, 4(1): 75-85.
[14] Lohmann J U, Weigel D. Building beauty: the genetic control of floral patterning[J]. Developmental Cell, 2002, 2(2): 135-142.
[15] 林 茂. 蠟梅Cpcor413pm1基因的抗逆分析与亚细胞定位[J]. 成都: 西南大学, 2008.
[16] Harris G P, Scott M A. Studies on the glasshouse carnation: effects of light and temperature on the growth and development of the flower[J]. Annals of Botany, 1969, 33(1): 143-152.
[17]高志红, 张玉明, 王 珊, 等. 植物花发育调控基因AGAMOUS的研究进展[J]. 西北植物学报, 2008, 28(3): 638-644.
[18] Mohammed B, Annick D, Oliver R, et al. Genetics and genomics of flower initiation and development in roses[J]. Journal of Experimental Botany, 2013, 64(4): 847-857
[19] Akita Y, Nakada M, Kanno A. Effect of the expression level of an AGAMOUS-like gene on the petaloidy of stamens in the double-flowered lily ‘Elodie[J]. Scientia Horticulturae, 2011, 128: 48-53.
[20] Liu A, Zhang D, Liu D, et al. Exon skipping of AGAMOUS homolog PrseAG in developing double flowers of Prunus lannesiana(Rosaceae)[J]. Plant Cell Reports, 2013, 32(2): 227-237.
[21] Mizukami Y, Ma H. Separation of AG function in floral meristem determinacy from that in reproductive organ identitiy by expressing antisense AG RNA[J]. Plant Molecular Biology, 1995, 28: 767-784.
[22] Moe R. Factors affecting flower abortion and malformation in roses[J]. Physiologia Plantarum, 1971, 24(2): 291-300.
[23] Bao X, Franks R G, Levin J Z, et al. Repression of AGAMOUS by BELLRINGER in floral and inflorescence meristems[J]. The Plant Cell Online, 2004, 16(6): 1 478-1 489.

