海南芒果蒂腐病可可球二孢抗药性及遗传多样性分析
王萌 陈小莉 赵磊 卜小莉 王莉巧 曾宇松 杨叶

摘 要 探索海南芒果蒂腐可可球二孢(Botryodiplodia theobromae)的抗药性、培养特性及遗传多样性的关系。以区分剂量法检测30个菌株对10种杀菌剂的敏感性,采用RAPD技术对菌株的遗传多样性进行分析。研究表明,芒果可可球二孢菌株对多菌灵、甲基硫菌灵、醚菌酯、嘧菌酯、吡唑醚菌酯、苯醚甲环唑和咪鲜胺锰盐7种杀菌剂产生了抗药性,抗性菌株比率(MR和HR)分别为66.67%、70.00%、90.00%、76.67%、53.33%、20.00%和16.67%。供试菌株的培养特性存在明显差异。应用6个随机引物对共扩增出64条带,DNA多态率高达90.6%,遗传距离在0.58~0.86,芒果蒂腐病菌遗传分化较大。在遗传距离为0.65时,可分为两个群,群Ⅰ分成3个类群,共有26个菌株,群Ⅱ分成2个类群。聚合类型与菌株的抗药性表现一致。菌株的致死温度与聚合类型、抗药性有一定的关联。
关键词 芒果;可可球二孢;抗药性;RAPD分析;培养特性
中图分类号 S436.67 文献标识码 A
Abstract The objective of the present study was to reveal the relationship among fungicide resistance, culture characteristics and genetic diversity of Botryodiplodia theobromae from mango in Hainan. The resistance of 30 strains to 10 fungicides was evaluated by a distinguishing dosage method. RAPD assay was used to reveal the genetic diversity. The results showed that strains showed different level of resistance to 7 tested fungicides. The frequency of resistant strains(MR and HR) to carbendazim, thiophanate-methyl, kresoxim-methyl, azoxystrobin, pyraclostrobin, difenoconazole and prochloraz was 66.67%, 70.00%, 90.00%, 76.67%, 53.33%, 20.00% and 16.67%, respectively. The culture characteristics of the 30 strains appeared diversified. RAPD-PCR analysis showed that the genetic diversity among the tested isolates was high. A total of 64 bands were amplified by 6 RAPD primers,polymorphic bands accounted for 90.6% with genetic distance between 0.58-0.86. All the strains could be classified into 2 genetic groups at the genetic distance of 0.65. Cluster Ⅰcould be classified into 3 subgroups, and cluster Ⅱ could be classified into 2 subgroups. The resistance of the strains showed significant correlation with the RAPD groups. The RAPD groups, fungicide resistance correlated with the lethal temperature.
Key words Mango;Botryodiplodia theobromae;Fungicide resistance;RAPD analysis;Culture characteristics
doi 10.3969/j.issn.1000-2561.2016.07.019
芒果蒂腐病主要为害芒果果实,导致芒果在贮藏、运输期间严重腐烂,造成严重的经济损失。据报道,有10多种真菌可引起芒果蒂腐病,部分真菌为混合侵染[1-2],海南芒果蒂腐病主要是由可可球二孢菌(Botryodiplodia theobromae,异名: Lasiodiplodia theobromae)引起,该病菌在世界各芒果种植地均有发现[3-4]。可可球二孢还可引起500多种植物病害的发生,除了造成果实腐烂,还可引起致苗枯和枝条枯死[5]。此外,该病菌具有潜伏侵染的特性,病菌早在田间就已侵染芒果果实,在采后贮藏运输期间才发病,造成果实腐烂,带来严重的经济损失。
海南芒果产量、种植面积皆位居全国首位,然而病害的发生严重制约着芒果产业的发展。在芒果种植期间及采收后均大量应用苯并咪唑类(BMZs)等杀菌剂防治病害。2009年就有芒果可可球二孢(B.theobromae)对多菌灵、甲基硫菌灵、醚菌酯和烯唑醇等杀菌剂产生抗药性的报道[6],2014年,本课题组从海南采集分离到大量对多菌灵等杀菌剂存在抗药性的可可球二孢菌株[7]。目前,有关芒果可可球二孢遗传多样性方面的研究没有报道,而病菌的抗药性与遗传分化、培养特性与群体遗传结构方面的研究工作,对于深入了解病菌具有重要的作用。因此,本研究针对海南芒果可可球二孢抗药性与菌株培养特性、遗传变异的相互关系加以探讨,探索杀菌剂的使用对病原菌群体遗传多样性的影响,以期为芒果蒂腐病的综合防治提供科学依据。
1 材料与方法
1.1 供试材料
供试的30个芒果可可球二孢菌株均为单孢分离物,其中,乐东菌株14个、三亚菌株11个、昌江菌株5个。
供试10种杀菌剂,分别是:瑞士先正达作物保护有限公司的丙环唑(25%乳油)、苯醚甲环唑(10%水分散粒剂)和嘧菌酯(25%乳油);拜耳作物科学有限公司的咪鲜胺锰盐(50%可湿性粉剂)、戊唑醇(43%可湿性粉剂)和异菌脲(50%悬浮剂);德国巴斯夫的吡唑醚菌酯(25%乳油)和醚菌酯(50%乳油);四川国光农化股份有限公司的多菌灵(50%可湿性粉剂)和江苏龙灯化学有限公司的甲基硫菌灵(70%可湿性粉剂)。
本试验采用20条RAPD引物的合成序列如表1,由上海生工生物工程有限公司合成;10×Mix、琼脂糖、50×TAE均购自上海生工。
1.2 方法
1.2.1 杀菌剂敏感性测定 采用生长速率法,针对30个芒果可可球二胞菌株对10种杀菌剂的敏感性进行初步检测。将供试菌株于28 ℃培养4 d后,在菌落边缘打取菌饼(ф=5 mm),分别移到含药PDA平板中央,每个药剂处理各有3个皿,28 ℃培养36 h后,以十字交叉法测量菌落直径。试验重复3次,计算平均值。参照Byungsup[8]和匡静等[9]的方法以10和100 mg/L为区分剂量;结合吴永官等[10]的方法进行抗性等级的划分:在含10 mg/L(质量浓度)的PDA上菌落直径小于空白对照的40%为敏感菌株(SS);在10 mg/L的PDA上菌落直径大于空白对照的40%,但在100 mg/L的PDA上菌落直径小于空白对照的40%为中等抗性菌株(MR);在100 mg/L的PDA上菌落直径超过空白对照的40%为高抗菌株(HR)。测定甲氧基丙烯酸酯类杀菌剂的敏感性时,含药培养基中还加入150.0 mg/L的水杨肟酸以降低旁路呼吸途径对该类杀菌剂的影响。
1.2.2 培养特性和致死温度测定 将菌饼接种到PDA培养基,每个处理重复3次,自然光照,28 ℃培养36 h,用十字交叉方法测量菌落的直径。培养20 d,每皿(9 cm)加入10 mL 0.1%吐温80的无菌水,轻轻将琼脂表面的孢子刮下,将该孢子悬浮液置于已灭菌烧杯内、振荡混匀制成孢子悬浮液,用血球板计数器计算产孢量。采用琼脂玻片法测定孢子的萌发率[11],于28 ℃、黑暗条件下培养4.5 h后观察计算孢子的萌发情况,每个菌株测量300个孢子。
菌丝致死温度的测定:在含3 mL无菌水的试管中加入菌饼(Ф=5 mm),分别置于50、52、54、56、58、60、62、和64 ℃的恒温水浴锅,每个温度3个试管,每个试管在处理10 min后用冰水迅速冷却,然后再将菌饼接种于PDA平板中央,再置于28 ℃培养,3 d后观察菌丝生长情况。
1.2.3 菌株基因组DNA的提取及PCR扩增 从培养3 d的菌落边缘挑菌丝约0.3 g于1.5 mL的离心管中,采用CTAB法提取菌株基因组DNA备用。PCR 扩增体系为20.0 μL,其中 1.0 μL随机引物,10.0 μL 2×PCR通用Mix,1.0 μL DNA,余下体积以超纯水补齐20.0 μL。PCR 扩增条件为 94 ℃预变性2 min 后进入循环,94 ℃变性1 min, 36 ℃复性1 min,72 ℃延伸2 min,共40个循环,后72 ℃延伸 10 min,4 ℃保存。扩增反应完毕后进行2%琼脂糖凝胶电泳,稳压50~100 V,在紫外凝胶成像系统上观察并拍照。
1.3 数据分析
采用SPSS 20.0分析软件,采用Duncans新复极差法统计分析。按电泳结果对DNA 条带的有无分别赋值“1”或“0”并进行统计,利用NTSYS-PC2.10e分析软件进行两两菌株间的遗传相似系数分析,并构建UPGMA 聚类分析树状图。
2 结果与分析
2.1 对杀菌剂的敏感性
供试30菌株对10种药剂初步检测结果表明,海南芒果可可球二孢对苯并咪唑类杀菌剂存在严重抗药性,高抗菌株数量超过50%,对多菌灵敏感(SS)、中抗(MR)及高抗(HR的菌株分别占33.33%、6.67%和60.00%,抗药性菌株共有20个;对甲基硫菌灵敏感(SS)、中抗(MR)及高抗(HR的菌株分别占30.00%、10%和60.00%,抗药性菌株共有21个,病菌对两种杀菌剂均表现出抗药性(表2)。该病菌对甲氧基丙烯酸酯类杀菌剂的抗性也非常突出,对醚菌酯敏感(SS)、中抗(MR)及高抗(HR)的菌株分别占10.00%、40.00%和50.00%,抗药性菌株共有27个;对嘧菌酯敏感(SS)、中抗(MR)及高抗(HR的菌株分别占23.33%、26.67%和50.00%,抗药性菌株共有23个;对吡唑嘧菌酯敏感(SS)、中抗(MR)及高抗(HR)的菌株分别占46.67%、36.67%和16.67%,抗药性菌株共有16个。供试芒果可可球二孢菌株对甾醇生物合成抑制剂的抗性与前面两类杀菌剂相比,抗性菌株少且抗性水平低,对苯醚甲环唑表现中抗菌株有6株,占20%;咪鲜胺锰盐的抗菌株5个,占16.67%;其中,戊唑醇和丙环唑没有发现抗性菌株。二甲酰亚胺类杀菌剂异菌脲也没有发现抗性菌株。
2.2 培养特性
芒果可可球二孢菌丝生长速度很快,在PDA培养基上一般40 h后可长满直径为9 cm的培养皿,培养36 h多数菌株的菌落直径在5~6 cm之间,部分菌株之间存在显著差异(p<0.05)(表2)。培养20 d后,不同菌株之间的产孢量差异很大,产孢量在3.0×106~156.37×106之间,最高产量与最低产量相差52倍,菌株之间存在明显差异(p<0.05)。总的来说,芒果可可球二孢菌株具有很高的萌发率,培养4.5 h有25个菌株萌发率在71.0%~90.1%之间。试验表明,不同菌株的致死温度的差异也很大,在52~64 ℃之间。
从表2可以看出,菌株产生抗药性与菌株的培养特性并没有直接的联系。但是,不同菌株致死温度的差异与菌株的抗药性水平表现出一定的规律,如:对多菌灵、甲基硫菌灵、醚菌酯和嘧菌酯4种杀菌剂均表现为高抗的菌株有7个,致死温度在60~64 ℃之间,对高温表现出较高的耐受性;而对多菌灵和甲基硫菌灵均表现为敏感的菌株有9个,其中,有6个菌株的致死温度在52~54 ℃之间,另外3个菌株SYTN72601、YM11602和TN11002的致死温度分别为64、58和60 ℃,但它们对醚菌酯和嘧菌酯表现为高抗。
2.3 RAPD分析
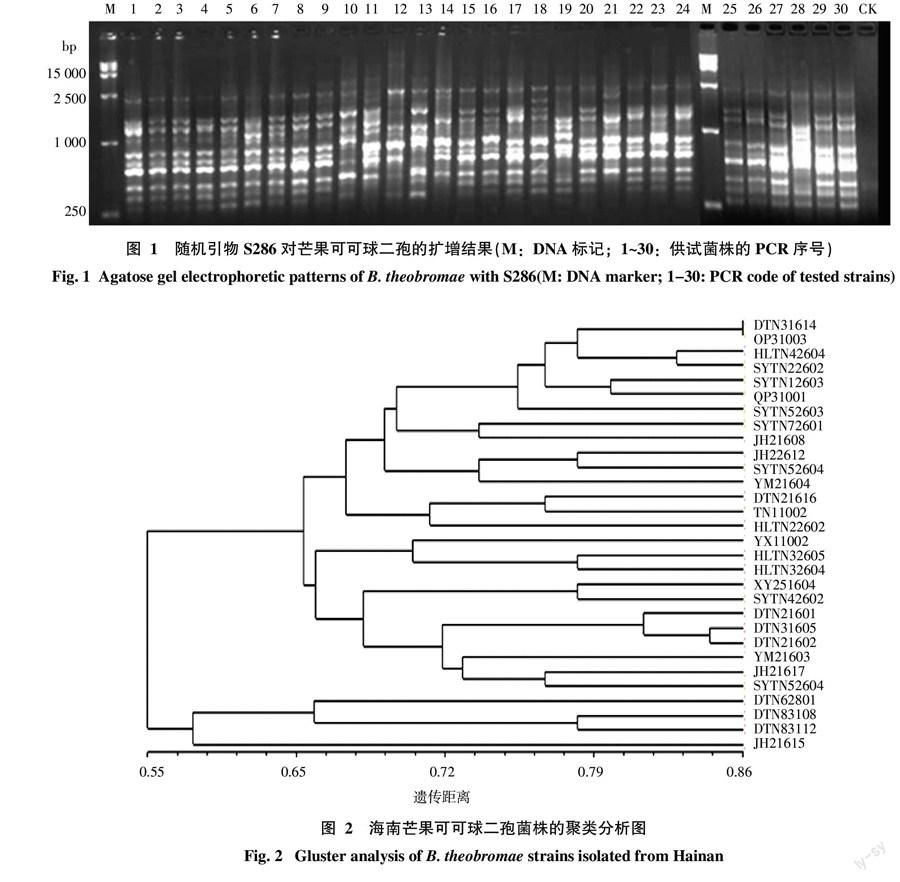
2.3.1 菌株 RAPD 扩增结果及聚类分析 以来源、培养性状、抗药性等有差异的4个菌株基因组DNA为模板,从20个10碱基的随机引物中筛选出OPE-15、OPP-06、S286、OPQ-05、OPP-02、OPT-05 6个随机引物,对30个菌株进行RAPD分析。这6个引物扩增的DNA片断具有清晰、带型稳定、条带多、多态性好及扩增重复性好的特点。6个引物对30个芒果可可球二孢菌株进行PCR扩增,共产生64条清晰的条带,58条具多态性,多态率达90.6%。不同菌株RAPD扩增产物有8~12条带,集中在250~2 500 bp(图1),其中主条带6~9条,平均每条引物的条带数10.7条。表明海南芒果可可球二孢菌株之间具有丰富的DNA多态性。
用NTSYS 软件对扩增出的64条多态性条带构建UPGMA树状图(图2),30个菌株的遗传距离在0.58~0.86之间,在遗传距离0.58水平上被聚为一类,说明海南省芒果可可球二孢病菌遗传分化明显,群体遗传结构多样性比较复杂。遗传距离为0.65时,所有供试菌株分为两个群,群Ⅰ分又成3个亚群,共有26个菌株,群Ⅱ分成2个亚群,仅有4个菌株。
2.3.2 抗药性结合遗传多样性分析 研究结果表明,芒果可可球二孢菌株的抗药性和遗传基础有很大的同步关系。群Ⅱ共有4个菌株,均对多菌灵和甲基硫菌灵表现敏感;群Ⅰ中多数菌株表现为抗药性,抗性菌株比率为69.2%,群Ⅰa中抗性菌株比率为73.3%,群Ⅰc中抗性菌株比率为75.0%;对多菌灵抗性水平最高的4个菌株(抑制率小于10%)均出现在群Ⅰa,对嘧菌酯抗性水平最高的5个菌株(抑制率小于20%)有4个在其群Ⅰa,供试菌株中,DTN31605和DTN21602亲缘关系很近,在高水平0.837上被聚为一类,说明这两个菌株遗传基础相似,它们对多菌灵、甲基硫菌灵、醚菌酯、嘧菌酯和吡唑嘧菌酯均表现为抗药;菌株HLTN42604和SYTN22602在高水平0.826上被聚为一类,对多菌灵、甲基硫菌灵均表现为抗药,对嘧菌酯、嘧菌酯均为敏感。因此,上述菌株遗传物质基础的差异可能是导致菌株产生抗药性的因素之一。
2.3.3 培养特性结合遗传多样性分析 从表2可以看出,不同菌株在菌丝的生长速率、产孢量及孢子萌发率等方面均存在较大的差异,通过上述培养特性结合遗传多样性分析表明,菌株在培养特性的差异与遗传物质基础并没有太大的相关性。供试芒果可可球二孢菌株的致死温度对病菌遗传差异存在一定的关系,群Ⅰ中不同菌株致死温度差异大,在52~64 ℃,其中群Ⅰb的3个菌株致死温度在52~54 ℃,比较一致;群Ⅱ中所有菌株的致死温度差异较小,在52~56 ℃。
3 讨论与结论
利用RAPD分子标记方法对30个芒果可可球二孢病菌遗传多样性分析表明,30个供试菌株的遗传分化较大,群体结构多样性丰富。海南各地收集的菌株的生长速度及孢子萌发都很快,这跟该菌在田间具有很强的生存竞争力有关。不同菌株在菌丝生长速率、产孢能力、分生孢子萌发能力及对温度的敏感性方面有明显的差异,但它们之间没有相关性。Sangeetha等[12]对香蕉可可球二孢的研究表明,从不同香蕉品种分离到的菌株,形态、颜色及孢子均存在明显差异,RAPD标记显示菌株间遗传多样性丰富,聚类分析与菌株来源有明显的相关性。菌株聚合类型与生长速率、产孢量及孢子萌发率并不一致,在每个基因类群里菌株都包含生长速率慢或快、产孢量少或多的菌株。
大量研究表明,苯并咪唑类杀菌剂存在高抗性风险,是现有杀菌剂中抗性最为严重的药剂,抗性机制主要是病菌β-微管蛋白基因发生突变所致[13-15];甲氧基丙烯酸酯类杀菌剂是线粒体呼吸抑制剂,同样存在很高的抗性风险,抗性机制为细胞色素b基因(Cyt b)发生突变所致[16-18]。夏烨等[19]用RAPD随机引物筛选出对三唑酮具有不同敏感性小麦白粉病菌株(Bulmeria graminis f. sp. tritici)的抗药性DNA分子标记。朱志成[20]则通过RAPD分析获得与病菌对三唑酮敏感性相关的标记,为进一步小麦白粉菌对三唑酮不同抗性建立起分子鉴定体系奠定基础。本研究采用RAPD遗传多样性分析表明,各菌株对多菌灵等杀菌剂的敏感性和遗传基础有很大的同步关系,遗传物质基础的差异可能是导致菌株产生抗药性的重要因素。供试菌株对两类药剂的抗药性即存在一致,又存在差异,并且遗传物质的差异也呈现出多样性和复杂性,表明遗传差异与病菌不同抗药性密切相关。海南地区的芒果可可球二孢菌株因抗药性不同而表现出遗传多态性的差别,这种差别应该与芒果用药历史及用药水平有关,意味着海南在芒果上频繁大量的用药导致病菌对多种杀菌剂产生抗药性并关联表现出遗传变异。
本项目针对病菌群体抗药性、温度敏感性和遗传多样性关系的研究表明,可可球二孢的遗传多样性和病原菌抗药性之间具有明显的关系。菌株的培养特性及抗药性是影响海南可可球二孢病菌遗传多样性的主要因素,在病菌的遗传变异以及病菌对杀菌剂的抗性方面起重要的作用。鉴于海南芒果可可球二孢对苯并咪唑类杀菌剂及甲氧基丙烯酸酯类杀菌剂均产生较为严重的抗药性,建议在海南芒果产区暂停使用苯并咪唑类及甲氧基丙烯酸酯类杀菌剂,可改用作用机制不同的异菌脲、戊唑醇和丙环唑等杀菌剂交替轮换使用。
参考文献
[1] 邓泽明, 胡美姣, 白菊仙, 等. 海南省杧果蒂腐病病原菌的初步研究[J]. 中国南方果树, 2002, 31(4): 39-41.
[2] Johnson G, Cooke T, Mead A. Infection and quiescence of mango stem-end rot pathogens[J]. Acta Horticulure, 1993, 341: 329-336.
[3] Hong S K, Lee S Y, Choi H W, et al. Occurrence of stem-end rot on mango fruits caused by Lasiodiplodia theobromae in Korea[J]. The Plant Pathology Journal, 2012, 28(4): 455.
[4] Serrato-Diaz L M, Perez-Cuevas M, Rivera-Vargas L, et al. First Report of Lasiodiplodia theobromae Causing Inflorescence Blight of Mango[J]. Plant Disease, 2013, 97(10): 1 380.
[5] Sakalidis M L, Ray J D, Lanoiselet V, et al. Pathogenic Botryosphaeriaceae Associated with Mangifera indica in the Kimberley Region of Western Australia[J]. European Journal of Plant Pathology, 2011, 130(3): 379-391.
[6] 胡美姣, 师 超, 安 勇, 等. 杧果蒂腐病菌对多菌灵的抗药性测定及其杀菌剂筛选[J]. 果树学报, 2009, 26(5): 671-677.
[7]王 萌, 陈小莉, 杨 叶, 等. 海南芒果蒂腐病对8种杀菌剂的抗药性测定[J]. 农药, 2015, 54(5): 289-291.
[8] Byungsup K, Eunwoo P, Yun C K. Population Dynamics of Sensitive and Resistance Phenotypes of Botrytis cinereato Benzimidazole, Dicarboximide and N-phenylcarbamate Fungicides in Korea[J]. Journal of Pesticide Science, 2000, 25(4): 385-386.
[9] 匡 静, 王建新, 周明国. 江苏省油菜菌核病菌对多菌灵和菌核净的抗药性监测[J]. 中国农学通报, 2011, 27(15): 285-291.
[10] 吴永官, 陆少峰, 黄思良, 等. 华南地区瓜类疫霉对甲霜灵的田间抗药性[J]. 微生物学报, 2011, 51(8): 1 078-1 086.
[11] 孙广宇, 宗兆锋. 植物病理学实验技术[M]. 北京: 中国农业出版社, 2002.
[12] Sangeetha G, Anandan A, Usha Rani S. Morphological and molecular characterisation of Lasiodiplodia theobromae from various banana cultivars causing crown rot disease in fruits[J]. Archives of Phytopathology and Plant Protection, 2012, 45(4): 475-486.
[13] Yarden O and Katan T. Mutations leading to substitutions at amino acides 198 and 200 on beta-tubulin that correlates with benomyl resistance phenotypes of fied strains of Botrytis cinerea[J]. Phytopathology, 1993, 83: 850-854.
[14] 周明国, 叶钟音, 刘经芬. 杀菌剂抗性研究进展[J]. 南京农业大学学报, 1994, 17(3): 33-41.
[15] Ma Z H, Yoshimura M A, Holtz B A, et al. Characterization and PCR-based detection of benzimidazole-resistant isolates of Monilinia laxa in California[J]. Pest Management Science, 2005, 61(5): 449-457.
[16] Gisi U, Sierotaki H, Cook A, et al. Mechanisms infucncing the evolution of resistance to Qo inhibition fungicides[J]. Pest Management Science, 2002, 58: 850-867.
[17] Grasso V, Palermo S, Sierotzki H, et al. Cytochromeb gene structure and consequences for resistance to Qo inhibitor fungicides in plant pathogens[J]. Pest Management Science, 2006, 62(6): 465-472.
[18] 赵 平, 严秋旭, 李 新, 等. 甲氧基丙烯酸酯类杀菌剂的开发及抗性发展现状[J]. 农药, 2011, 50(8): 5 47-551, 572.
[19] 夏 烨. 小麦白粉菌对杀菌剂敏感性测定及不同敏感性菌株RAPD标记[D]. 哈尔滨: 东北农业大学, 2003.
[20] 朱志成. 对三唑酮不同敏感性小麦白粉菌菌株的RAPD分子检测[D]. 长春: 吉林农业大学, 2005.

